Wnt4、Wnt7a在不同程度脊髓损伤小鼠中的差异表达
高 敏,段 娟
(暨南大学粤港澳中枢神经再生研究院,广东广州510632)
Wnt信号在神经系统发育过程中极为关键,根据激活的下游途径分为经典Wnt信号及非经典Wnt信号。Wnt2b/4/5a/6/7a做为非经典信号分子可激活下游多个非经典Wnt信号通路,其中PCP通路为非经典Wnt信号的下游通路之一。PCP核心蛋白由多次跨膜蛋白Frizzled(Fzd)、Celsr、Vangl及胞浆蛋白Prickle、Diego组成膜复合受体。PCP通路在调节细胞极性排列、神经迁移及成熟,在轴突导向及树突形成过程发挥关键作用。在脊髓发育过程中,非经典Wnt信号分子引导神经嵴细胞穿越中线向对侧迁移形成痛觉神经元。在脊髓A-P轴中非经典Wnts呈现特定的浓度梯度,对Fzd3介导的脊髓背侧连合神经元轴突沿A-P轴导向至关重要[1]。但在成熟脊髓及其损伤后,非经典Wnt及PCP核心基因表达情况及作用并不清楚。本研究观察不同程度脊髓损伤后小鼠感觉及运动功能变化以及非经典Wnt基因(Wnt2b、Wnt4、Wnt5a、Wnt6、Wnt7a)基因、PCP核心基因(Fzd3、Fzd6、Vangl1、Vangl2、Celsr3)表达变化,为研究非经典Wnt信号在脊髓损伤后分子水平的调控机制提供前期基础。
1 材料与方法
1.1 动物
所有实验均使用8~10周龄,体质量17~23 g的成年雌性C57BL/6J小鼠60只,由广东省动物中心提供,随机分为对照组和实验组(SCI 0.65组和SCI 0.45组),每组20只。所有实验动物的饲养与管理都在暨南大学动物伦理委员会的指导和批准下进行。
1.2 方法
1.2.1 建立小鼠脊髓损伤(SCI)模型 按照0.02mL/g通过腹腔射的方式用三溴乙醇深度麻醉小鼠3 min,小鼠麻醉良好后,背部剃毛,俯卧置于操作台上,常规碘伏消毒。在T10行椎板切除术,暴露硬脊膜包裹的脊髓[2]。将LISA脊髓撞击器调整至深度为0.45 mm和0.65 mm,时间0.35 s,平均撞击力为1.25牛顿进行撞击,Sham组动物只进行T10处椎板切除但不损伤其脊髓。实验组小鼠脊髓被打击后尾巴翘起,随后下垂。依次缝合皮下组织与皮肤。手术场所及所用器械均经严格消毒。待动物麻醉苏醒后将其分笼饲养,术后应用抗生素(硫酸庆大霉素)3 d预防感染;每天进行两次膀胱按摩挤尿。
1.2.2 运动功能恢复 脊髓损伤前及损伤后第1 d开始每隔两天直至术后42 d对小鼠进行BMS评分评估[3]。采用双盲法观察,对每只小鼠至少观察5 min。BMS评分总计0~9分。
1.2.3 Von Frey测试 造模后待小鼠后肢功能恢复具有缩足、甩足能力,在第28、35、42天,将小鼠放置在金属丝网平台上的有机玻璃小室(长:8.5 cm,高:4 cm,宽:4 cm)中使其适应2 h。使用一系列范围(0.04~2.00 g)不同弯曲力的细丝垂直于小鼠右后足底给予刺激,直到细丝刚弯曲并保持5 s或后肢撤回。每根细丝对每只小鼠足底重复刺激5次并记录其撤足的次数。在刺激的过程中小鼠的后肢快速撤回或舔脚记为阳性刺激反应,否则为阴性反应。从0.4 g细丝开始,如果0.4 g细丝在5次试验中引发3次阳性反应,则将测试小鼠的刺激程度向下移动至0.04 g细丝,如果0.4 g细丝没有引起3个阳性反应,则将测试小鼠的刺激程度向上移动至2.0 g细丝,记录被每根细丝刺激后小鼠的撤足或舔脚次数。每只小鼠平均刺激间隔为2~3 min。5次试验中至少有3次阳性反应的最低力度的细丝被定义为该小鼠的机械性痛觉阈值[4]。
1.2.4 冷热板测试 将冷热板(IITC Life Sciences)的起始温度设置为30℃,温度每分钟升高或者降低10℃[5]。分别用小鼠舐足底和跳跃来判定它们对热和冷的反应。在刺激试验开始之前,将每只小鼠放在30℃金属板上适应30~60s,之后开始试验,记录小鼠舔脚(热)或跳跃(冷)时板的温度。使用0℃(冷刺激)和60℃(热刺激)的自动截止温度来避免小鼠足底受到损伤。
1.2.5 CatWalk测试 使用CatWalk 9.0步态分析系统(Noldus)评估小鼠运动状态及四肢协调性。在进行测试前,提前一天将小鼠放置在跑道上适应。测试时,小鼠在玻璃跑道上来回行走,同时跑道上出现的足迹会被跑道下面的摄像头记录。数据收集的标准是:小鼠每次步行在0.5~10 s之间,步行速度变化小于60%[3]。每只小鼠在跑道上来回至少跑3次后取平均值进行分析。
1.2.6 Real-time PCR法检测非经典Wnt通路基因和PCP通路基因的mRNA表达水平 SCI后第1、3、7、14、21、42天后将小鼠断颈处死迅速取出小鼠脊髓损伤节段和L 4-5节段。用TRIzol试剂(Invitrogen)抽提总RNA,反转录合成cDNA。通过RT-PCR分析6个非经典Wnt基因和5个PCP基因的表达。反应条件为:预变性95℃30 s,变性94℃1 min,退火56℃1 min。延伸72℃90 s,循环35次;72℃延伸10 min。Wnt非经典配体和PCP基因表达的引物列于表1中。使用2-ΔΔCT方法计算相对mRNA水平。
1.3 统计学分析
结果采用GraphPad Prism进行统计学分析,所有数据均以均值±标准误(X±S)表示,BMS评分、Von Frey测试和冷热板测试采用双因素方差分析(two-way ANOVA),其他数据多组间比较采用单因素方差分析(one-way ANOVA),P<0.05被认为有统计学差异。

表1 Real-time PCR分析中所用的特异性引物序列Table 1 Sequences of gene-specific primers used for real-time PCR
2 结果
2.1 SCI程度越深小鼠后肢运动功能恢复越差
SCI后第1天,所有小鼠的运动功能几乎完全丧失(BMS评分为0或1)。SCI后1 d至42 d运功功能开始恢复,SCI 0.65组各时间点BMS评分均低于SCI 0.45组(F=4.491,P=0.0402),在第7、10、25、42天差异具有统计学意义(P<0.05,图1A)。SCI后42 d对后脚掌着地的小鼠进行CatWalk测试发现损伤组的四肢协调率(regularity index)低于Sham组(F=13.05,P=0.0016),SCI 0.45组与SCI 0.65组相比差异无统计学意义(图1B),SCI 0.45组的步态规律性优于SCI 0.65组(图1C)。
2.2 SCI程度越深小鼠对机械痛感觉越明显
SCI后28 d,小鼠的运动功能恢复,后足受刺激后有所反应。SCI后的第28、35、42天对小鼠后肢进行Von Frey测试和冷热板测试。在第28天(F=24.42,P <0.0001)、35天(F=61.3,P< 0.0001)、42天(F=149.5,P <0.000 1),SCI小鼠对纤毛刺激阳性反应次数与sham组相比增加,SCI 0.65组的撤足次数高于SCI 0.45组且有统计学差异(P<0.01,图2A),随着时间的增长曲线向左移。SCI 0.45组的机械阈值高于SCI 0.65组(F=50.01,P<0.000 1),在第35、42天差异有统计学意义(P<0.01)。说明损伤程度深的小鼠对机械刺激更敏感(图2B)。冷热板测试表明从损伤后第28天开始至42天,冷板阈值逐渐降低及热板阈值逐渐升高,损伤组相比Sham组显著升高(P<0.05),但损伤组之间差异无统计学意义,说明小鼠对冷热的敏感度随时间的推移逐渐加强(图2C)。综上所述,SCI程度越深小鼠的机械性疼痛越严重。
2.3 不同损伤程度小鼠损伤部位PCP基因和非经典Wnt基因的表达不同

图1 不同SCI程度对小鼠后肢运动功能恢复的影响Fig.1 Recovery of hindlimb motor function in mice with different degrees of SCI

图2 不同SCI程度对小鼠机械痛及冷热痛的影响Fig.2 Mechanical allodynia and thermal hyperalgesia in mice with different degrees of SCI
SCI后42 d,取小鼠脊髓损伤节段和L4-L5节段检测PCP基因和非经典Wnt基因mRNA的表达情况。在损伤部位,各组小鼠均不表达Celsr3、Wnt6;与Sham组相比,SCI后小鼠Fzd3、Fzd6、Vangl1、Vangl2、Wnt2b、Wnt5a表达无差异。与 Sham组相比,SCI 0.65组Wnt4显著上调(t=4.746,P=0.002 1)、Wnt7a显著下调(t=4.636,P=0.001 7,图3A、B)。在L4-L5节段脊髓,所有检测基因表达在各组之间均无差异(图4A、B)。

图3 不同程度SCI后非经典Wnt基因和PCP基因在小鼠损伤部位的表达差异Fig.3 The expression of Wnt/PCP signaling pathway related genes at the injury site after different degrees of SCI
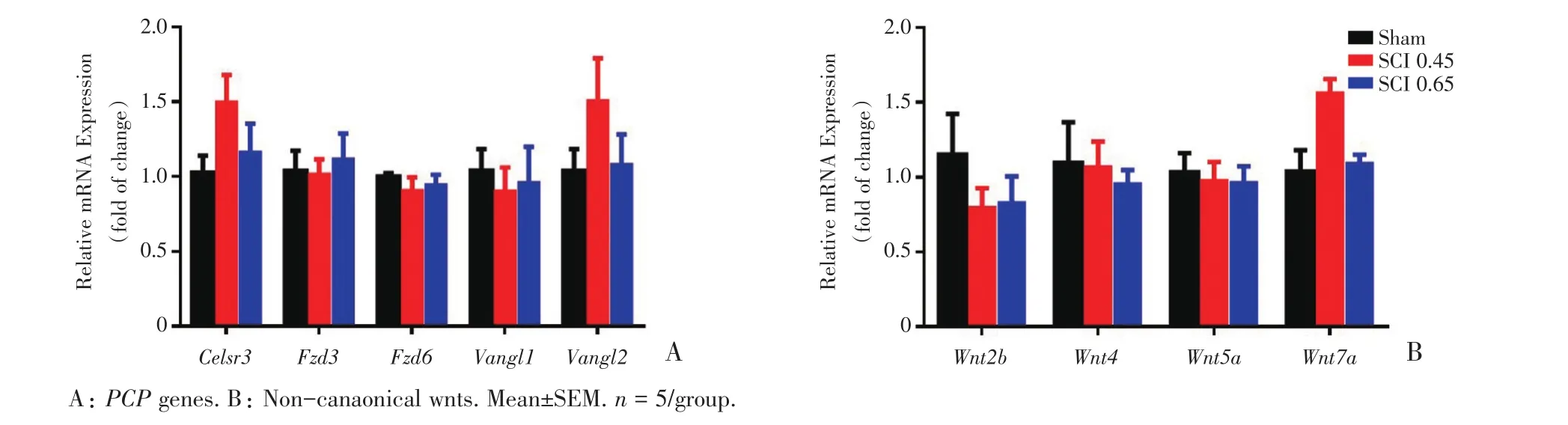
图4 不同程度SCI后非经典Wnt基因和PCP基因在小鼠L4-5部位的表达差异Fig.4 The expression of Wnt/PCP signaling pathway related genes at L4-5 after different degrees of SCI
2.4 SCI后损伤部位Wnt4和Wnt7a出现暂时性表达下调
在SCI后42 d,Wnt4和Wnt7a仅在脊髓损伤节段出现表达变化,而在L4-L5节段表达未发生改变,提示Wnt4和Wnt7a主要参与脊髓损伤后损伤部位的神经元和微环境的调控。之前的研究显示脊髓横切伤模型中Wnt相关基因在损伤后两周内出现表达改变,因此我们进一步研究了非经典Wnt信号通路相关基因在SCI后短期是否同样出现表达水平的改变。CatWalk检测显示SCI 0.45组和SCI 0.65组运动功能恢复无显著性差异(图1B),SCI 0.65组属于重度脊髓损伤,手术中及术后死亡率高(40%)且护理困难,目前的脊髓撞击损伤模型通常采取中度损伤模型(如0.45 mm)[2-3],因此我们选取SCI 0.45组小鼠进行术后不同时间点的表达变化分析。Dunnett′s检验分析表明,Wnt4在SCI后第1、3、7天表达下调,第1天(q=2.875,P=0.029 1)、3 d(q=2.946,P=0.024 2)、7 d(q=3.312,P=0.009 0)差异具有统计学意义,随后在第14、21、42天回调至正常水平。Wnt7a在SCI后第1天(q=3.324,P=0.008 8)、3天(q=3.709,P=0.002 9)、7天(q=4.928,P=0.000 1)、14天(q=5.294,P=0.000 1)、21天(q=4.432,P=0.000 3)表达显著下调(P<0.05),在42天时回调至正常水平。Wnt5a和Vangl1在SCI后第1和3天均表达下调,分别在第1天(q=6.981,P=0.000 1;q=4.912,P=0.000 1)、3天(q=5.692,P=0.000 1;q=3.188,P=0.013 6)以及Wnt5a在7天(q=5.901,P=0.0001)差异具有统计学意义,随后在第7、14、21、42天回调至正常水平。Wnt2b和Fzd6表达无变化(图5)。Celsr3在损伤后每个时间点均不表达。

图5 SCI 0.45组小鼠损伤部位Wnt4、Wnt7a、Wnt5a、Vangl1、Wnt2b和Fzd6在SCI后不同时间点的表达Fig.5 Expression of Wnt4,Wnt7a,Wnt5a,Vangl1,Wnt2b and Fzd6 from SCI 0.45 group at dpi 1,3,7,14,21 d
3 讨论
本研究采用压缩空气驱动撞击器对脊髓暴露小鼠进行撞击来建立脊髓损伤模型[2],该模型可以精确地控制撞击的力度、撞击深度和撞击时间,具有重复性好,可模拟临床病例等优点。实验中小鼠脊髓损伤后运动功能受损且存在机械性痛觉超敏及冷热痛觉过敏典型的神经病理性疼痛表现,提示模型制作成功。同时实验发现不同程度脊髓损伤后小鼠对冷热刺激痛觉阈值无差异,而机械性痛觉超敏阈值存在差异,在重度损伤后的机械性痛觉敏感更强。
温度刺激和机械刺激感受在脊髓层面存在不同的传导通路:脊髓背角第Ⅰ和Ⅴ层接受有髓Aδ纤维传入,传递机械性痛觉;第Ⅱ层接受C纤维传入,传递冷、热、酸等刺激痛觉及非伤害性机械刺激。传递非伤害性刺激的Aβ纤维终止于第Ⅲ~Ⅴ层[6]。不同程度脊髓损伤对感觉传导通路影响表现差异,其机制复杂,目前尚不清楚。
Wnt信号通路参与感觉运动神经元、背根神经节细胞等多种神经元轴突导向,在脊髓损伤修复过程中发挥重要作用。研究表明,经典Wnt/β-catenin信号通路影响斑马鱼、七鳃鳗脊髓损伤后运动功能恢复[7-8],在电针刺激干预治疗大鼠脊髓损伤后,Wnt信号通路被激活并促进大鼠肢体功能恢复[9]。此外,非经典通路中Ryk属于轴突排斥性受体,大鼠脊髓损伤后通过注射Ryk抗体或小鼠基因敲除Ryk将增加皮质脊髓束附属分支芽生,促进前肢运动功能的恢复[10]。本实验结果显示Wnt4、Wnt7a在较轻度脊髓损伤后短期表达下调,在重度脊髓损伤后长期表达也发生了改变,表明它们可能参与脊髓损伤后的再生修复过程,但是本实验尚未通过干预Wnt4和Wnt7a的表达来研究它们对于脊髓损伤后神经功能恢复和再生的影响,因此对于它们的功能是促进损伤恢复的或是不利于损伤修复尚无法下结论,这一部分工作我们后期正在展开。Wnt4、Wnt7a在脊髓中的功能研究报道较少,有研究发现脊髓横切损伤后Wnt信号普遍被抑制,Wnt4与Wnt7a在脊髓损伤后1~14 d内表达下调[11]。与此研究结果相似,我们发现Wnt4、Wnt7a在脊髓撞击损伤后表达第1天开始减弱,分别在损伤后第14、42天恢复正常。Wnt4作为轴突重要导向分子,在发育期间导向感觉神经轴突上行和运动神经轴突下行,而在成熟脊髓损伤时被诱导抑制轴突生长[12]。在大鼠双侧坐骨神经钳压伤后对脊髓背侧感觉神经纤维移植分泌Wnt4的骨髓基质细胞可引起背根感觉神经节中央分支明显撤回[13]。此外,有研究报道Wnt4联合褪黑素可以促使牛的羊膜上皮细胞向神经元分化,并促进损伤脊髓中的神经功能恢复[14]。Wnt7a与生长锥生长,轴突分支有重要联系,体外培养的海马神经元中加入含Wnt7a的培养基能使神经元中突触素富集,促进轴突微管重构、轴突延伸和分支[15]。众多研究发现腰段脊髓参与高位脊髓损伤后下肢感觉功能改变过程,本结果L4-5节段非经典Wnt及PCP基因在损伤后均未发生改变,提示非经典Wnt信号通路可能不参与脊髓损伤后的感觉环路的调控。
同时,研究发现Wnt5a、Vangl1在脊髓损伤后1~3 d内短期下调,在第7天恢复至正常水平。Wnt5a是排斥性的轴突导向因子,在脊髓发育过程中与Ryk受体结合调控皮层轴突在胼胝体和皮质脊髓束中的投射,脊髓损伤后被迅速诱导表达[10]。Vangl1-2参与调控后脑神经元迁移的方向和路径及神经管闭合,研究发现,Ryk通过介导Vangl2在细胞膜上不对称分布,从而调控皮质脊髓束轴突向低浓度Wnt5a方向生长[16]。脊髓损伤后病理机制复杂,患者损伤后存在长期的运动功能障碍和感觉异常,Wnt4和Wnt7a在脊髓损伤后中急性期及中长期表达改变提示其可能在脊髓损伤后分子调节机制中更具有长期的影响和意义,可能成为脊髓损伤后调控神经轴突再生的新靶点,但在确切作用及其机制目前仍不十分清楚,尚需进一步的研究证实。

