唑来膦酸治疗恶性肿瘤高钙血症的临床效果及对不良反应发生的影响
何林莉
【摘要】 目的:探讨唑来膦酸治疗恶性肿瘤高钙血症的临床效果及不良反应发生。方法:选取2016年5月-2017年7月在笔者所在医院进行治疗的恶性肿瘤高钙血症患者96例,随机分为两组,对照组采取帕米膦酸二纳进行治疗,研究组采取唑来膦酸进行治疗。比较两组血钙值的变化、不良反应发生率和生命质量(QOL)评分。结果:对照组血钙值的变化明显差于研究组,研究组的不良反应发生率明显低于对照组,研究组的生命质量评分明显高于对照组,差异均有统计学意义(P<0.05)。结论:采取唑来膦酸对恶性肿瘤高钙血症进行治疗,取得了理想的临床治疗效果,具有很高的安全性,不良反应较少,有利于疾病的康复,改善生活质量,值得进一步在各大医院的临床治疗上进行推广。
【关键词】 唑来膦酸; 恶性肿瘤高钙血症; 不良反应; 生命质量
doi:10.14033/j.cnki.cfmr.2019.21.049 文献标识码 B 文章编号 1674-6805(2019)21-0-03
很多临床研究表明,高钙血症是恶性肿瘤的常见代谢并发症,临床表现为肿瘤侵犯骨骼,增强了破骨细胞活性,诱导体内骨溶解、骨吸收,导致大量骨骼钙在血内释放[1]。随着人们生活节奏的加快和饮食结构的改变,恶性肿瘤高钙血症发病率正在逐年上升,发病机制具有复杂性,大多數与患者体内维生素D3水平和前列腺素水平等有关系,该病对患者的身心健康造成一定的影响[2]。对恶性肿瘤高钙血症主要是采取药物治疗,高钙血症药物主要选取抑制肾小管对钙重吸收和减少骨吸收,帕米膦酸二纳和唑来膦酸是恶性肿瘤高钙血症主要的治疗药物[3]。而唑来膦酸是第三代双膦酸盐类药物的一种,药效起效快,易于被患者所接受[4]。本研究中,选取在笔者所在医院进行治疗的恶性肿瘤高钙血症患者96例,对唑来膦酸治疗恶性肿瘤高钙血症的临床效果及对不良反应发生的影响进行探讨,现具体报告如下。
1 资料与方法
1.1 一般资料
选取2016年5月-2017年7月在笔者所在医院进行治疗的恶性肿瘤高钙血症患者96例。纳入标准:(1)均符合恶性肿瘤高钙血症诊治标准[3];(2)凝血功能正常;(3)没有认知功能障碍病史。排除标准:(1)存在精神疾病病史;(2)心肺功能出现障碍;(3)对本研究药物有过敏现象。随机分为两组,对照组48例,男29例,女19例,年龄29~69岁,平均(47.5±0.4)岁。病程3~16个月,平均(9.7±0.4)个月。研究组48例,男31例,女17例,年龄31~68岁,平均(45.2±0.6)岁。病程1~13个月,平均(10.3±0.2)个月。两组一般资料比较,差异无统计学意义(P>0.05),存在可比性。本研究在笔者所在医院伦理委员会处经过了审核与批准。所有患者均知晓同意此次研究。
1.2 方法
1.2.1 对照组 采取帕米膦酸二纳(仁怡,南京正大天晴公司,批号:0912141、0912143、1003103)进行治疗,在住院期间对患者进行各项生命体征的监测,向患者及其家属详细的讲解关于疾病的相关知识和注意事项,当体内的血钙<3.0 mmol/L时,选取静脉注射的方式,将30 mg的帕米磷酸二钠与250 ml的5%葡萄糖静脉相融合注入患者体内,注射2 h以上;当患者体内的血钙3.0~3.5 mmol/L时,将60 mg的帕米磷酸二钠与500 ml的5%葡萄糖静脉相融合注入患者体内,注射4 h以上;当患者体内的血钙大于3.5 mmol/L时,将90 mg的帕米磷酸二钠与
750 ml的5%葡萄糖静脉相融合注入患者体内,注射6 h以上。2次/d,两周为1个疗程。
1.2.2 研究组 采取唑来膦酸(择泰,诺华公司,批号:S0024、S0142)进行治疗,在住院期间对患者进行各项生命体征的监测,向患者及其家属详细的讲解关于疾病的相关知识和注意事项,选择静脉注射的方式,将4 mg唑来膦酸与100 ml 0.9%氯化钠注射液注入患者体内,注射时间为15 min,2次/d,两周为1个疗程。
在对两组患者进行治疗前2 d内,保证两组患者拥有足够的补液量。并且在使用过程中水化、利尿,并对钙摄入进行限制。
1.3 观察指标
统计并比较两组血钙值的变化及不良反应(骨痛、肾功能异常、发热和呕吐)。专业医护人员对两组QOL(生活质量)评分进行评定,包括身体状况、行为、社会活动和自评生活质量,满分100分,分数越高表示患者的QOL越高[5]。
1.4 统计学处理
数据应用SPSS 20.0进行分析,计量资料以(x±s)表示,采用t检验,计数资料以率(%)表示,采用字2检验,P<0.05为差异有统计学意义。
2 结果
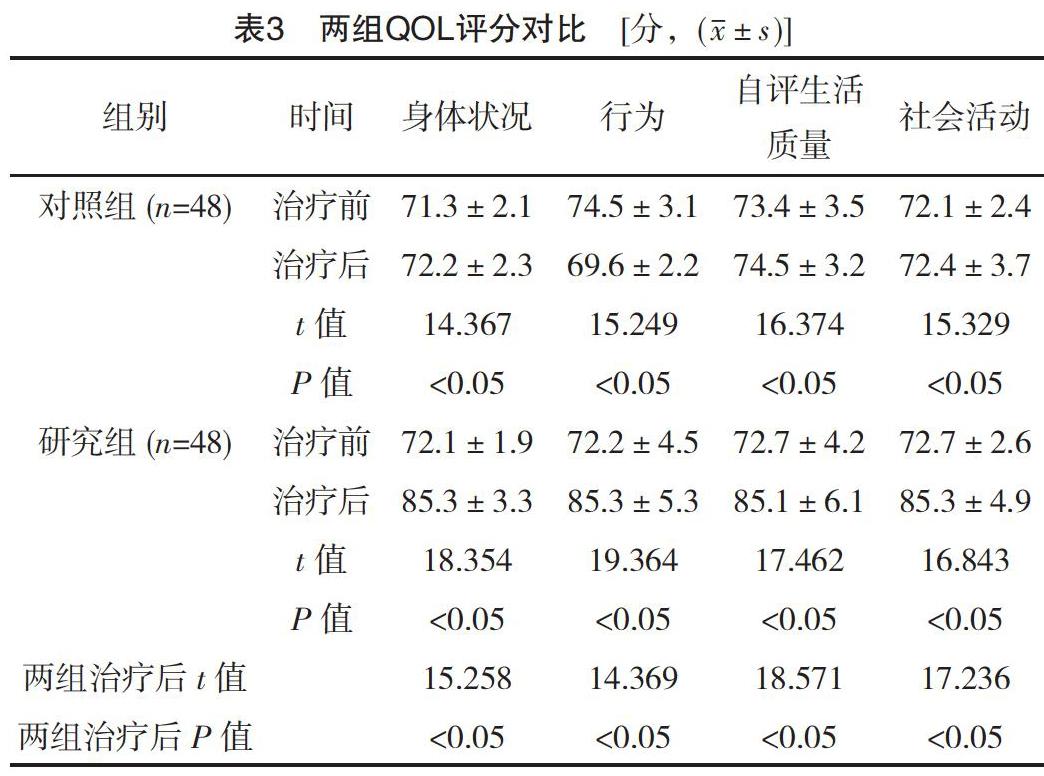
2.1 两组血钙值变化对比
治疗前两组血钙值对比差异无统计学意义(P>0.05),治疗后1、4、7 d对照组的血钙值变化明显差于研究组(P<0.05),见表1。
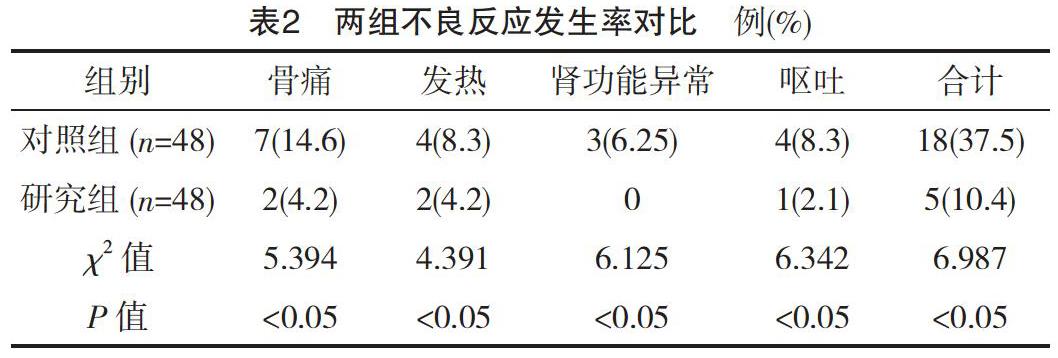
2.2 两组不良反应发生率对比
研究组的不良反应发生率明显低于对照组(P<0.05),见表2。
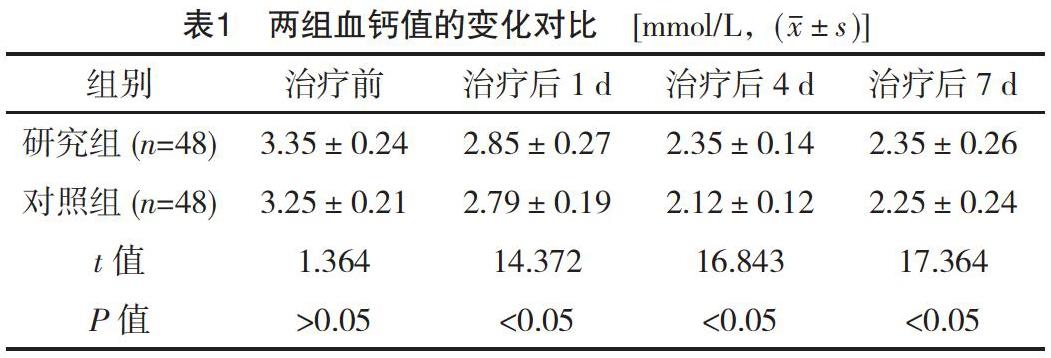
2.3 两组QOL评分对比
对照组的QOL评分明显低于研究组(P<0.05),见表3。
3 讨论
很多临床研究表明,恶性肿瘤并发的高钙血症与骨病变和骨转移息息相关,该疾病是常见代谢性疾病的一种,严重威胁患者的生命健康[6]。治疗该疾病的主要药物中要含有内源性焦磷酸盐类似物的双磷酸盐,主要是依附在骨骼羟磷灰石结晶上[7]。用来代替骨基质中的焦磷酸盐含量,药理上是抑制着破骨细胞的产生[8]。并且对破骨细胞对骨的吸收起到一定的阻碍作用,对破骨细胞起的抑制作用联系着侧链结构,对患有恶性肿瘤并发的高钙血症进行药物治疗取得理想的效果[9]。
唑来膦酸是一种新型的双磷酸盐类药物,其主要的药物机制包括:(1)对破骨细胞对骨的破坏具有直接性的阻碍;(2)不仅抑制了焦磷酸法尼基合成酶的活性,还对甲醛戊酸生物合成通路起到了一定的抑制作用[10-11]。進而将破骨细胞的活力进行抑制,间接地促进破骨细胞尽早地死亡[12-13]。(3)能够阻止破骨细胞的前体细胞进行转化,避免转化为成熟的破骨细胞[14-15]。
(4)当破骨细胞合成并释放一些疼痛和炎性介质时,能够进行及时的抑制[16-17]。处于较低浓度的唑来膦酸不会影响成骨细胞增殖分化,反而可以利用成骨细胞护骨素对破骨细胞的骨吸收功能起到间接性的抑制作用,再则促进了软骨的再吸收与骨骼结合阻滞矿物质骨结合下,起到了一系列的抑制作用,主要体现在对患者体内骨钙的释放和破骨细胞活性的异常增加的情况上,对患者体内磷和血清钙水平起到了降低作用,促进患者度体内尿钙和磷进行排泄[18-19]。本研究中,对照组血钙值的变化明显差于研究组(P<0.05),表明,采取唑来膦酸对恶性肿瘤高钙血症进行治疗,取得了理想的临床治疗效果,有利于疾病的康复,改善生活质量。
但是少数患者在服用唑来膦酸药物会存在不良反应,会出现骨痛、发热、肾功能异常、呕吐等一系列症状,还可能会影响患者的肾功能,但是与服用帕米膦酸二纳药物相比,出现肾功能亏损的情况较少,且不良反应发生率明显低。本研究中,研究组的不良反应发生率明显低于对照组(P<0.05)。表明,采取唑来膦酸对恶性肿瘤高钙血症进行治疗,取得了理想的临床治疗效果,药物的不良反应较少,具有很高的安全性。
综上所述,采取唑来膦酸对恶性肿瘤高钙血症进行治疗,取得了理想的临床治疗效果,具有很高的安全性,药物的不良反应较少,有利于患者疾病的康复,改善生活质量,值得进一步在各大医院的临床治疗上进行推广。
参考文献
[1]何斌,蔡雅霜,张志刚,等.双膦酸盐类药物用于肿瘤辅助治疗的临床研究进展[J].中国新药与临床杂志,2018,37(4):185-192.
[2]李嘉,付婷婷,马元琛,等.唑来膦酸联合甲状旁腺激素对椎体压缩性骨折术后影响的临床研究[J].中国骨质疏松杂志,2017,23(5):647-651.
[3] Billington E O,Horne A,Gamble G D,et al.Effect of single-dose dexamethasone on acute phase response following zoledronic acid:a randomized controlled trial[J].Osteoporosis International,2017,28(6):1867-1874.
[4]张铎安,党兴,陈兆兴.唑来膦酸结合钙尔奇对老年脑梗死合并骨质疏松症患者疗效影响的临床研究[J].中国骨质疏松杂志,2017,23(11):1468-1471.
[5] Aubry S,Dubut J,Nueffer J P,et al.Prospective 1-year follow-up pilot study of CT-guided microwave ablation in the treatment of bone and soft-tissue malignant tumours[J].European Radiology,2016,27(4):1477-1485.
[6]李鹏飞,贾楠,侯素平,等.伊班膦酸与唑来膦酸治疗脊柱骨巨细胞瘤的疗效及安全性[J].肿瘤,2016,36(3):334-339.
[7] Blanchette P S,Desautels D N,Pond G R,et al.Factors influencing survival among patients with HER2-positive metastatic breast cancer treated with trastuzumab[J].Breast Cancer Research & Treatment,2018,170(11):1-9.
[8]余德涛,王雷,邢贞武.唑来膦酸联合经皮椎体成形术治疗骨质疏松性椎体压缩骨折的临床研究[J].中国药房,2017,28(29):4137-4139.
[9] Frazier A L,Stoneham S,Rodriguezgalindo C,et al.Comparison of carboplatin versus cisplatin in the treatment of paediatric extracranial malignant germ cell tumours:A report of the Malignant Germ Cell International Consortium[J].European Journal of Cancer,2018,24(11):30-37.
[10]关媛,高燕玲,李贵庆.唑来膦酸注射液治疗高龄老年性骨质疏松的药物不良反应发生情况研究[J].中国全科医学,2017,20(28):77-81.
[11]刘智楠,郑慧,郭向辉.西那卡塞片联合骨化三醇胶丸治疗血液透析伴高钙血症的临床研究[J].中国临床药理学杂志,2017,33(23):2381-2383.
[12]袁志峰,刘会文.唑来膦酸、伊班膦酸钠及阿伦膦酸钠防治绝经后骨质疏松症的疗效对比研究[J].中国骨质疏松杂志,2018,24(2):23-25.
[13] Pinkawa M.Zoledronic Acid in first-line Treatment of prostate cancer[J].International Journal of Radiation Oncology Biology Physics,2017,97(1):6.
[14]张儒,吴鹏.唑来膦酸联合瑞舒伐他汀辅助治疗老年骨质疏松性椎体压缩性骨折临床观察[J].中国骨质疏松杂志,2018,24(3):56-58.
[15] Davison M R,Lyardet L,Preliasco M,et al.Experimental model of osteonecrosis of the jaw associated to bisphosphonates(ONJBPs) in ewes chronically treated with high doses of zoledronic acid[J].Bone,2016,89(13):68.
[16]史光彩,崔丽,郝丽,等.骨化三醇治疗维持性血液透析患者甲状旁腺功能亢进的临床疗效[J].中国现代医学杂志,2017,27(19):74-78.
[17] Abe T,Sato T,Kokabu S,et al.Zoledronic acid increases the circulating soluble RANKL level in mice,with a further increase in lymphocyte-derived soluble RANKL in zoledronic acid- and glucocorticoid-treated mice stimulated with bacterial lipopolysaccharide[J].Cytokine,2016,83(25):1-7.
[18] Majithia N,Atherton P J,Lafky J M,et al.Zoledronic acid for treatment of osteopenia and osteoporosis in women with primary breast cancer undergoing adjuvant aromatase inhibitor therapy:a 5-year follow-up[J].Supportive Care in Cancer,2016,24(3):1219-1226.
[19] Nagy D I,Grün A,Lévay K,et al.Efficient syntheses of zoledronic acid as an active ingredient of a drug against osteoporosis[J].Synthetic Communications,2018,48(6):1-9.
(收稿日期:2019-03-05) (本文編辑:何玉勤)

