32546例疏血通注射液医院集中监测研究
姜俊杰+谢雁鸣+张寅+杨志欣+易丹辉


[摘要]为了解疏血通注射液的不良反应特征、发生率等安全性信息,该研究采用多中心、大样本医院集中监测的设计方法,在全国54家医疗机构中,以使用疏血通的住院患者为监测对象,进行用药周期的全程监测。监测内容为患者的一般信息、诊断信息、用药信息、不良反应/事件信息等。共纳入32 546例病例,发生不良反应64例,不良反应发生率为0.197%,发生特征主要是皮肤瘙痒、皮疹、感冒状、呼吸困难、心悸、头痛、胸闷等过敏反应;发生不良反应患者以中老年人为主,用药特征基本符合说明书。以上结果说明,疏血通注射液在临床应用中安全性良好。
[关键词]疏血通注射液; 医院集中监测; 不良反应; 安全性
[Abstract]This study adopted multi-center and large sample design to understand the incidence, characteristics and other information about adverse reaction of Shuxuetong injection. In 54 medical institutions, use of Shuxuetong injection of entire treatment period was monitored, including patients′ general information, diagnostic information, medication, adverse reaction/event information, etc. Sixty four cases of adverse reactions in 32 546 patients was monitored, adverse rate was 0.197%, mainly characterized by skin itching, rash, flu-like, dyspnea, palpitations, headache, chest tightness and other allergic reactions. Adverse reaction occurred mainly in elderly patients and medication was consistent with the instruction. Based on these results, safety of Shuxuetong injection in clinical application is excellent.
[Key words]Shuxuetong injection; intensive hospital monitoring; adverse reactions; safety
doi:10.4268/cjcmm20162023
疏血通注射液(以下简称“疏血通”)是我国第一个动物类中药注射剂,成分是水蛭、地龙提取物,功效活血化瘀、通经活络,用于瘀血阻络所致的中风病中经络急性期,症见半身不遂、口眼歪斜、言语蹇涩,急性脑梗死见上述证候者。疏血通在临床上有较广泛的应用,不仅限于说明书中的适应症急性脑梗死,还涉及其他脑血管疾病、心血管疾病、肾脏疾病以及糖尿病周围神经病变、突发性耳聋、视网膜中央静脉阻塞、类风湿性关节炎等疾病的治疗[1]。关于其安全性,既往研究中,李百强等于黑龙江省内进行疏血通的医院集中监测,结果共纳入9 897例患者,发生9例不良反应(adverse reactions,ADR),ADR发生率是0.09%,以过敏反应为主[2]。但该研究的监测范围仅局限于黑龙江省内,监测结果仅代表局部区域。基于此,本研究以全国范围内的医疗机构为监测对象,开展疏血通的多中心、大样本、医院集中监测研究,以了解真实世界疏血通的安全性情况。
1 方法
1.1 监测设计 本研究为多中心、大样本、医院集中监测的设计方法。
1.2 监测机构 本研究在全国共设有54家监测机构,其中,河南中医药大学第一附属医院、广东省中医院、长春中医药大学附属医院、石家庄市中医院为负责单位,其余50家为监测参加单位,包括哈尔滨医科大学附属第一医院、齐齐哈尔医学院第一附属医院、佳木斯大学附属第一医院、河南大学第一附属医院、重庆市中医院等。
1.3 监测对象 2012年3月—2015年3月,在监测机构使用疏血通的住院患者。各监测医院所使用的疏血通是由牡丹江友搏药业有限责任公司独家生产的不同批次产品。
1.4 样本量 根据国际通用“三例原则”,确定样本量是3万例。
1.5 监测周期 用药期间全程观察。
1.6 监测形式及内容 本监测的形式分为2种,一是由临床医师观察,并由临床医师填写监测表;二是由临床医师观察,继而将观察结果上报药师,由药师填写监测表。监测表分为A,B 2个表。A表包括一般信息、诊断信息、用药信息、联合用药信息,每个病例均需填写;B表是不良事件相关信息,发生不良事件的患者需要填写。A,B表具体内容是①一般信息:包括性别、年龄、生命体征、个人过敏史、家族过敏史等;②诊断信息:包括西医诊断、中医诊断、合并疾病;③用药信息:包括疏血通的使用方式、用药天数、药物剂量、溶媒、溶媒用量、注射室温、配液放置时间、注射持续时间、滴速;④联合用药信息:合并用药名称、注射前使用的注射剂名称、注射期间使用的注射剂名称、注射后使用的注射剂名称、注射前后是否冲管、注射前后是否更换输液器、注射期间;⑤不良反应/事件信息:不良反应/事件名称、发生时间、症状、体征、临床检验,不良反应/事件结果、转归、预后,怀疑药品、溶媒、输液器、并用药品的名称、批准文号、通用名、生产厂家、批号、用法用量、室温等,关联性评价结果等。
1.7 质量控制 质量控制主要从以下7个方面实施:监测中心、监测人员、监测进度、原始文件、电子数据、档案管理、质量管理。其中,原始文件和电子数据是质量控制的重要内容。原始文件方面,主要是防止漏报病例以及监测表的填写质量检查。通过调取医院信息系统数据中研究时间范围内使用疏血通的病例数,与实际登记例数相对照的方法,检查是否有漏报情况。原始文件质量方面,通过与原始病历对照溯源进行检查,要求具备规范性、及时性、准确性、真实性。电子数据要求与纸质监测表内容一致。
1.8 数据管理 本研究的数据采集工具是监测表,并建立了专有网络平台数据库,网址为www.crpcm.com。采用独立双人双份数据录入的形式,并由计算机执行差异校验功能,解决录入间的不一致。数据的现场核查主要指核对源数据(住院病历)与监测表或电子数据的一致性。在收集数据结束之后,对所有数据进行整体核查与清理,包括清除重复数据、修改错误数据和疾病名称、药物名称不标准的数据,继而,锁定数据库,用于统计分析。
1.9 不良反应因果判断方法 按照国家药品不良反应监测中心2011年公布的《药品不良反应报告和监测管理办法》(卫生部第81号令),对不良反应、不良事件、严重不良反应进行判断,并采用6级不良事件关联性评价对不良事件与疏血通的关联性做出评价,包括肯定、很可能、可能、可能无关、待评价、无法评价。
1.10 伦理审查与国际注册 本监测已通过伦理审查,审查机构是中国中医科学院中医临床基础医学研究所伦理委员会,伦理批件号码是2012-9-3。并于美国临床试验注册网www.clinicaltrials.gov通过注册,注册号是NCT01508403。
1.11 数据标准化 由于监测数据来源于多家医院,为便于分析,需要对数据库的相关信息进行标准化。参照西医ICD-10 疾病分类[3]对西医诊断进行规范化;参照《中华人民共和国国家标准——中医病证分类与代码》(GB/T15657-1995)[4]对中医诊断标准化;参照2015年版《中国药典》[5]对药品名称进行标准化;参照《WHO不良反应术语集》对不良反应/事件名称及所属系统进行标准化。
1.12 数据统计 对于计数资料,采用描述方法分析频数及百分比;对于计量资料,采用分段描述频数和百分比的方式,Excel辅助作图。采用SAS 9.3进行统计分析。
2 结果
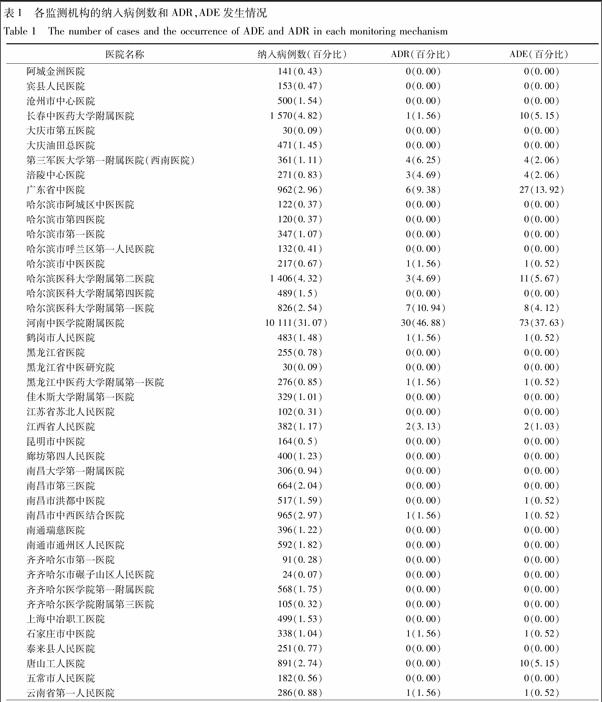
2.1 监测完成情况及ADR发生率 全国54家监测机构共纳入32 546例使用疏血通的患者资料,发生ADR 64例,不良事件(adverse event,ADE)194例,ADR发生率是0.197%。所有监测机构纳入病例数及ADR,ADE发生例数、百分比见表1。
2.2 ADR表现 每个病例可能有多个ADR表现,因此,64例ADR病例中,发生183频次。其中,皮肤瘙痒、皮疹分别占19.13%,13.11%,ADR表现的频次及百分比见表2。ADR类型中,一般ADR 54例,严重ADR 1例,是上消化道出血,新发ADR 9例,见表2。
ADR表现所涉及的系统见表3,其中,皮肤及其附件损害最多,占64.06%。
2.3 年龄及性别 64例ADR患者中,中老年人占多数,年龄分布见表4。性别分布为男性27例,女性37例。
2.4 西医诊断及合并疾病 64例ADR患者的前10位西医诊断分布见表5。急性脑梗死、糖尿病、短暂性脑缺血是主要的西医诊断。
64例ADR患者的前10位合并疾病分布见表6。高血压、糖尿病、高脂血症、冠心病是主要合并疾病。
2.5 中医诊断 64例ADR患者的中医病名见表7,中医辨证见表8。由于西医院未收集中医诊断相关信息,因此,64例患者的中医诊断信息缺失,共收集中医病名12例次,中医辨证22例次。
2.6 过敏史 64例ADR患者中,15例有过敏史,过敏原均为药物,过敏表现是皮疹、胃肠道痛性痉挛等。
2.7 疏血通用药特征 64例患者使用的疏血通均为静脉滴注的方式;溶媒方面,使用5%葡萄糖注射液的42例,0.9%氯化钠注射液的22例;溶媒用量≤250 mL的62例,250~500 mL的2例;单次使用剂量≤6 mL的49例,6~8 mL的4例,8~10 mL的11例;注射室温是17~26 ℃的60例,26 ℃的3例,0~16 ℃的1例;配液放置时间在0~30 min的44例,30 min~4 h的20例;0~60滴/min的57例,61~80滴/min的7例;注射前冲管的14例,注射后冲管的10例,注射前更换输液器的2例,注射后更换输液器的2例。
2.8 合并用药 64例ADR患者的前10位合并用药见表9。
2.9 出现ADR距用药时间 64例ADR患者中,出现ADR距用药时间分布见表10。大部分ADR在24 h内发生。
2.10 ADR转归 64例ADR中,痊愈38例,好转25例,未好转1例。停药/减量后症状消失的51例,未消失的1例,未停药/减量的12例。再次使用可疑药品出现类似症状的5例,未出现类似症状的8例,不明的5例,未再使用的46例。
3 讨论
3.1 疏血通的安全性良好,不良反应以过敏反应为主 本监测结果表明,32 546例监测病例中,共发生ADR 64例,不良反应发生率为0.197%,属于偶见不良反应,说明其在临床中应用的安全性良好。64例不良反应中,一般ADR 54例,严重ADR 1例,新发ADR 9例。一般不良反应表现以过敏反应为主,包括皮肤瘙痒、皮疹、感冒状、呼吸困难、心悸、头痛、胸闷、皮肤肿胀、头晕等。严重不良反应是上消化道出血。新发不良反应表现是头晕、胃部不适、腰痛、静脉炎等。郭新峰等对2012年2月以前的所有关于疏血通不良反应的文献进行全面梳理分析,得到的疏血通ADR主要临床表现是血压下降、呼吸困难等的过敏性休克,胸闷、憋气、心悸等全身过敏反应,结膜充血等过敏性眼部反应,皮疹,消化道出血、恶心等消化系统反应,头晕、头痛、低热、轻度嗜睡、静脉炎等其他反应[6]。该研究结果得到的主要ADR表现,本研究均已监测到,说明本监测结果较为全面,可信度较高。
3.2 发生ADR的患者疏血通用药特征基本符合说明书 本监测结果显示,发生ADR的64例患者的疏血通用药特征中,用药原因是急性脑梗死的22例,占33.33%;使用方式均为静脉滴注;单次用药剂量为6 mL以下的49例;溶媒种类是5%葡萄糖注射液的42例,0.9%氯化钠注射液的22例;溶媒用量≤250 mL的62例,250~500 mL的2例。疏血通说明书中表明:“静脉滴注,每日6 mL,加于5%葡萄糖注射液(或0.9%氯化钠注射液)250~500 mL中,缓慢滴入。”说明发生ADR患者的用药特征基本符合说明书,因此,疏血通发生ADR的影响因素尚需进一步的统计分析或前瞻性试验加以探索。
3.3 本研究的局限及优势 在不良事件和不良反应的观察方面,本研究可能存在一定的低估问题:①本监测为医生或药师主导的研究,因无法在用药期间时时刻刻观察患者,可能会出现漏报轻度不良反应的情况;②研究涉及的实验室指标相对较少,有可能会低估实验室检查异常值方面的不良事件/反应;③由于观察仅限于用药期间,并不涉及随访,因此,对于远期产生的不良反应无法观测到。
在偏倚控制中,本研究在抽样时为非随机抽样,选取的研究医院为疏血通用量较大的医院,可能存在一定的选择偏倚。但选择时,使监测医院尽量分布于我国的东、西、南、北、中,以使监测医院更具全国代表性,从而减小偏倚。监测医院分布于北部的黑龙江、吉林,南部的广东、江西,西部的四川、重庆,东部的江苏,中部的河北、河南。另外,由于门诊患者较难得到相应的安全性数据,所以纳入的门诊患者较少,可能会造成一定的偏倚。各监测医院对ADR因果关系的判断及轻重程度的判断方面,因监测者知识结构的不同存在测量偏倚。
药物上市后的安全性研究中,包括大样本的医院集中监测研究,基于国家药品不良反应监测中心数据(SRS)的ADR信号发现,基于医院信息系统数据的安全性研究、文献分析、个案分析等。其中,大样本、前瞻性的医院集中监测的数据来源于真实世界,不仅能观察到不良事件的发生情况,而且已知使用药物的基础人群情况,因此能计算不良反应发生率,得出的结论是药物安全性研究中证据级别最高的[7],也是目前较好的药物安全性研究方法。
[参考文献]
[1]郭伦,崔瑛,杨亚蕾,等. 疏血通注射液的临床应用研究进展[J].中国现代药物应用,2015,9(1):240.
[2]李百强,鲁仲平,方洪壮,等.疏血通注射液大样本临床使用安全性分析[J].中国药物警戒,2011,8(10):592.
[3]董景五.疾病和有关健康问题的国际统计分类[M].北京:人民卫生出版社,2008.
[4]陈佑邦,潘筱秦,金棣生,等.中医病证分类与代码[M].北京:中国标准出版社,1995.
[5]中国药典.一部[S]. 2015:143.
[6]郭新峰,温泽淮,谢雁鸣,等.疏血通注射液临床安全性的系统分析[J].中国中药杂志,2012,37(18):2782.
[7]廖星,谢雁鸣,王永炎,等.药品安全性证据分级分类探索研究——构建中药上市后安全性证据体[J].中国中药杂志,2015,40(24):4723.
[责任编辑 曹阳阳]

