口服营养支持在鼻咽癌放疗患者中的临床研究
苏端玉+侯如蓉


[摘要] 目的 探讨口服营养支持对鼻咽癌放疗患者营养状况及副反应的影响。 方法 鼻咽癌初治患者83例,放疗前NRs 2002评分<3分,随机分为营养支持组40例和无营养支持组43例,放疗后1周内再次行NRs 2002评分,比较两组的营养指标和放疗副反应情况。 结果 83例鼻咽癌患者根治性放疗后NRs 2002评分≥3分者53例,营养风险发生率为63.9%,营养支持组营养不良发生率更低(52.5% vs 74.4%,P<0.05)。两组血红蛋白(Hb)、白蛋白(ALB)、淋巴细胞数(LYM)放疗后均有显著下降,但营养支持组放疗后的Hb、体重指数(BMI)较无营养支持组高,体重下降比例更低,差异均有统计学意义(P<0.05)。无营养支持组的2/3级口腔黏膜炎、咽食管炎发生率较营养支持组高,放疗疗程更长(P<0.05)。 结论 鼻咽癌放疗患者营养风险发生率较高,口服营养支持可以减少体重丢失,减轻急性放射性口咽黏膜反应,进而提高患者的生活质量和肿瘤控制率。因此口服营养支持是一种值得临床推广的方便、经济、有效的肠内营养方法。
[关键词] 鼻咽肿瘤;放射治疗;营养风险;口服营养补充;不良反应
[中图分类号] R739.63;R473.73 [文献标识码] B [文章编号] 1673-9701(2016)26-0073-05
营养不良和肿瘤消耗是癌症患者存在的普遍现象,其发生率达30%~80%[1]。头颈部肿瘤患者因吞咽困难、吞咽疼痛和抑郁情绪而导致营养状况更遭[2]。营养不良可以直接导致肿瘤患者住院时间延长、抗肿瘤治疗敏感性减弱、并发症增加、治疗费用提高、生活质量以及生存率下降[3]。因此必须重视头颈部肿瘤患者的营养状态和治疗。鼻咽癌是我国南方地区的高发肿瘤之一,放疗是鼻咽癌的重要治疗手段,放疗引起的口咽、食管黏膜反应、口干、味觉改变等副反应降低了患者的食欲和免疫功能,从而影响放疗的进行和治疗效果,降低患者的生存质量。本研究探讨了口服营养支持对鼻咽癌放疗患者营养状况及放疗副反应的影响,以期为临床制订营养支持治疗方案提供依据。现报道如下。
1 资料与方法
1.1 一般资料
选择2013年1月1日~2015年10月31日就诊于我院的初治鼻咽癌患者83例,男58例,女25例,年龄23~70岁,中位年龄49岁。患者均经组织学和免疫组化检查确诊为鼻咽未分化非角化性癌,按照AJCC鼻咽癌分期标准(第7版,2010),Ⅰ期3例,Ⅱ期13例,Ⅲ期33例,Ⅳ期34例。放疗前营养风险筛查量表2002(nutritional risk screening 2002,NRs 2002)评分均<3分。83例患者随机分为营养支持组(40例)和无营养支持组(43例),所有患者均签署知情同意书,两组均接受根治性调强放疗,鼻咽靶区剂量为66~75 Gy,平均剂量70 Gy,放疗疗程(第1次放疗到放疗结束的天数)的中位时间为47 d,其中50例患者接受过新辅助化疗2~3周期,方案为“紫杉醇、顺铂/奈达伯”或“吉西他滨、顺铂/奈达伯”。57例接受单药铂类的同期化疗。9例接受“尼妥珠单抗”靶向治疗。放疗结束1周内再次NRs2002评定。两组患者的临床资料(性别、年龄、分期、放疗剂量、有无化疗、靶向治疗)比较,差异均无统计学意义(P>0.05),具有可比性。见表1。
1.2营养支持方法
根据肿瘤患者营养指南,设定营养支持组目标能量30~35 kcal/(kg·d),蛋白质1.5~2.0 g/(kg·d),碳水化合物3.0~4.0 g/(kg·d)),脂肪1.0~1.5 g/(kg·d),液体量30~40 mL/(kg·d)),每天统计日常饮食产生的热量和各种营养素含量,然后予安素(雅培制药生产,400 g/罐,注册证号H20130320)补充不足的能量和营养素。无营养支持组则除日常饮食外无额外补充营养素。
1.3 评价指标
1.3.1 营养指标 观察两组放疗后的营养风险发生率(放疗结束后1周内NRs 2002测评,具体判定详见1.3.3)和体重下降比例(放疗开始前和结束后1周内的体重变化/放疗前1周内的体重),以及两组放疗前后(1周内)血红蛋白(Hb)、白蛋白(ALB)、淋巴细胞计数(LYM)、体重指数(BMI)的变化情况。
1.3.2 放疗副反应 按照RTOG急性放射损伤分级标准[4],观察两组的急性皮炎、口腔黏膜反应、咽食管黏膜反应、涎腺反应(口干)和血细胞下降情况。
1.3.3营养风险评定 营养风险评定采用欧洲肠外肠内营养学会(ESPEN)2002年制订的NRs 2002[5],主要包含营养状况受损评分(0~3分);疾病严重程度评分(0~3分);年龄评分,即在前两项评分基础上若年龄≥70岁者加1分;总分为0~7分。当NRs 2002评分≥3分时判断为有营养风险。
1.4 统计学方法
采用 SPSS 19.0统计学软件对数据进行分析。计量资料以均数±标准差(x±s)表示,采用t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
83例鼻咽癌患者根治性放疗后NRs 2002评分≥3分者53例,营养风险发生率为63.9%,其中营养支持组21例(52.5%),无营养支持组32例(74.4%)。
2.1 营养指标变化
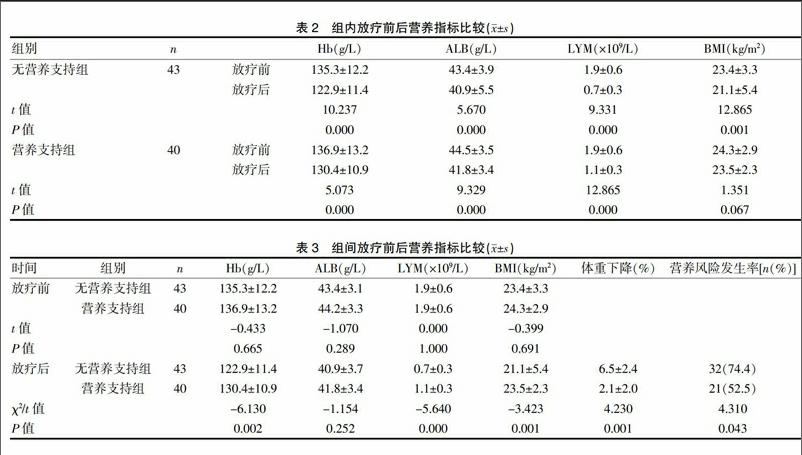
两组Hb、ALB、LYM放疗后均有下降(P<0.05);营养支持组放疗后Hb、BMI较无营养支持组高,差异有统计学意义(P<0.05);营养支持组放疗后体重下降比例较无营养支持组低,差异有统计学意义(P<0.05)。见表2、3。
2.2 放疗副反应
急性放疗副反应主要为1~3级急性放射性皮炎[分别为79.5%(66/83)、13.3%(11/83)、7.2%(6/83)]、口腔黏膜炎[分别为36.1%(30/83)、46.3%(38/83)、17.6%(15/83)]和咽食管炎[分别为39.8%(33/83)、46.1%(38/83)、14.1%(12.83)],1~2级涎腺损伤[分别为62.7%(52/83)、37.3%(31/83)]和1~4级白细胞降低[分别为16.8%(14/83)、18.1%(15/83)、0%(0/83)、1.2%(1/83)],血红蛋白和血小板降低不明显。两组比较结果显示,无营养支持组的2/3级口腔黏膜炎、咽食管炎发生率较营养支持组高,差异有统计学意义(P<0.05,表4)。无营养支持组因治疗中断发生率更高导致疗程较营养支持组长(χ2=6.018,P<0.05,表1)。
表4 两组放疗副反应比较[n(%)]
3 讨论
营养支持已成为肿瘤治疗的重要组成部分,理想的营养支持应当基于对患者营养状况的准确评估。目前营养筛查的方法很多,本研究采取2002年欧洲营养学会提出的营养风险筛查方案(nutritional risk screening 2002,NRs 2002),该方案主要用于住院患者的营养风险筛查,其突出的优点在于能预测营养风险,并能前瞻性地动态判断患者营养状态变化,便于及时反馈患者的营养状况,并为调整营养支持方案提供证据[6]。口服营养补充(ONS)为特殊医疗目的经口摄入一般食品以外的口服营养补充剂,以达到增加能量和营养素的摄入量,经济、方便,患者易于接受。
头颈部肿瘤在初诊时约有3%~52%存在营养不良[7],这主要是由肿瘤本身引起。而手术、放疗、化疗或以上措施的综合治疗进一步影响了患者的营养摄入。文献报道,头颈部肿瘤患者在单纯放疗或同期放化疗期间约有44%~88%出现营养不良[8,9]。本组鼻咽癌患者根治性放疗后NRs 2002评分≥3分者53例,营养风险发生率为63.9%,提示鼻咽癌放疗患者存在较高的营养风险发生率,故应重视并及时评估患者的营养状况。
在头颈部肿瘤研究中通常将营养不良定义为最近1~6月体重下降大于5%~10%,或是BMI小于18.5~20 kg/m2[10,11]。本研究发现无营养支持组的营养风险发生率显著高于营养支持组(74.4% vs 52.5%,P<0.05),且放疗后体重下降比例更高,BMI更低。体重下降影响患者的治疗耐受性、降低生存质量和缩短生存时间[1,11,12]。Du等[13]研究发现,严重体重下降(治疗期间体重下降≥10%)是总生存和无远处转移生存不良的独立预后因素。Ouyang等[14]对1778例鼻咽癌接受放(化)疗患者治疗前的体重指数进行倾向匹配分析显示,BMI<18.5 kg/m2组的疾病相关生存、总生存、无远处转移生存方面劣于正常BMI(18.5~22.9 kg/m2),而超重(22.9~27.5 kg/m2)和肥胖组(≥27.5 kg/m2)与正常组相似。因此重视营养摄入,减少治疗后体重丢失,有益于肿瘤患者的治疗和预后。
血红蛋白、白蛋白和淋巴细胞计数等血液指标也常被用于评估营养状况。已有研究发现低蛋白血症是进展期头颈部肿瘤同期放化疗的独立预后因素[15]。但近几年有学者研究发现在头颈部肿瘤前白蛋白是较白蛋白更为敏感的指标[16,17]。淋巴计数低于(1.2~1.3)×109/L被认为是营养不良的另一个指标[18]。Mc Closkey等[19]发现,血红蛋白低于12 g/dL和总放疗时间均是头颈部肿瘤同期放化疗后局部复发的预后指标。但Mary等[20]对该组病例的进一步随访和重新分析,结果单因素分析显示,血红蛋白仍存在统计学差异,但多因素分析结果只有总放疗时间和治疗前的理想体重比是局部复发的预后因素。两次分析血红蛋白的分界点不同可能是造成此差异的原因。本研究发现两组放疗后血红蛋白、白蛋白、淋巴细胞计数均下降,但营养支持组放疗后的血红蛋白和淋巴细胞计数较无营养支持组高,差异有统计学意义。
有文献报道[21,22]鼻咽癌调强放疗2级以上的急性黏膜炎发生率约63%~83%。本研究2/3级急性放射性口腔黏膜炎和咽食管炎的发生率分别为63.9%(53/83)、60.2%(50/83),与文献报道相似,而营养支持组的2/3级急性放射性口腔黏膜炎和咽食管炎的发生率较无营养支持组显著降低。2级以上的急性黏膜反应和口干影响患者的营养摄入,从而降低患者的免疫功能、体重,甚至导致治疗中断、延长放疗疗程。本研究也显示无营养支持组的放疗疗程较营养支持组延长,差异有统计学意义(P<0.05)。已有文献报道头颈部鳞癌放疗疗程是局部治疗失败的主要预后指标[19,20]。因此,早期、及时营养干预,减轻急性放射损伤,可能提高肿瘤的局控率。
预防性的鼻饲管置入术或经皮胃造瘘术是目前常用的头颈部肿瘤肠内营养方法。有文献报道[23]头颈部肿瘤放(化)疗时预防性鼻饲管置入患者在治疗结束6周时的体重下降和三角肌厚度较预防性胃造瘘术患者差,但两种肠内营养方法带来的并发症和患者的满意度无差异,而胃造瘘术的费用是鼻饲管置入术的10倍以上,且胃造瘘管依赖的时间更长。另外预防性胃造瘘术因无需吞咽,吞咽肌群鲜少活动,研究发现胃造瘘术后吞咽困难发生率较鼻饲管置入高[24]。因此胃造瘘术和鼻饲管置入孰优孰劣,目前尚无确定标准。Hutcheson KA等[25]的研究发现咽部肿瘤放(化)疗期间坚持经口摄入或坚持吞咽功能锻炼,放(化)疗后可以获得更好的长期饮食,依赖胃造瘘管的时间更短。因此口服营养支持不失为一种有效、简便、经济的肠内营养方法,值得临床推广,并予个体化的饮食指导也有助于提高患者的营养摄入、营养状态和生活质量。
综上所述,鼻咽癌放疗患者营养风险发生率较高,口服营养支持可以减少体重丢失,减轻急性放射性口咽黏膜反应,进而提高患者的生活质量和肿瘤控制率。因此口服营养支持是一种值得临床推广的方便、经济、有效的肠内营养方法。
[参考文献]
[1] Capuano G,Gentile PC,Bianciardi F,et al. Prevalence and influence of malnutrition on quality of life and performance status in patients with locally advanced head and neck cancer before treatment[J]. Support Care Cancer,2010, 18(4):433-437.
[2] Couch M,Lai V,Cannon T,et al. Cancer cachexia syndrome in head and neck cancer patients:Part I. Diagnosis,impact on quality of life and survival,and treatment[J]. Head Neck,2007,29(4):401-411.
[3] Di Luzio R,Moscatiello S,Marchesini G,et al. Role of nutrition in gastrointestinal oncological patients[J]. Eur Rev Med Pharmacol Sci,2010,14(4):277-284.
[4] 殷蔚伯,余子豪,徐国振,等. 肿瘤放射治疗学[M]. 北京:中国协和医科大学出版社,2008:1350-1352.
[5] Kondrup J,Allison SP,Elia M,et al. ESPEN guidelines for nutrition screening 2002[J]. Clin Nutr,2003,22(4):415-421.
[6] 林在楷,殷保兵. 中晚期肿瘤患者营养支持治疗的临床进展[J]. 上海医药,2015,36(4):3-5.
[7] Mojca G,Nada RK,Primoz S. Malnutrition and cachexia in patients with head and neck cancer treated with(chemo)radiotherapy[J]. Reports of Practical Oncology and Radiotherapy,2015,20:249-258.
[8] Langius JAE,Doornaert P,Spreeuwenberg MD,et al. Radiotherapy on the neck nodespredicts severe weight loss in patients with early stagelaryngeal cancer[J]. Radiother Oncol,2010,97:80-85.
[9] Unsal D,Mentes B,Akmansu M,et al. Evaluation of nutritional status in cancer patients receivingradiotherapy:A prospective study[J]. Am J Clin Oncol,2006,29:183-188.
[10] Van den Berg MG,Rasmussen-Conrad EL,Van Nispen L,et al. A prospective study on malnutrion and quality of life in patients with head and neck cancer[J]. Oral Oncol,2008,44:830-837.
[11] Capuano G,Grosso A,Geatile PC,et al. Influence of weight loss on outcomes in patients with head and neck cancer undergoing concomitant chemoradiotherapy[J]. Head Neck,2008,30:503-508.
[12] Datema FR,Ferrier MB,Baatenburg de Jong RJ. Impact of severe malnutrition on short-term mortality and overall survival in head and neck cancer[J]. Oral Oncol,2011, 47:910-914.
[13] Du XJ,Tang LL,Mao YP,et al. Value of the prognostic nutritional index and weight loss in predicting metastasis and long-term mortality in nasopharyngeal carcinoma[J]. J Transl Med,2015,13(1):364-367.
[14] Ouyang PY,Zhang LN,Tang J,et al. Evaluation of body mass index and survival of nasopharyngeal carcinoma by propensity-matched analysis:An observational case-control study[J]. Medicine(Baltimore),2016,95(2):e2380.
[15] Shin SW,Sung WJ,Lee JW,et al. Serum albumin as an independent prognostic indicator in patients with advanced head and neck cancer treated with concurrent chemoradiotherapy[J]. Journal of Clinical Oncology,2005, 23(16S):5549.
[16] Unal D,Orhan O,Eroglu C,et al. Prealbumin is a more sensitive marker than albumin to assess the nutritional status in patients undergoing radiotherapy for head and neck cancer[J]. Contemp Oncol,2013,17:276-280.
[17] Salas S,Deville JL,Giorgi R,et al. Nutritional factors as predictors of response to radio-chemotherapy and survival in unresectable squamous head and neck carcinoma[J].Radiother Oncol,2008,87:195-200.
[18] Schwenk A,Beisenherz A,Romer K,et al. Phase angle from bioelectrical impedance analysis remains an independent predictive marker in HIV-infected patients in the era of highly active antiretroviral treatment[J]. Am J Clin Nutr,2000,72:496-501.
[19] Mc Closkey SA,Jaggernauth W,Rigual NR,et al. Radiation treatment interruptions greater than one week and low hemoglobin levels(12 g/dL are predictors of local regional failure after definitive concurrent chemotherapy and intensity-modulated radiation therapy for squamous cell carcinoma of the head and neck[J]. Am J Clin Oncol,2009,32:587-591.
[20] Mary EP,Mary ER,Gregory EW,et al. Pretreatment nutritional status and locoregional failure in patients with head and neck cancer undergoing definitive concurrent chemoradiation theraphy[J]. Head Neck,2011,33(11):1561-1568.
[21] Ozdemir S,Akin M,Coban Y,et al. Acute toxicity in nasopharyngeal carcinoma patients treated with IMRT/VMAT[J]. Asian Pac J Cancer Prev,2015,16(5):1897-1900.
[22] Wei R,Jiang W,Su J,et al. Intensity modulated radiation therapy for 90 untreated nasopharyngeal carcinoma[J]. Zhong Nan Da Xue Xue Bao Yi Xue Ban, 2012,37(2):173-178.
[23] Nugent B,Lewis S,OSullivan JM. Enteral feeding methods for nutritional management in patients with head and neck cancers being treated with radiotherapy and/or chemotherapy[J]. Cochrane Database Syst Rev,2010,17,(3):CD007904.
[24] Wang J,Liu M,Liu C,et al. Percutaneous endoscopic gastrostomy versus nasogastric tube feeding for patients with head and neck cancer:A systematic review. J Radiat Res,2014,55:559-567.
[25] Hutcheson KA,Bhayani MK,Beadle BM,et al. Eat and exercise during radiotherapy or chemoradiotherapy for pharyngeal cancers:Use it or lose it[J]. JAMA Otolaryngol Head Neck Surg. 2013,139(11):1127-1134.
(收稿日期:2016-06-24)

