硼替佐米联合沙利度胺或环磷酰胺治疗多发性骨髓瘤效果分析
魏天南 尚晋 林芸 王志红 陈为民

【摘要】 目的:分析探讨以硼替佐米联合沙利度胺或环磷酰胺为基础的三药联合化疗方案VTD和VCD方案治疗多发性骨髓瘤的效果和不良反应。方法:回顾性分析2013年1月-2017年12月福建省立医院血液科收治并采用VTD和VCD方案治疗的多发性骨髓瘤病例32例,收集病历资料并于4个疗程后进行疗效評价和不良反应观察。结果:VTD治疗组与VCD治疗组CR率、PR率及总有效率比较差异无统计学意义(P>0.05),但VTD治疗组VGPR率优于VCD治疗组,差异有统计学意义(P<0.05)。VTD治疗组神经系统毒性发生率高于VCD治疗组,差异有统计学意义(P<0.05);两组带状疱疹、肺部感染、药物性肝损伤、肾功能损伤、心脏毒性、消化道反应发生率比较差异无统计学意义(P>0.05)。结论:作为多发性骨髓瘤三药联合化疗方案,VTD与VCD在治疗效果上大致相同,VTD治疗组在VGPR率上存在优势,同时也存在较高的神经系统毒性风险。
【关键词】 硼替佐米; 沙利度胺; 环磷酰胺; 化疗
doi:10.14033/j.cnki.cfmr.2019.21.002 文献标识码 A 文章编号 1674-6805(2019)21-000-04
The Analysis of the Effects of Chemotherapies Based on Bortezomib Combined with Thalidomide or Cyclophosphamide in the Clinical Treatment of Multiple Myeloma/WEI Tiannan,SHANG Jin,LIN Yun,et al.//Chinese and Foreign Medical Research,2019,17(21):-8
【Abstract】 Objective:To analyze the efficacy and side effects of VTD and VCD regimen based on Bortezomib combined with Thalidomide or Cyclophosphamide in the treatment of multiple myeloma.Method:A total of 32 multiple myeloma from January 2013 to December 2017 in the department of hematology,Fujian Provincial Hospital were collected and were treated with VTD or VCD.The data was analyzed retrospectively,and the curative effects and adverse reactions were evaluated after 4 courses of treatment.Result:There was no significant difference in CR rate,PR rate and total effective rate between VTD treatment group and VCD treatment group(P>0.05),but the VGPR rate in VTD group was better than that in VCD treatment group(P<0.05).The incidence of neurotoxicity in VTD treatment group was significantly higher than that in VCD treatment group(P<0.05),there was no significant difference in herpes zoster,pulmonary infection,drug-induced liver injury,renal function injury,cardiotoxicity and digestive tract reaction rate between the two groups(P>0.05).Conclusion:The overall response rate of VTD and VCD is about the same.VTD treatment group has advantages in VGPR rate,but may also has a higher risk of neurotoxicity.
【Key words】 Bortezomib; Thalidomide; Cyclophosphamide; Chemotherapy
First-authors address:Fujian Provincial Hospital,Fuzhou 350001,China
多发性骨髓瘤是一种克隆性浆细胞异常增殖的血液系统恶性肿瘤[1],在血液系统恶性肿瘤中较为常见,但在普通内科及肿瘤内科领域仍属于相对少见病。过去,由于诊疗手段有限、临床医生认识不足等原因,本病误诊、误治率较高,许多患者确诊时已到终末期,失去治疗机会[2]。而今,随着临床医生对本病认识的不断提高及分子遗传学、影像学的飞速发展,使大部分患者得以在疾病早期即获得确诊,加上许多新药的临床应用,使多发性骨髓瘤从一种预后极差的疾病“化身”为一种可控可管的慢性病[3]。其中,以新药为基础的联合化疗对改善疾病的预后起到了关键作用。以硼替佐米联合沙利度胺或环磷酰胺为基础的三药联合化疗方案-VTD和VCD方案是血液科常用的方案[4]。本文回顾性分析了福建省立医院血液科应用VTD和VCD方案治疗的多发性骨髓瘤病例32例,评估其临床疗效和主要不良反应,以期对今后的临床工作起到一定的指导和借鉴作用,具体如下。
1 资料与方法
1.1 一般资料
收集2013年1月-2017年12月福建省立医院血液科收治的多发性骨髓瘤患者,并从中筛选出使用VTD或VCD相同方案治疗至少4个疗程或以上的患者32例,评估完成4个疗程治疗后的临床疗效和主要不良反应,并将所有患者随访至2018年12月31日。所有患者均经《血液病诊断及疗效标准》的多发性骨髓瘤诊断标准确诊[5],包括临床、实验室、骨髓或病理检查证实,并根据多发性骨髓瘤国际分期标准(ISS)对患者初治时的疾病情况进行分期。在32例患者中,男18例,女14例,年龄33~82岁,中位年龄63岁,平均(61.7±9.3)岁。根据患者治疗时的化疗方案,将患者分为VTD治疗组(19例)和VCD治疗组(13例)。两组一般资料比较差异无统计学意义(P>0.05),具有可比性,见表1。
1.2 方法
本研究为非随机对照研究,根据患者的化疗方案进行分组,并回顾性分析患者治疗4个疗程后的临床疗效。VTD治疗组化疗方案:硼替佐米(BSP pharmaceuticals生产,西安杨森制药有限公司分装,批号J20171067),剂量1.3 mg/m2,疗程第1、4、8、11天;沙利度胺(常州制药厂有限公司,批号15102831)1次/d,睡前服用,劑量从50 mg/d开始,若无明显副作用则在治疗过程中逐渐增量至150~200 mg/d,并保持剂量至疗程第21天;地塞米松(福州海王福药制药,批号1604141),剂量20 mg/d,疗程第1、2、4、5、8、9、11、12天;上述用药21 d为1个疗程。VCD治疗组化疗方案:硼替佐米,剂量1.3 mg/m2,疗程第1、4、8、11天;环磷酰胺(Baxter Oncology GmbH,批号6A096A),剂量300 mg/m2,疗程第1、8天;地塞米松注射液(福州海王福药制药,批号1604141),剂量20 mg/d,疗程第1、2、4、5、8、9、11、12天;上述用药21 d为1个疗程。所有患者均以上述相同方案完成化疗至少4个疗程。化疗过程中预防毒副作用的常规处理:常规使用维生素B12营养神经,加强水化、碱化尿液、补钙补钾、保护胃黏膜、保护肾功能等处理。所有患者均予以阿昔洛韦200 mg/次,2次/d,口服,常规预防性抗病毒治疗。治疗和随访期间密切监测各项临床指标。
1.3 观察指标及疗效评价标准
所有患者均以相同化疗方案治疗至少4个疗程。4个疗程结束后,进行疗效评价:依据国际骨髓瘤工作组(IMWG)2013年制定的多发性骨髓瘤疗效判定国际统一标准,分别检测治疗前、治疗4个疗程后的骨髓细胞学涂片、血免疫固定电泳,M蛋白等临床指标,将患者疗效判定为:完全缓解(CR),血、尿免疫固定电泳阴性,骨髓中浆细胞小于5%;非常好的部分缓解(VGPR),蛋白电泳未能检测出M蛋白但血或尿免疫固定电泳阳性或血清M蛋白降低≥90%且尿M蛋白<100 mg/24 h;部分缓解(PR),血清M蛋白降低50%~89%及24 h尿M蛋白减少≥90%或降至<200 mg/24 h;疾病稳定(SD),不符合CR、VGPR、PR及疾病进展标准;疾病进展(PD),血清M蛋白水平绝对值升高≥5 g/L,尿M蛋白升高绝对值≥200 mg/24 h。如果基线血清M蛋白≥50 g/L,则M蛋白增加≥10 g/L时即可认定PD。总有效率(ORR)=(CR+VGPR+PR)/总例数×100%。不良反应评价:所有患者在治疗期间均进行密切临床观察随访,并统计主要不良反应的例数和严重程度。临床观察的不良反应主要为:血液学毒性(与原发疾病不相关的中性粒细胞和/或血小板减少)、神经系统毒性、胃肠道反应(包括恶心、呕吐和便秘等)。
1.4 统计学处理
采用SPSS 17.0统计学软件进行统计分析。计量资料以(x±s)表示,采用t检验;计数资料以率(%)表示,采用字2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组临床疗效比较
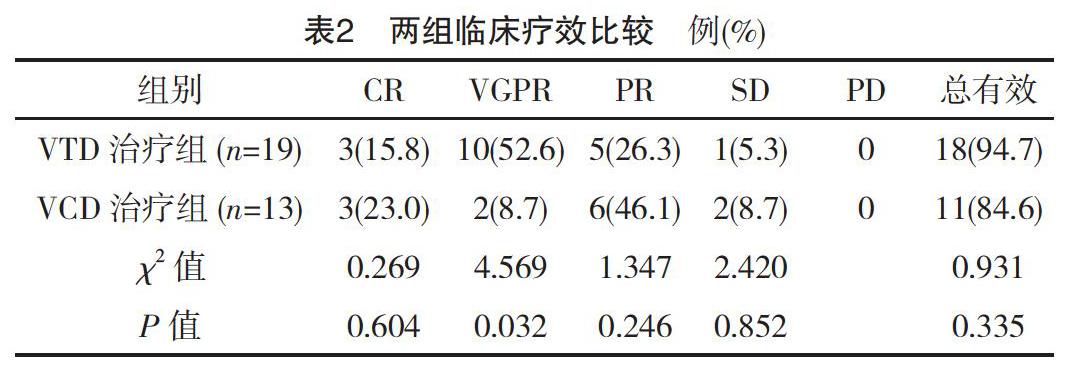
VTD治疗组与VCD治疗组CR率、PR率及总有效率比较差异无统计学意义(P>0.05),但VTD治疗组VGPR率优于VCD治疗组,差异有统计学意义(P<0.05),见表2。
2.2 两组不良反应发生情况比较
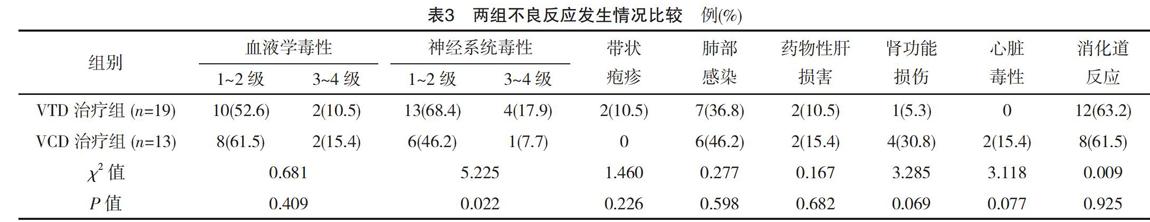
两组血液学毒性均较轻微(1~2级),少部分较为严重的血液学毒性也可经治疗后恢复;神经系统毒性较为常见,但严重且不可耐受的神经系统毒性少见,且VTD治疗组神经系统毒性发生率高于VCD治疗组,差异有统计学意义(P<0.05)。两组带状疱疹、肺部感染、药物性肝损伤、肾功能损伤、心脏毒性、消化道反应发生率比较差异无统计学意义(P>0.05),见表3。
3 讨论
多发性骨髓瘤(multiple myeloma,MM)是血液系统常见恶性肿瘤,其本质是一种浆细胞恶性克隆性疾病,常见临床表现有骨痛、贫血、肾功能不全、高钙血症、高黏滞血症等[6]。过去,由于检测手段和治疗方法的限制,本病易被误诊,早期诊断率不足30%,且预后极差,3年生存率低于30%。近年来,随着检测水平的飞速提高和新药的大量问世,以及造血干细胞移植的广泛实施,使多发性骨髓瘤的诊疗水平得到极大的发展,预后亦得到极大改善[7]。研究显示,诱导期达到完全缓解的患者具有更长的总体生存期和无病生存期,而在新药时代,多发性骨髓瘤的治疗目标是尽最大可能使患者达到完全缓解或非常好的部分缓解[8]。目前,以新药为基础的三药联合方案是得到包括NCCN指南在内的诸多国内外一线指南推荐的对于初治多发性骨髓瘤的一线治疗方案。其中,以硼替佐米和地塞米松为基础,联合沙利度胺(VTD)或环磷酰胺(VCD)的三药联合化疗方案是目前最常用的方案之一[9],也是笔者科室在临床实践中使用经验最丰富、疗效最为确切的化疗方案。
硼替佐米是人工合成的糜蛋白酶活性抑制剂,也是首个被批准用于临床的蛋白酶体抑制剂,可影响多条肿瘤信号通路并可改善骨髓造血微环境,是目前多发性骨髓瘤治疗的一线用药[10-11],其基础化疗方案为硼替佐米联合地塞米松的VD方案。国际大规模临床试验显示,VD加用沙利度胺的VTD方案和加用环磷酰胺的VCD方案(统称三药联合方案)较之VD方案有更强的临床疗效,且副作用可控[12]。因此,VTD方案与VCD均为临床可选的常用化疗方案。本文对福建省立医院血液科2013年1月-2017年12月收治的多发性骨髓瘤患者进行汇总分析,抽取使用VTD或VCD方案并完成化疗至少4个疗程的患者32例进行回顾性分析,评价两种方案的临床疗效及主要不良反应发生率,以期为未来的临床治疗选择提供更多的依据。
本文统计并对比硼替佐米、地塞米松联合沙利度胺的VTD方案与联合环磷酰胺的VCD方案在临床实践中的疗效与不良反应。其中,硼替佐米与地塞米松的剂量和给药时间、途径均一致。沙利度胺是近年来广泛应用于临床的血管生成抑制剂,其使用范围遍布于肿瘤及自身免疫病等各个领域[13]。其主要通过免疫调节、抑制肿瘤血管新生、经自由基介导造成肿瘤细胞DNA氧化损伤等作用抑制肿瘤细胞生长,且具备价格低廉、给药途径方便等优势[14]。环磷酰胺是长久以来在血液科使用的常用化疗药物,在多种血液系统恶性肿瘤中均有应用[15]。存在于VCD方案中的环磷酰胺剂量较之其在白血病、淋巴瘤中的应用剂量明显减少,因此不良反应也相应减少。笔者严格按照NCCN指南推荐的给药方案及剂量给药,观察两组患者4个疗程结束后的疗效,结果发现,VTD治疗组与VCD治疗组CR率、PR率及总有效率比较差异无统计学意义(P>0.05),但VTD治疗组VGPR率优于VCD治疗组,差异有统计学意义(P<0.05)。因此,可以认为VTD治疗组在疗效上比VCD治疗组更有优势,因为早期达到VGPR仍然是一个预后良好的预测指标。
沙利度胺的主要不良反应为周围神经炎、便秘、皮疹与血栓,研究显示,其不良反应的发生及严重程度与剂量成正相关[16],且50~200 mg/d的剂量对多发性骨髓瘤均可获得相似疗效。因此,探索小剂量沙利度胺对多发性骨髓瘤的疗效具备一定的临床意义。本文中大多数患者以50~150 mg/d的剂量给药,未发现需要立即停药的严重毒副作用。因为硼替佐米也存在较常见的神经系统毒性,因此,硼替佐米与沙利度胺联用可使神经系统毒副作用累积、增多。本研究观察到,VTD治疗组神经系统毒性发生率高于VCD治疗组,差异有统计学意义(P<0.05),这与预判相符,但以1~2级为主,总体风险可控。结论表明,中小剂量的沙利度胺也可以达到与常规剂量相似的治疗效果,并减少其治疗相关副作用。环磷酰胺的主要不良反应为肾脏毒性、血液系统毒性、出血性膀胱炎、消化道反应等[17]。多发性骨髓瘤的三药联合方案中环磷酰胺一般用量较小,药物相关不良反应较为轻微。本研究显示,VCD治疗组未出现危及生命的严重不良反应,与VTD治疗组相比,没有更显著的不良事件,仅在肾功能损伤发生率上存在接近统计学意义的结果。多发性骨髓瘤患者常伴有免疫抑制,因此感染,尤其肺部感染是其在化疗过程中的常见并发症[18-19]。观察结果显示,两组患者在肺部感染发生率上表现接近,经过合理的抗感染治疗后均得到理想控制。
结果分析显示,以硼替佐米和地塞米松为基础、联合沙利度胺或环磷酰胺的三药联合化疗方案,对初治多发性骨髓瘤的疗效确切,大多数患者均达到PR及以上的治疗结果。VTD治疗组与VCD治疗组CR率、PR率及总有效率比较差异无统计学意义(P>0.05),但VTD治疗组VGPR率优于VCD治疗组,差异有统计学意义(P<0.05),与文献[20]研究结果接近。不良反应的统计显示,VTD治疗组神经系统毒性发生率高于VCD治疗组,差异有统计学意义(P<0.05)。但是也应该注意到,本研究存在纳入病例数较少、观察时间较短、后续疗效不明确以及患者疾病亚型、初诊时脏器功能状态等不均一的缺陷。两种化疗方案的疗效与利弊还有待于更多病例、更长时间的观察来更明确地
判定。
参考文献
[1] Mateos M V,San Miguel J F.Management of multiple myeloma in the newly diagnosed patient[J].Hematology Am Soc Hematol Educ Program,2017,2017(1):498-507.
[2]侯健,李建勇,邱录贵.多发性骨髓瘤理论与实践[M].上海:上海科学技术出版社,2011:113-128.
[3]李佳丽,刘耀,曾东风,等.硼替佐米联合地塞米松和沙利度胺治疗多发性骨髓瘤的临床研究[J].第三军医大学学报,2012,34(24):2515-2517.
[4] Benboubker L,Dimopoulos M A,Dispenzieri A,et al.Lenalidomide and dexamethasone in transplant-ineligible patients with myeloma[J].N Engl J Med,2014,371:906-917.
[5]張之南,沈悌.血液病诊断及疗效标准[M].北京:科学出版社,2007:232-235.
[6] Weber D M,Chen C,Niesvizky R,et al.Lenalidomide plus dexamethasone for relapsed multiple myeloma in North America[J].N Engl J Med,2007,357:2133-2142.
[7] Reece D,Kouroukis C T,Leblanc R,et al.Practical approaches to the use of lenalidomide in multiple myeloma:a canadian consensus[J].Adv Hematol,2012(12):621958.
[8] Larocca A,Mina R,Gay F,et al.Emerging drugs and combinations to treat multiple myeloma[J].Oncotarget,2017,8(36):60656-60672.
[9] Kumar S K,Callander N S,Alsina M,et al.NCCN Guidelines Insights:Multiple Myeloma,Version 3.2018[J].J Natl Compr Canc Netw,2018,16(1):11-20.
[10] Attal M,Lauwers-Cances V,Hulin C,et al.Lenalidomide,Bortezomib,and Dexamethasone with Transplantation for Myeloma[J].N Engl J Med,2017,376(14):1311-1320.
[11]翁翔,顾超,翟丽娜,等.硼替佐米在多发性骨髓瘤治疗中的应用[J].中国肿瘤,2014,23(8):674-679.
[12] Hou J,Du X,Jin J,et al.A multicenter,open-label,phase 2 study of lenalidomide plus low-dose dexamethasone in Chinese patients with relapsed/refractory multiple myeloma:the MM-021 trial[J].J Hematol Oncol,2013(6):41.
[13]刘爱军,李利红,黄仲夏,等.硼替佐米、地塞米松加或不加沙利度胺治疗多发性骨髓瘤67例疗效分析[J].中华血液学杂志,2010,31(7):486-488.
[14]袁红建,孙善芳,潘怀富,等.硼替佐米聯合地塞米松、沙利度胺方案治疗多发性骨髓瘤的疗效[J].临床医学,2012,32(11):38-40.
[15]陈建霖,董丽华,郭小卫,等.硼替佐米联合环磷酰胺和地塞米松治疗多发性骨髓瘤28例临床观察[J].临床血液学杂志,2010,23(3):89-91.
[16]陈飞,王玉娟,张克俭,等.硼替佐米联合地塞米松及沙利度胺治疗多发性骨髓瘤临床观察[J].临床血液学杂志,2011,24(3):176-177.
[17] Kim K,Lee J H,Kim J S,et al.Clinical profiles of multiple myeloma in Asia-An Asian Myeloma Network study[J].Am J Hematol,2014,89:751-756.
[18] Vallet S,Podar K.New insights,recent advances,and current challenges in the biological treatment of multiple myeloma[J].Expert Opin Biol Ther,2013,13(Suppl 1):S35-53.
[19] Arnulf B,Pylypenko H,Grosicki S,et al.Updated survival analysis of a randomized,phase 3 study of subcutaneous versus intravenous bortezomib in patients with relapsed multiple myeloma[J].Haematologica,2012,97:1925-1928.
[20] Moreau P,Hulin C,Macro M,et al.VTD is superior to VCD prior to intensive therapy in multiple myeloma:results of the prospective IFM2013-04 trial[J].Blood,2016,127(21):2569-2574.
(收稿日期:2019-06-03) (本文编辑:马竹君)

