新疆巴州幼年与成年牦牛瘤胃细菌区系多样性分析
聂召龙 刘书杰 崔占鸿 潘 浩 柴沙驼 孙 璐 张晓卫 冯宇哲
(青海大学畜牧兽医科学院/青海省牦牛工程技术研究中心/青海省高原放牧家畜动物营养与饲料科学重点实验室,青海 西宁 810016)
牦牛作为青藏高原及其邻近地区的优势品种,主要分布于海拔3 000米以上的地区。目前,中国约有1 600万头牦牛,主要分布在青海、西藏、四川、甘肃及新疆等地区[1-2]。新疆巴州牦牛是由上世纪20年代初,从西藏引入的牦牛,经过近一个世纪,由蒙古族游牧民在特定环境下繁育形成的具有共同来源、体形外貌较一致、产肉性能良好、适应性强的牦牛类群。研究表明,地理位置、家畜年龄、季节条件等在一定程度上能够影响反刍动物的生长状况[3-4]。牦牛作为反刍家畜,瘤胃是其主要的消化场所,与其生产性能密切相关。而反刍动物的瘤胃细菌群落结构会因年龄的增长而变化,所以探究不同年龄牦牛瘤胃微生物的变化规律,对于研究其瘤胃发育与代谢、营养调控关系具有重要意义[5-6]。
对于牦牛而言,幼年期是从断奶到性成熟这段时间,约0.5~2岁之间。牦犊牛从母乳喂养过渡到采食饲料,随着饲料摄入量的增加,其消化能力增强。牦牛在2~4岁之间时,其生长发育接近成熟,体形基本固定,绝对增重达到峰值。动物成年期是指从生理成熟到开始衰老这段时间,牦牛约为4~8岁,成年牦牛组织器官发达,生理功能成熟,代谢水平稳定,生产性能最高,是利用牦牛的最佳时机。本研究通过对比较分析疆巴州1岁幼年与4岁成年牦牛瘤胃细菌区系的多样性,探究在采食粗饲料条件下不同年龄牦牛瘤胃细菌区系组成的差异性,以期为不同年龄牦牛饲养的瘤胃营养调控与科学补饲提供参考依据。
1 材料与方法
1.1 样品采集
在新疆维吾尔自治区(以下简称“新疆”)巴州和静县新疆牦牛种牛场选取放牧饲养的同一牛群的1岁幼年巴州牦牛和4岁成年巴州牦牛各3头,其中巴州牦牛是牦牛的一个地方品种名,在新疆巴州和静县均有分布。幼年组3头公牦牛,体重123~127 kg;成年组3头公牦牛,体重355~363 kg。在2018年10月中旬,将6头牦牛于同一天屠宰,屠宰后采集其瘤胃内容物并快速放入液氮中冻存,备用。
1.2 新疆巴州牦牛瘤胃微生物总DNA的提取
将37份幼年牦牛瘤胃内容物等量混合,搅拌均匀后称取0.15 g瘤胃内容物倒入研钵中,37份成年牦牛瘤胃内容物作相同处理。加入1.5 mL 1% CTAB抽提液,经液氮研磨法处理后,倒入2 mL离心管中混匀,然后加入20 μL 10 mg·mL-1蛋白酶K和250 μL 10%十二烷基硫酸钠(sodium dodecyl sulfate, SDS),65℃恒温水浴2 h(注意每隔20 min颠倒混匀几次),最后 7 000×g 离心10 min,保留上清液。避开上层的漂浮物,取中层溶液,加入等体积苯酚∶氯仿∶异戊醇(25∶24∶1)抽提,然后于4℃条件下12 000×g离心5 min,取上层溶液,重复上述操作1次,至上清液无浑浊。将上述上清液混合,采用氯仿∶异戊醇(24∶1,v/v)萃取,然后于4℃条件下12 000×g离心5 min,保留上清液。于上清液中加入0.6倍体积的异丙醇,沉淀2 h,于4℃条件下12 000×g离心15 min,弃上清液,然后用75%乙醇洗涤沉淀,晾干后用50 μL TE(pH值8.0,含10 mg·μL-1RNase)进行溶解,在37℃恒温水中浸泡30 min,得到总DNA溶解液,于-20℃保存。
1.3 新疆巴州牦牛瘤胃微生物总DNA浓度的测定
采用TU-1810APC紫外分光光度计(北京普析通用仪器有限责任公司)分别于260、280 nm波长处测定瘤胃微生物粗提DNA的吸光度值和浓度,计算OD260/OD280值。
DNA浓度(μg·mL-1)=A260×50 μg·mL-1×稀释倍数。
1.4 凝胶电泳检测
使用DYCZ-23A型电泳仪(北京六一生物科技有限公司)对瘤胃微生物粗提DNA进行凝胶电泳检测(1%琼脂糖)。电泳条件:调节电压100 V,电泳30 min,当溴酚蓝染料移动到距凝胶前沿1~2 cm处,停止电泳。使用WD-9413B凝胶成像分析仪(北京六一生物科技有限公司)观察电泳条带;凝胶成像分析系统处理瘤胃微生物DNA电泳结果。
1.5 16S rRNA基因扩增瘤胃微生物DNA电泳结果
以5、10、25、50倍的瘤胃微生物总DNA稀释液为模板,采用预混Taq法扩增瘤胃微生物总DNA。反应体系总体积为50 μL,其中模板为0.5 μL,引物(100 μmol·L-1)0.1 μL,premixed Taq 25 μL,ddH2O 24.3 μL。引物为27 F 5′-AGGATTATCM TGGCTCAG-3′和1492 R 5′-GGTTACTTGTTACGACT-3′。扩增程序:95℃预变性5 min;95℃变性30 s,55℃退火30 s,72℃延伸90 s,共30个循环;72℃延伸10 min。扩增完成后采用1%琼脂糖进行凝胶电泳检测。
1.6 目的基因克隆及测序
采用PMD18-T Vector进行目的DNA片段连接与纯化回收。目的DNA片段的连接:4 μL DNA样品、1 μL载体和15 μL DNA连接酶溶液,于16℃条件下反应30 min。目的DNA片段的转化:取感受态细胞,在冰上将感受态细胞融化(2 min),然后加入10 μL上述连接体系,于冰上放置30 min,42℃热激90 s,再于冰上放置3~5 min,加入500~700 μL液体LB培养基,最后于37℃摇床培养箱中培养1 h。转化的感受态细胞过夜培养后会在平板上形成很明显的蓝白色菌落,其中白色菌落代表阳性克隆。在无菌操作台中,于氨苄青霉素(Ampicilin, AMP)抗性LB平板上提前涂布4 μL 1mol·L-1IPTG和40 μL 20 mg·μL-1X-gal,晾干。取已经转化完成的感受态细胞,4 000×g离心3 min,保留200 μL上清液。用移液枪将上清液中的感受态细胞吹打混匀,取100 μL进行涂布平板,置于37℃恒温培养箱内进行过夜培养。对阳性克隆进行氨苄西林抗性和蓝白斑筛选。随机选择300株单白细菌,在高频振荡培养基中37℃培养6~8 h。以M13F(-47)5′-C G C C G T T C C C A G T C A C G AC-3′和M13R(-48)5′-A G G A T A A C A A C A C G GA-3′作为引物进行假阳性克隆检验。送至上海生工生物工程股份有限公司进行检验,检验后确定为阳性克隆菌液。M13F(-47)5′-C G C C A G T T C C C A T C A C A C GA-3′和M13R(-48)5′-A GCGGA TaCaaT A T C A C A C A C GA-3′作为测序引物。
1.7 数据分析
采用 FLASH(V1.2.7)软件对原始数据进行拼接和质控,得到有效数据,然后用 Qiime(V1.7.0)软件过滤嵌合体,最后得到有效片段,用作后续分析。
利用 Uparse v7.0 软件对全部有效片段进行 OTUs 聚类,采用 Mothur 方法和 SILVA[7]的SSU rRNA 数据库[8]对16S rRNA基因序列样品进行物种注释,获得样品在门和属水平上的分类信息,然后分别在门和属水平上分析并统计2种16S rRNA基因序列样本的群落组成,并用Alpha分析4个样本菌群丰度及相对丰度。使用R语言计算Chao1指数和Shannon指数,并绘制稀释图案,比较分析群的丰度和多样性。
2 结果与分析
2.1 新疆巴州牦牛瘤胃微生物总DNA的提取结果
由图3可知,成年巴州牦牛和幼年巴州牦牛的瘤胃微生物粗提DNA凝胶电泳获得的条带位置都远大于10 kb,说明从牦牛瘤胃微生物中均提取到了较为完整的大片段DNA片段。凝胶孔和条带都比较明亮,说明粗提DNA中含有某些多糖、RNA片段和一些大分子物质,也可能是部分DNA片段被降解所导致的。

表1 新疆巴州牦牛瘤胃微生物的粗提DNA OD260/OD280值及浓度Table 1 Crude extract DNA OD260/OD280 ratio and concentration of Bazhou yak in Xinjiang

Note: M: Marker.图1 新疆巴州牦牛的瘤胃微生物粗提总DNA电泳图Fig.1 Total DNA electrophoresis map of rumen microorganisms of Bazhou yak in Xinjiang
纯DNA的OD260/OD280值范围在1.7~2.0之间,当OD260/OD280值大于2.0时,说明DNA样品中含有较多的RNA杂质;当OD260/OD280值小于1.6时,说明DNA样品中混有蛋白质[9]。由表1可知,幼年巴州牦牛和成年巴州牦牛瘤胃微生物的DNA的OD260/OD280值分别为1.72、2.12,说明提取的成年牦牛瘤胃微生物DNA中含有部分RNA。OD260为1时相当于双链DNA浓度为50 μg·mL-1,OD260值越高,DNA浓度越大[9]。因此,本试验所提取的幼年巴州牦牛和成年巴州牦牛瘤胃微生物的DNA浓度均大于100 μg·mL-1。
2.2 新疆巴州牦牛牛瘤胃微生物目的基因的PCR扩增及纯化回收
由图2可知,粗提DNA进行PCR扩增后获得的DNA片段大小为1.5 kb,用不同稀释倍数的DNA作为模板进行PCR扩增,其条带的明亮程度不同,在此选用模板稀释倍数最小且条带最明亮的PCR产物用于后续试验,即成年巴州牦牛和幼年巴州牦牛均选择模板5倍稀释后获得的PCR产物。
将用于后续试验的PCR产物使用琼脂糖凝胶纯化回收试剂盒进行纯化回收,回收的DNA为无色,且回收的样品DNA OD260/OD280值在1.7~2.0之间,满足较纯DNA的要求,其回收率为50%~65%。纯化回收后的DNA样品于-20℃保存备用。

注:从左到右每4个孔为一组,依次为该样品DNA 5倍、10倍、25倍、50倍稀释后的PCR结果。Note: From left to right, each of the four wells was a group, and the PCR results were 5 times, 10 times, 25 times and 50 times diulted DNA of the sample.图2 新疆巴州牦牛瘤胃微生物的粗提DNA的PCR扩增Fig.2 PCR amplification of crude DNA from rumen microorganisms of Bazhou yak in Xinjiang
2.3 新疆巴州牦牛瘤胃微生物目的基因的克隆及测序结果
转化的感受态细胞过夜培养后会在平板上形成很明显的蓝白色菌落,白色菌落代表阳性克隆。挑取300个阳性克隆单菌落高频摇床培养6~8 h后,培养基由透明变浑浊,然后对这300个阳性克隆进行假阳性克隆检验。由图3可知,阳性克隆在凝胶电泳图中都具有条带,且条带大都出现在1.5 kb处;部分阳性克隆的条带位置出现在小于1.5 kb处,说明此克隆在转化试验时与载体连接的DNA片段长度小于1.5 kb,这部分阳性克隆需要剔除。选择在1.5 kb处有明亮条带的阳性克隆送至上海生工生物工程股份有限公司测序,测序结果采用16S rRNA基因序列分析技术进行分析。每个样品符合这些条件的阳性克隆约有135个。
图3 新疆巴州牦牛瘤胃微生物目的基因的假阳性克隆检验凝胶电泳图(部分)Fig.3 Gel electrophoresis of false positive clones of rumen microbial target genes of Bazhou yak in Xinjiang
2.4 新疆巴州牦牛瘤胃微生物目的基因的测序结果及嵌合体检测
由表2可知,幼年巴州牦牛和成年巴州牦牛瘤胃微生物目的基因的阳性克隆送检个数分别为145和138个。测序过程中会出现一部分序列测序失败或送交的菌液是非单克隆而导致测序失败的情况,因此幼年巴州牦牛和成年巴州牦牛胃微生物目的基因的阳性克隆中测序成功序列的个数分别为142和133个。使用Bellerophon软件检测可能的嵌合体序列,去除这些可能的嵌合体序列,最终幼年巴州牦牛和成年巴州牦牛胃微生物目的基因的阳性克隆中可用的基因序列个数分别为137和121个。

表2 新疆巴州牦牛瘤胃微生物目的基因阳性克隆基因的测序结果Table 2 Sequencing results of positive clones of target genes in rumen microorganisms of Bazhou yak in Xinjiang
2.5 新疆巴州牦牛瘤胃细菌Mothur分析结果
相似性大于97%的序列划分为一个操作归类单元(operational taxonomic units, OTU)。OTUs数目越大,代表瘤胃微生物越丰富。Mothur分析结果显示,幼年巴州牦牛瘤胃细菌共统计128个OTUs序列,成年牦牛共统计112个OTUs序列,表明幼年巴州牦牛瘤胃细菌较成年巴州牦牛瘤胃丰富。
2.6 新疆巴州牦牛瘤胃细菌的优势菌群在门水平上的分析
厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)的细菌均已在陆生哺乳动物和海洋哺乳动物肠道中检测到,且探究了这2种细菌的多样性丰度[9-10]。由表3、图4和图5可知,幼年巴州牦牛和成年巴州牦牛的瘤胃菌群被显著分为两类,其中厚壁菌门均占据较大比例,且有着很高的表达量,幼年巴州牦牛瘤胃内厚壁菌门所占比例(70.31%)高于成年巴州牦牛瘤胃(66.96%);拟杆菌门是巴州牦牛瘤胃内的第二大优势菌门,同样有着较高的表达量,在2个年龄段的巴州牦牛瘤胃菌群中所占比例略有不同,幼年巴州牦牛瘤胃内拟杆菌门所占比例(21.87%)低于成年巴州牦牛(24.11%);巴州牦牛瘤胃内其他菌门所占比例都很少且表达量较低,其中软皮菌门(Tenericutes)在成年巴州牦牛瘤胃内占3.57%,在幼年巴州牦牛瘤胃内仅占0.78%;疣孢菌门(Verrucomicrobia)在成年巴州牦牛瘤胃内占0.89%,在幼年巴州牦牛瘤胃内所占比例为2.34%。此外,疣孢菌门、变形杆菌门(Proteobacteria)和蓝藻门(Cyanobacteria)在幼年巴州牦牛瘤胃中的表达量高于成年巴州牦牛,而软皮菌门、纤维杆菌门(Fibrobacteres)和黏胶球形菌门(Lentisphaerae)在成年巴州牦牛瘤胃中的表达量高于幼年巴州牦牛。

图4 新疆巴州牦牛瘤胃细菌在门水平上的相对丰度Fig.4 Relative abundance of rumen bacteria at phylum level of Bazhou yak in Xinjiang
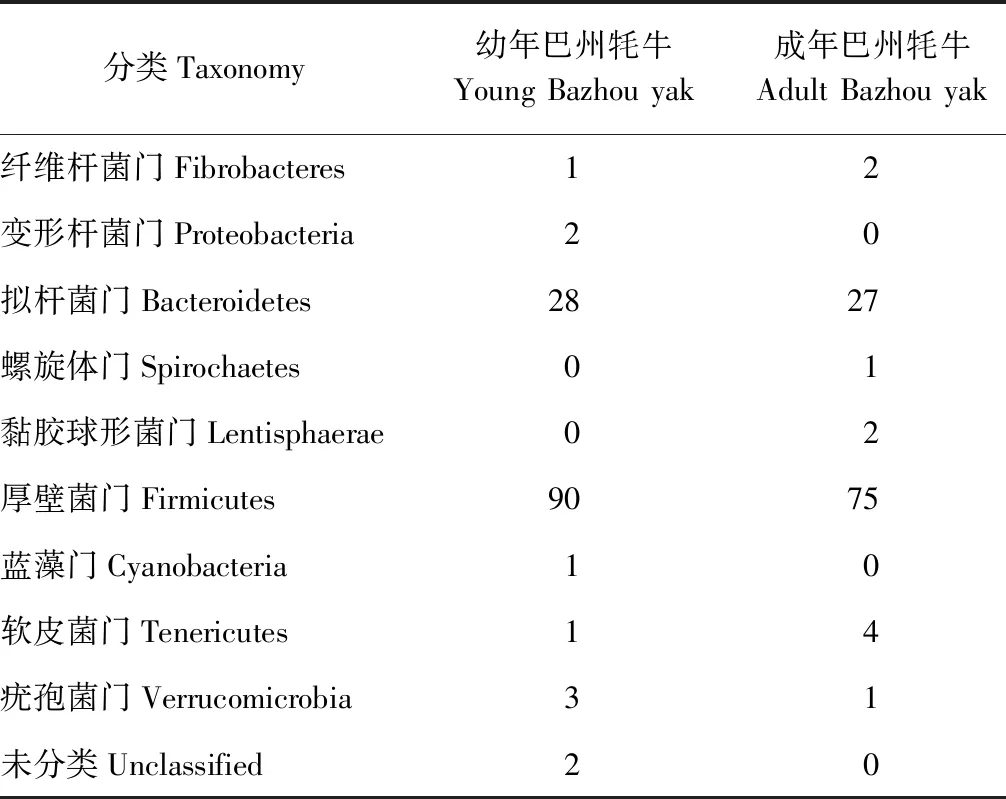
表3 新疆巴州牦牛瘤胃中细菌在门水平上的分布Table 3 Distribution of bacteria in rumen at phylum level of Bazhou yak in Xinjiang
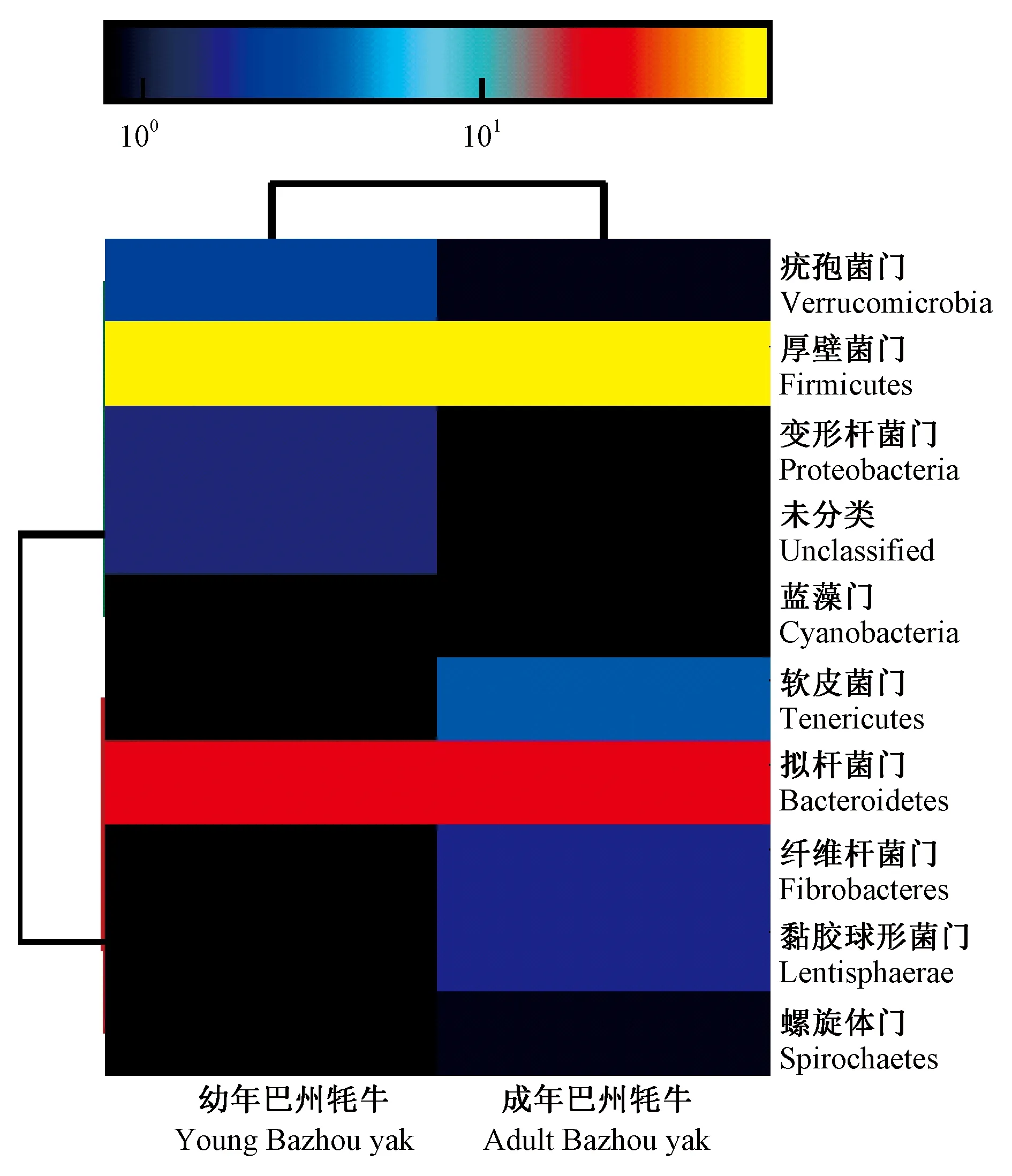
图5 新疆巴州牦牛瘤胃细菌在门水平上的热图Fig.5 Heat map of rumen bacteria at phylum level of Bazhou yak in Xinjiang
2.7 新疆巴州牦牛瘤胃细菌的优势菌群在属水平上的分析
细菌属水平上的丰度分析较门水平上的丰度分析更加困难。由表4、图6和图7可知,属水平上的丰度分析中,巴州牦牛牛瘤胃细菌被分为 2 类,能够明确分类的只有很少一部分,更多的还不能分出类别,且未能分出类别的菌属表现出很高的表达量,其类别和功能有待进一步深入研究。能够明确类属的普雷沃菌属(Prevotella)在幼年巴州牦牛瘤胃内所占比例(4.69%)高于在成年巴州牦牛(2.68%);瘤胃球菌属(Ruminococcus)在幼年巴州牦牛瘤胃内所占比例(4.69%)高于成年巴州牦牛(1.79%);琥珀酸菌属(Succiniclasticum)在幼年巴州牦牛瘤胃内所占比例(2.34%)低于成年巴州牦牛(4.46%);丁酸弧菌属(Butyrivibrio)在幼年巴州牦牛瘤胃内所占比例(5.47%)与成年巴州牦牛(5.35%)相差不大。此外,幼年巴州牦牛和成年巴州牦牛瘤胃细菌中不能分出类别的菌属所占比例分别为70.31%、75.89%。

图6 新疆巴州牦牛瘤胃细菌在属水平上的相对丰度图Fig.6 Relative abundance map of rumen bacteria at genus level of Bazhou yak in Xinjiang

图7 新疆巴州牦牛瘤胃细菌在属水平上的热图Fig.7 Heat map of rumen bacteria at genus level of Bazhou yak in Xinjiang
2.8 新疆巴州牦牛瘤胃细菌的Alpha多样性分析
Chao 1指数能够表征物种的丰度;Shannon指数反映群落均匀度和多样性的变化[11-13]。为探究幼年与成年巴州牦牛瘤胃细菌菌群的丰度差异,对聚类结果进行Chao 1、Shannon 指数分析。由图8、9可知,幼年巴州牦牛和成年巴州牦牛瘤胃细菌的Chao 1指数分别是783.50和544.00,Shannon指数分别是4.68和4.52,说明幼年巴州牦牛瘤胃内细菌的丰度和细菌群落多样性均高于成年巴州牦牛。
3 讨论
牦牛瘤胃微生物复杂而多变,瘤胃微生物区系结构和种群数量会因年龄的改变而改变。本研究结果表明,新疆幼年巴州牦牛菌群丰度高于成年巴州牦牛瘤胃,瘤胃细菌多样性也更丰富。此外,幼年巴州牦牛瘤胃细菌能分类到门的OTUs是9个,能分类到属的是17个。吴婷婷[14]研究羔羊的胃肠道菌群,分类到的门和属的OTUs都是10个;Nathani等[15]发现印度野牛瘤胃微生物中能分类到门的OTUs是6个,能分类到的属是14个;周熊艳等[16]在云南大额牛瘤胃微生物的研究中发现能分类到门的OTUs是9个,能分类到属的是3个,但其能分类到种水平上的是10个。综上,与其他反刍家畜相比,巴州牦牛的瘤胃细菌多样性更丰富,表明牦牛瘤胃细菌区系维持稳态的能力更强,是牦牛适应高海拔气候环境条件和耐粗饲的良好表现。

表4 新疆巴州牦牛瘤胃细菌在属水平上的分布Table 4 Distribution of rumen bacteria at genus level of Bazhou yak in Xinjiang
研究表明,牦牛在消化器官结构、放牧行为、氮利用效率、甲烷排放、季节间能量分布等方面均优于黄牛,且从牦牛全基因组测序中找到了适应高寒营养胁迫的相关功能基因[17]。推断,长期的极端环境与营养胁迫,使细菌在牦牛瘤胃中分别形成了特殊的分布模式,以帮助宿主提高能量利用效率和有效应对营养匮乏的情况。Eckburg等[18]和Ley等[19]推测厚壁菌门和拟杆菌门是哺乳动物肠道中最主要的两大菌门。已有报道证实,厚壁菌门和拟杆菌门在人类和猫科动物的胃肠道菌群中均占有较高的丰度[20-21]。关于牛的研究也发现,拟杆菌门是水牛和荷斯坦牛瘤胃内细菌的优势菌门[22-23];厚壁菌门是瘤胃中占比最多的优势菌门[24-27]。曹连宾等[28]报道,牦牛在放牧和舍饲两种状态下,瘤胃细菌都是以厚壁菌门为最优势菌门,拟杆菌门次之。本研究中,厚壁菌门也是巴州牦牛瘤胃中的最优势菌门,两个不同年龄阶段(幼年和成年)巴州牦牛瘤胃细菌OTUs序列分属于拟杆菌门、厚壁菌门、变形杆菌门和放线菌门等9个菌门,其中厚壁菌门所占比例为66.96%~70.31%,拟杆菌门所占比例为21.87%~24.11%。此外,与其他品种牛的研究结果[29-30]相比,在幼年巴州牦牛瘤胃中还发现了蓝藻门(Cyanobacteria)细菌。研究表明,在胃肠道中的蓝藻门细菌主要参与维生素B和维生素K的合成[31],这种细菌在幼巴州牦牛瘤胃中占高比例可能有助于牦牛发展强壮的骨骼,有效释放能量和保持基因稳定性以应对青藏高原放牧系统的恶劣条件,如8个月的寒冷季节压力、强烈紫外线和缺氧等。但需要进一步研究来证实这一假设,并通过测量胃肠道和血液中的维生素水平为该假设提供更直接的证据。崔占鸿等[32]推测,青海放牧牦牛瘤胃内溶纤维丁酸弧菌属的相似序列数量明显多于白色瘤胃球菌、黄色瘤胃球菌、产琥珀酸丝状杆菌3种纤维降解菌,本研究结果与之相似,溶纤维丁酸弧菌属在幼年巴州牦牛瘤胃内所占比例(5.47%)和在成年巴州牦牛瘤胃内所占比例(5.35%)高于其他纤维降解菌,进一步证明溶纤维丁酸弧菌属对瘤胃内纤维降解以及瘤胃发酵有着至关重要的作用。

图8 新疆巴州牦牛瘤胃细菌的Chao 1指数分析图Fig.8 Chao 1 index analysis of rumen bacteria of Bazhou yak in Xinjiang

图9 新疆巴州牦牛牛瘤胃细菌的Shannon指数分析图Fig.9 Shannon index analysis of rumen bacteria of Bazhou yak in Xinjiang
瘤胃微生物的数量和种类会因诸多因素的不同而有所差异,包括动物种类、动物年龄、健康状况和饲料等,其中动物年龄是影响瘤胃微生物多样性的主要因素之一[33-35]。Chao 1指数分析得到细菌中幼年巴州牦牛瘤胃细菌物种丰富度高于成年巴州牦牛,这可能是由于幼年巴州牦牛刚断奶不久,瘤胃消化吸收的功能正在转化建立的过程中[36],随着日龄的增加,食物中微生物不断进入瘤胃,且此时瘤胃还未形成稳定的菌群区系,因此早期进入到瘤胃中的各种微生物都有可能被检测到。但随着年龄的增加,瘤胃功能不断完善,微生物区系逐渐趋于稳定平衡,一些菌群逐渐被优势菌群取代甚至消失[37-38]。本试验中Shannon指数分析显示,幼年巴州牦牛瘤胃细菌物种多样性高,这可能是由于在瘤胃发育的早期,其内部尚未建立有效的竞争机制,此时进入瘤胃的微生物都可存在于瘤胃中,而成年后,随着竞争机制的完善,一些菌群逐渐适应了这种竞争机制而变成了优势菌群,而另一些菌群丰度变得很低甚至消失,物种多样性减少[39]。
目前,瘤胃微生物只能培养10%~20%,微生物的研究主要依赖于纯菌株的分离和鉴定,80%~90%的瘤胃微生物不能被识别和利用。本试验对新疆巴州牦牛瘤胃细菌菌群结构的比较研究也只到属水平,故下一步将致力于牦牛瘤胃微生物的分离和培养,更深入地探究牦牛瘤胃微生物的功能和稳态机制。
4 结论
本试验结果表明,新疆巴州牦牛瘤胃微细菌的数量和种类会因年龄阶段的不同而有所差异,幼年和成年巴州牦牛瘤胃细菌都是以厚壁菌门和拟杆菌门为主,两者的表达量也相对较高,其他菌类所占比例较少,且牦牛瘤胃纤维降解菌主要分布于厚壁菌门,同时纤维降解菌是放牧牦牛瘤胃内的优势菌群,这与牦牛的生存环境较恶劣,主要采食粗饲料,需要消化大量纤维有关。牦牛瘤胃细菌多样性也会因为年龄的变化而受到影响,幼年巴州牦牛瘤胃消化吸收的功能正在转化建立的过程中,所以Chao 1指数、Shannon指数,以及细菌物种丰度和多样性均高于成年巴州牦牛。本研究主要分析在采食粗饲料条件下巴州1岁幼年牦牛和4岁成年牦牛瘤胃细菌区系组成的差异性,为不同年龄牦牛饲养的瘤胃营养调控与科学补饲提供了参考依据。

