没食子酸对海鳗肌原纤维蛋白氧化及凝胶特性的影响
胡 熠 张进杰 唐 艳 杨文鸽 徐大伦 楼乔明
(宁波大学食品与药学学院/浙江省动物蛋白食品精深加工技术重点实验室,浙江 宁波 315211)
海鳗(Muraenesoxcinereus)在我国海洋渔业中占有重要地位,2017年捕捞量达39万t[1]。除鲜销外,海鳗常被制成风味独特的鳗鲞或鱼糜制品,深受消费者喜爱[2]。但由于海鳗富含蛋白质、不饱和脂肪酸、过渡态的金属离子及其他促氧因子,使其在加工和贮藏过程中极易氧化劣变[3]。而肌原纤维蛋白(myofibrillar protein,MP)是蛋白质的主要成分,有着良好的胶凝性,且在热诱导作用下能形成三维网状结构,赋予产品较好的质地、感官及保水性[4]。研究表明,蛋白氧化会降低肉的质地、口感、风味及保水性,缩短产品的货架期[5]。因此,控制海鳗肌肉蛋白氧化,提高鱼糜的凝胶强度对海鳗制品的影响意义重大。
合成抗氧化剂,如没食子酸丙酯(propyl gallate,PG)、叔丁基羟基茴香醚(butylated hydroxyl anisole,BHA)、叔丁基对苯二酚(tert-butyl hydroquinone,TBHQ)和二丁基羟基甲苯(butylated hydroxyl toluene,BHT)等,由于具有良好的抗氧化效果且价格相对低廉等优点,一直被广泛用于食品中。但近年来研究显示,摄入合成抗氧化剂对人体健康有潜在的危害,如诱发畸形和癌症等[6-8]。植物多酚是植物组织中一种具有抗氧化性能的天然物质,在食品中应用不仅能起抗氧化作用,还能提高蛋白质的交联作用[9]。目前,植物多酚类物质主要应用于抑制水产品脂质氧化,但有关水产品蛋白质氧化抑制的研究较少[10]。没食子酸(gallic acid,GA)易溶于水,且含有多个酚羟基,能够有效地清除自由基[11]。因此,可将GA应用于水产品蛋白质氧化抑制研究,并进一步研究GA对蛋白凝胶的交联作用。本研究采用羟自由基氧化体系,以海鳗MP总巯基、羰基含量及表面疏水性为生化指标,结合圆二光谱分析蛋白质的空间结构,并观察凝胶微观结构变化,探究GA对海鳗MP氧化抑制与凝胶特性的影响,以期为GA在海鳗加工与贮藏过程中的实际应用提供理论依据。
1 材料与方法
1.1 材料与试剂
鲜活海鳗,每条重750±15 g,体长50±3 cm,购自宁波路林水产交易中心。购买后于冰藏条件下快速运回实验室,清洗后去除头尾、内脏,清洗沥干,沿脊柱分为两半后真空包装,每包100 g。
三氯化铁、双氧水、没食子酸、三氯乙酸(trichloroacetic acid,TCA)、十二烷基硫酸钠,国药集团化学试剂有限公司;5, 5′-二硫代2-硝基苯甲酸(5, 5′ -dithio-2-nitrobenzoic acid,DTNB)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、2,4-二硝基苯肼(2, 4-dinitrophenylhydrazine,DNPH),美国Sigma公司;牛血清白蛋白(bovine serum albumin,BSA),上海生工生物工程股份有限公司;福林酚试剂,北京索莱宝科技有限公司。
1.2 主要仪器与设备
Biofuge stratos台式高速冷冻离心机,美国Thermo Scientific公司;SpectraMax i3多功能酶标仪,美国Molecular Devices公司;TF-SC-50真空冷冻干燥机,北京博医康实验仪器公司;Jasco J-1500圆二色谱、S-3400N 扫描电镜,日本日立公司;CR-400便携式色差仪,日本日立公司。
1.3 试验方法
1.3.1 MP提取及浓度测定 参照Chin等[12]的方法。随机选取20 g分装鱼肉并切碎,取适量加入10倍体积(以取肉量为标准)pH值7.5的20 mmol·L-1磷酸盐缓冲溶液(phosphate buffered solution,PBS),匀浆30 s后用冷冻离心机7 500 r·min-1离心10 min,弃上清液,然后重复上述操作2次,合并沉淀。粗提的蛋白沉淀加入10倍体积0.1 mol·L-1NaCl溶液,匀浆后7 500 r·min-1离心10 min,保留沉淀,并将沉淀加入8倍体积20 mmol·L-1PBS溶液(含0.1 mol·L-1NaCl,pH值7.5),匀浆30 s后用4层纱布过滤,滤液用冷冻离心机7 500 r·min-1离心15 min,沉淀即为MP。采用福林酚法测定MP浓度,以BSA为标准蛋白。
1.3.2 羟自由基氧化体系的构建 本试验采用的羟自由基氧化体系主要由抗坏血酸(0.1 mmol·L-1)、FeCl3(0.1 mmol·L-1)和H2O2(2 mmol·L-1)组成。反应过程:抗坏血酸+Fe3+→Fe2+;Fe2++H2O2→·OH[13]。
1.3.3 GA添加及蛋白氧化处理 参照张慧芸等[14]的方法。试验分为7组,第1组为空白对照组,蛋白未氧化,不添加GA,记作NonOx;第2~第7组为试验组,依次加入不同质量分数的GA(0%、0.05%、0.10%、0.15%、0.20%、0.25%,GA添加量以蛋白质含量为基准),分别记作Ox、Ox + GA(0.05%)、Ox + GA(0.10%)、Ox + GA(0.15%)、Ox + GA(0.20%)、Ox + GA(0.25%)。将2~7组的MP溶解于50 mmol·L-1含有羟自由基氧化体系的PBS溶液(pH值6.0)中,使得蛋白浓度为20 mg·mL-1。所有样品混合振荡1 min,4℃条件下放置12 h,使样品发生不同程度氧化,最后加入1 mmol·L-1EDTA终止氧化反应。
1.3.4 总巯基含量测定 根据Benjakul等[15]的方法,并略作修改。在1 mL蛋白液中加入9 mL Tris-HCl溶液(含8 mol·L-1尿素、2% SDS、10 mol·L-1EDTA,pH值 6.8),混匀后取4 mL加入0.4 mL 0.1% DTNB溶液,摇匀后于40℃水浴25 min,测定其在412 nm波长处的吸光度值。按照公式计算总巯基含量:

(1)
式中,ρ为蛋白溶液质量浓度,mg·mL-1;13 600为巯基摩尔消光系数,L·mol-1·cm-1;11为稀释倍数。
1.3.5 羰基含量测定 参照Zhou等[16]的方法,并略作修改。在1 mL蛋白液加入1 mL 10 mmol·L-1DNPH(3 mol·L-1HCl配制),暗处反应1 h后加入 1 mL 20% TCA,4℃条件下10 000 r·min-1离心10 min,沉淀用1 mL乙酸乙酯-乙醇(1∶1,v/v)洗涤3次,然后加入3 mL 6 mol·L-1的盐酸胍溶液溶解沉淀(37℃,15 min),最后在4℃条件下10 000 r·min-1离心5 min,测定上清液在370 nm波长处的吸光度值。按照公式计算羰基含量:
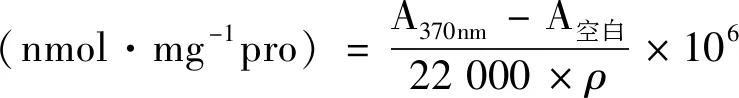
(2)
式中,ρ为蛋白溶液质量浓度,mg·mL-1;22 000为羰基摩尔消光系数,L·mol-1·cm-1。
1.3.6 表面疏水性测定 参照Chelh等[17]的方法。表面疏水性用溴酚蓝(bromophenol blue,BPB)含量表示。在1 mL蛋白质溶液中加入200 μL 1 mg·mL-1BPB,对照组用1 mL PBS代替,振荡摇匀后于室温下反应10 min,4℃条件下7 000 r·min-1离心15 min,保留上清液。取1 mL上清液并稀释10倍,然后测定其在595 nm波长处的吸光度值。按照公式计算溴酚蓝含量:
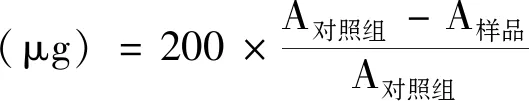
(3)
式中,200为溴酚蓝质量,μg。
1.3.7 圆二色光谱测定 参照Cao等[18]的方法,并略作修改。将样品溶液稀释到0.2 mg·mL-1,吸取300 μL稀释后的样品溶液,置于光程为1 mm的石英比色皿中,4℃条件下从190 nm 扫描至240 nm,扫描速率为50 nm·min-1。圆二色光谱(circular dichroism,CD)数据用平均比椭圆率[θ](deg·cm2·dmol-1)表示。
1.3.8 MP凝胶的制备 参照Cao等[18]的方法,并稍作修改。用50 mmol·L-1PBS缓冲液(pH值6.5,含0.6 mol·L-1NaCl)将MP配制成40 mg·mL-1蛋白液。以1 000×g离心1 min脱气,然后将20 g脱气蛋白液转移到20(内径)mm×100(长)mm的肠衣中,将肠衣置于20℃水浴锅,随后以1℃·min-1的速率升温至72℃,最后将形成的凝胶冷却至室温置于4℃冰箱中过夜。测量前,使样品在室温(25±1℃)下平衡2 h。
1.3.9 MP凝胶白度的测定 利用便携式色差仪测定MP的凝胶白度。每个样品测量3个不同部位,白度是L*值、a*值和b*值的综合指标。按照公式计算白度:

(4)。
1.3.10 MP凝胶保水性的测定 参照And等[19]的方法,并略作修改。准确称取2 g蛋白凝胶放入离心管底部,冷冻离心(5 000 r·min-1,10 min)后去除管内液体,并用滤纸吸干多余的水分,用电子天平称量离心前后的离心管与蛋白凝胶的质量。按照公式计算凝胶保水性(water holding capacity,WHC):
(5)
式中,m0为离心管的质量,g;m1为离心前离心管与蛋白凝胶的总质量,g;m2为离心后离心管与蛋白凝胶的总质量,g。
1.3.11 MP凝胶微观结构观察 参照陈霞霞等[20]的方法。取1 mL 2.5%戊二醛溶液浸泡蛋白凝胶24 h,然后用PBS缓冲液(0.1 mol·L-1pH值7.2)漂洗凝胶3次,接着依次用30%~100%乙醇梯度洗脱,再按照体积比(v/v)分别为3∶1、1∶1、1∶3的无水乙醇∶叔丁醇及纯叔丁醇依次洗脱,最后用少量叔丁醇覆盖样品,冷冻干燥,贴样、镀金后扫描电子显微镜观察拍照,加速电压为10 kV。
1.4 数据处理
除扫描电子显微镜观察外,所得试验数据均用平均值±标准差表示,重复3~5次。采用SPSS 21.0软件进行统计分析,数据显著性差异分析用Duncan多重检验分析,数据绘图采用Origin 9.0软件。
2 结果与分析
2.1 GA对MP生化特性的影响
2.1.1 GA对MP总巯基含量的影响 由表1可知,未氧化MP总巯基(T-SH)含量为75.33 nmol·mg-1,氧化12 h后T-SH含量显著降低(P<0.05),下降21.27%,这是因为MP富含SH基团,且在氧化应激下易转化成二硫键(S-S)或进一步与分子氧反应形成巯基过氧自由基[18]。与氧化MP相比,添加0.05%~0.15% GA可显著抑制氧化诱导的总巯基含量减少(P<0.05),且当GA添加量为0.15%时,氧化MP中巯基含量最高,但仍显著低于未氧化组(P<0.05);而GA添加量为0.20%、0.25%时,对总巯基含量无显著影响(P>0.05),说明GA对海鳗MP的氧化抑制作用具有浓度效应。
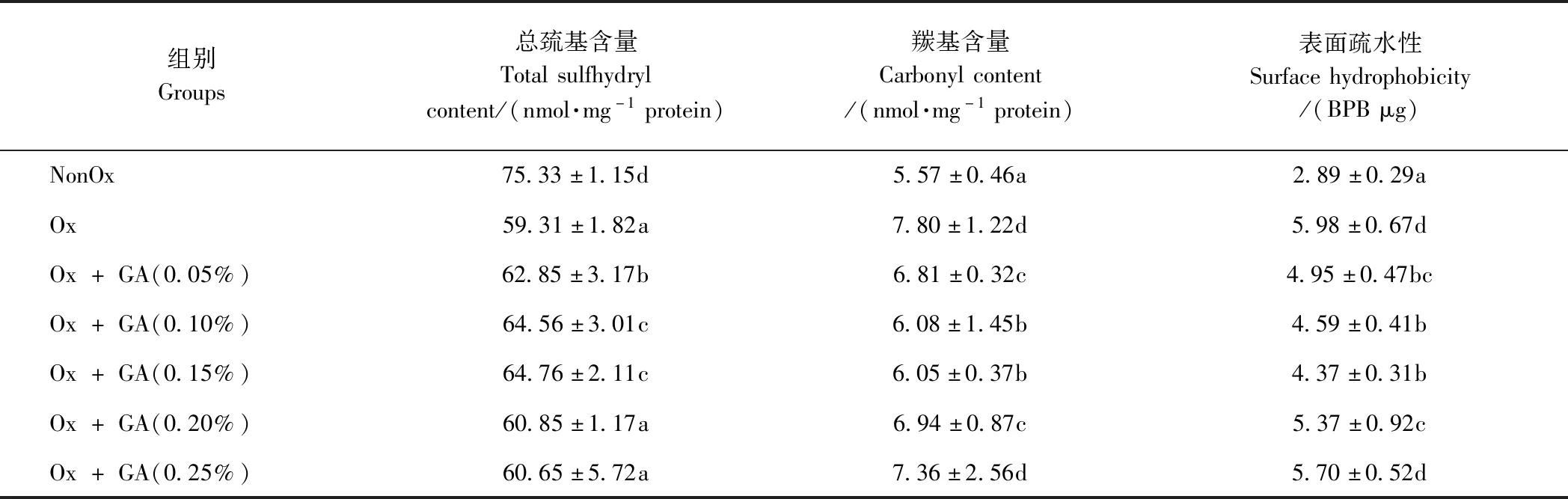
表1 GA对海鳗肌原纤维蛋白生化特性的影响Table 1 Effects of GA on the biochemical characteristics of myofibrillar proteins in M. cinereus
注:同列不同小写字母表示差异显著(P<0.05)。下同。
Note: Different lowercase letters in the same column indicate significant difference at 0.05 level. The same as following.
2.1.2 GA对MP羰基含量的影响 由表1可知,未氧化MP的羰基含量为5.57 nmol·mg-1,氧化12 h后羰基含量显著上升至7.80 nmol·mg-1(P<0.05),这是因为蛋白质在发生氧化时,活性氧攻击了侧链氨基酸,从而导致肽链断裂,形成羰基衍生物[20]。相比氧化MP,添加GA后有效抑制了MP羰基含量的上升,其抑制效率在5.6%~22.4%。添加0.10%GA和0.15%GA能显著降低MP的羰基含量(P<0.05),且这2个试验组间无显著差异(P>0.05)。但随着GA质量分数的增加,MP中羰基含量反而逐渐升高。
2.1.3 GA对MP表面疏水性的影响 BPB分子可结合于蛋白质分子表面的疏水性结合位点,因此通常将蛋白质所能结合的BPB量作为反映蛋白表面疏水性的指标[17]。由表1可知,氧化后的MP所结合的BPB含量是未氧化MP结合量的2倍之多,这是因为蛋白质在发生氧化时,蛋白结构展开,大量疏水性氨基酸暴露在分子表面,从而蛋白结合的BPB含量明显增加[17]。与氧化MP相比,随着GA质量分数的增加,蛋白质的BPB结合量先减小而后增大,当GA质量分数为0.15%时,BPB结合量最低,继续增大GA质量分数,BPB结合量逐渐升高,这是因为GA是多羟基结构,溶解度较大,易与MP发生反应;但当浓度增加到一定程度时,反而破坏了与蛋白质相互反应的程度。
2.2 GA对MP结构的影响
采用圆二色谱对MP二级结构变化进行分析,测定结果见图1。未氧化MP在195 nm显示强正峰,在208和223 nm处显示2个强负峰,表明MP富含α-螺旋结构[18];MP氧化后,正、负峰的强度明显降低,表明蛋白有序结构被破坏,α-螺旋结构部分丧失。添加GA后的MP曲线处于氧化与未氧化曲线之间,且添加0.10%和0.15% GA的CD曲线接近未氧化MP曲线;继续增加GA添加量,MP的正、负峰强度不断减弱,表明过量的GA破坏了蛋白的有序结构。
通过JASCO软件分析圆二色谱图并计算MP中α-螺旋、β-折叠、β-转角及无规则卷曲的含量。由图2可知,氧化导致α-螺旋含量由39.2%下降至25.6%,β-折叠含量由4.3%上升至10.0%,无规则卷曲含量由35.1%上升至43.9%,β-转角含量基本不变。相比氧化MP,随着GA添加量的增加,MP中β-转角含量无显著变化,α-螺旋含量呈先上升后下降的趋势,β-折叠含量呈先上升后下降的趋势,无规卷曲含量呈先下降后上升的趋势。添加0.10%和0.15% GA后MP中α-螺旋含量分别达到了32.3%和33.5%,而添加0.20%和0.25% GA后,MP中无规则卷曲含量分别高达43.0%、43.5%。综上表明,添加0.10%和0.15% GA能明显改善氧化对蛋白结构的破坏。

图1 氧化及不同质量分数GA添加量对MP圆二色谱的影响Fig.1 Effects of oxidation and different concentrations of GA addition on MP circular dichroism

注:1: NonOx,2: Ox,3: Ox + GA(0.05%),4: Ox + GA(0.10%),5: Ox + GA(0.15%),6: Ox + GA(0.20%),7: Ox + GA(0.25%)。下同。Note:1: NonOx. 2: Ox. 3: Ox + GA(0.05%). 4: Ox + GA(0.10%). 5: Ox + GA(0.15%). 6: Ox + GA(0.20%). 7: Ox + GA(0.25%).The same as following.图2 氧化及不同质量分数GA添加量对MP二级结构的影响Fig.2 Effects of oxidation and different concentrations of GA on the secondary structure of MP
2.3 GA对MP凝胶特性的影响
2.3.1 GA对MP凝胶白度的影响 由图3可知,氧化处理并未明显影响凝胶的白度值。随着GA添加量的增加,MP凝胶的白度值逐渐降低,差异不显著(P>0.05)。
2.3.2 GA对MP凝胶持水性的影响 氧化处理后,凝胶持水性显著下降(P<0.05)。添加GA后明显改善了MP凝胶的持水性,当GA添加量为0.15%时,MP凝胶持水性达到了未氧化样品的水平;继续增加GA的添加量,凝胶持水性却逐渐降低,这可能与GA的自我聚集有关。综上所述,添加0.15% GA能有效抑制氧化,保持MP凝胶的持水性。

图3 氧化及不同质量分数GA添加量对MP凝胶特性的影响Fig.3 Effects of oxidation and GA addition at different concentrationson the gel properties of MP
2.3.3 GA对MP凝胶微观结构的影响 鉴于氧化及不同质量分数GA对海鳗MP的生化、结构及凝胶特性的影响,得出当GA添加量分别为0.10%和0.15%时,其抗氧化效果最好,故对未氧化、氧化及添加0.10%、0.15% GA的MP凝胶微观结构进行观察。由图4可知,未氧化MP凝胶网络结构紧密,呈现良好的三维网状结构,但结构比较粗糙,出现蛋白质聚集现象,交联程度不高;氧化后MP形成的凝胶网状结构质地疏松、不紧密,有一些不规则的空洞和蛋白质聚集;添加0.10%和0.15% GA后形成的MP凝胶网状结构分布均匀,交联程度也极大提高,但添加0.15% GA的MP凝胶结构更加致密,表面更加光滑平整。综上表明,适量的GA能明显提高蛋白凝胶网络的交联度。

Note:1:NonOx. 2:Ox. 3:Ox + GA(0.10%).4: Ox + GA(0.15%).图4 氧化及不同质量分数GA添加量对MP凝胶微观结构的影响(×15.0 K)Fig.4 Effect of oxidation and GA addition on microstructure of MP gel(×15.0 K)
3 讨论
多酚类物质作为优质的天然抗氧化剂已用于水产品保鲜,如鲭鱼(Rastrelligerkanagurta)[21]、大眼鲷鱼(Priacanthustayenus)[22]、尼罗罗非鱼(Niletilapia)[23]。海鳗肌肉蛋白含量高达20%,在加工和贮藏过程中易发生氧化变质,导致鱼肉品质下降。一般来说,蛋白氧化会导致氨基酸侧链修饰、结构展开、蛋白质交联聚集及功能改变等[24]。巯基(-SH)和二硫键(-S-S-)是蛋白质中反应活性最高的基团,发生氧化时巯基易转化成二硫键及相关物质,从而引起总巯基含量下降[25]。本研究中,海鳗MP经·OH攻击后,蛋白质空间结构遭到破坏,巯基不断暴露出来,进而被氧化成二硫键,从而导致总巯基含量显著降低[18]。在海鳗MP中添加0.05%~0.15% GA后,其总巯基含量明显高于Ox组,因此,添加GA能有效抑制氧化过程中MP的侧链修饰。而添加0.20%~0.25% GA后,MP总巯基含量较Ox组未发生显著变化,这可能是过多的氧化酚类化合物与巯基相互作用造成的[21]。
蛋白氧化时,·OH导致侧链氨基酸肽链断裂生成羰基衍生物,因此蛋白羰基化也可作为蛋白氧化的一个重要指标[26]。Domenico等[27]研究表明,羰基含量越高蛋白质氧化损伤程度越高。本研究中,与氧化组相比,添加0.05%~0.15% GA对蛋白的羰基化有明显的抑制作用,这可能归因于GA清除自由基及螯合金属离子的能力[28]。但添加0.20%~0.25% GA后,MP羰基含量反而逐渐上升,这可能与GA的自我聚集有关,当浓度增加到一定程度时,破坏了其与蛋白质的交联能力[28]。Pazos等[29]研究表明,儿茶酚能显著抑制大西洋鲭鱼(Scomberscombrus)MP的氧化羰基化。·OH在攻击氨基酸侧链时,同时也会导致MP结构展开,更多内部疏水基团暴露于分子表面,从而使MP表面疏水性显著上升[30]。本试验中,不仅氧化使MP表面疏水性显著增加,而且过量的GA(0.20%~0.25%)也会促进氧化诱导的MP结构进一步展开,这与陈霞霞等[31]研究氧化对银鲳MP表面疏水性的影响结果一致。
Zhao等[32]在研究·OH氧化对大豆蛋白二级结构影响时指出,氧化会导致蛋白结构打开,α-螺旋结构转变为无规则卷曲结构。Sun等[33]发现·OH氧化导致MP的α-螺旋结构减少,β-折叠和无规则卷曲含量增加。本试验结果表明,添加0.10%和0.15% GA能有效阻止α-螺旋结构的减少,且β-折叠含量少量增加,MP二级结构变化趋势与表面疏水性变化具有一致性,即氧化导致蛋白质分子解旋,无规则卷曲含量增加,蛋白结构更具无序性,包埋的疏水肽段暴露,故蛋白质分子表面疏水性增强。添加GA后可使蛋白分子免受氧化对结构的进一步破坏,因而蛋白结构有序含量相对较高,表面疏水性也相对减小[34]。
蛋白质分子的展开变性或聚集会引起其表面疏水性、溶解性等生化特性发生变化,这些变化必然会进一步引起蛋白质的凝胶特性发生改变。而多羟基结构的多酚类物质可与蛋白之间形成共价键和非共价键的相互作用,其作用程度取决于多酚含量、化学状态及蛋白质分子大小等[23]。Balange等[21]研究表明,鲭鱼鱼糜中分别添加质量分数为0.05%鞣酸、0.15%咖啡酸、0.2%阿魏酸、0.05%儿茶酸可显著提高其凝胶强度和凝胶持水性。本研究中,GA处理的MP凝胶持水性明显增强,尤其是添加0.15% GA的MP凝胶,且其微观结构可见清晰、紧密的三维网状结构。因此,推测GA含有的4个羟基可与蛋白分子间发生相互作用,提高蛋白的交联作用,从而有助于改善MP凝胶的持水性。
4 结论
本试验研究了不同浓度GA对海鳗MP的生化特性及凝胶特性的影响,结果表明,GA对海鳗MP的生化特性及凝胶特性的作用具有浓度效应,0.05%~0.15%GA能显著抑制氧化引起的MP巯基减少和表面疏水性增加,提高MP凝胶的持水性,并改善凝胶的微观结构,其中,Ox+ GA(0.15%)处理组效果最佳;继续增加GA添加量,可促进MP总巯基含量减少和羰基含量增加,但会导致蛋白结构过度展开,破坏MP的凝胶性能。由此可见,GA对羟自由基引起的MP氧化起到了一定的抑制作用。因此,可通过向海鳗及其制品中添加0.15%GA抑制蛋白质氧化,同时提高蛋白质的凝胶特性。本研究结果为GA在水产品加工及贮藏过程中的应用提供了理论依据。

