荷斯坦牛DRA基因多态性及序列特征分析
刘丽霞 张 丽,* 欧阳霞辉 乔自林 付保强
(1 西北民族大学生命科学与工程学院,甘肃 兰州 730030; 2 西北民族大学生物医学研究中心,甘肃 兰州 730030)
牛(Bostaurus)的主要相容性复合体即牛的白细胞抗原(bovine lymphocyte antigen, BoLA)是一组紧密连锁的高度多态基因家族,编码主要组织相容性抗原,与机体的免疫应答和抗病性具有密切的相关性,位于牛的第23号染色体上,由Ⅰ类、Ⅱ类和Ⅲ类基因构成[1-3]。牛DRA基因位于BoLA-Ⅱ类基因的Ⅱa亚区,编码DR分子的α链,参与抗原呈递和传输过程[4],与人DRA基因的结构非常相似[5],牛的DRA基因可在牛晚期黄体的内皮细胞中高表达[6]。与α链上的其他基因相比,DRA基因的多态性较低[7],早期研究认为该基因仅有1个等位基因,是1个单态基因。随后研究者发现牛的DRA基因座位上也存在等位变异,Sigurdardottir等[8]最早报道了5个DRA的RFLP分型;Sena等[9]发现水牛包含2个DRA等位基因,其中1个位于抗原结合位点上,且该基因在不同的品种中具有不同的特征;王兴平[10]在秦川牛、鲁西牛、南阳牛和晋南牛的DRA外显子2的第116和第197位分别发现G→A和T→C的点突变,且该基因对南阳牛的体高标记效应显著;中国荷斯坦牛、中国西门塔尔牛和三河牛中具有3个DRA外显子2的等位基因,其基因型与乳房炎的易感性和抗性有关[11];甘南牦牛和天祝白牦牛DRA外显子2具有3个单核苷酸多态位点(single nucleotide polymorphism sites, SNPs),具有较为保守的多态性[12];而李彥清等[13]在天祝白牦牛、大通牦牛、甘南牦牛和普通牛的DRA第2外显子上检测到197位的T>C和116位的G>A突变;Sun等[14]发现大额牛及其杂交后代DRA基因的核苷酸和氨基酸序列与普通牛和牦牛的相似度达到99%;张周等[15]在大通牦牛和天祝白牦牛DRA外显子上分别检测到2个碱基突变位点;付保强等[16]发现荷斯坦牛DRA外显子1上有1个碱基插入。由此可见,牛DRA基因具有一定的多态性,但这种多态性具有高度的保守性。
从分子水平上了解基因的基本结构和生物学功能,可为研究其作为疾病相关候选基因奠定理论基础。近年来国内外已有关于牛DRA基因特性和结构功能的相关研究报道[17-21],但有关荷斯坦牛DRA基因序列特征的相关研究尚未见报道。
本研究利用荷斯坦牛基因组DNA混合池扩增并直接测序的方法对DRA基因编码区(coding regions, CDS)进行多态性分析,同时利用生物信息学方法预测DRA基因的理化特性及其编码蛋白的高级结构,以期为荷斯坦牛的疾病相关基因筛选和抗病分子育种提供一定的理论依据。
1 材料与方法
1.1 试验材料
本研究从宁夏农垦贺兰山奶业有限公司采集303头荷斯坦牛尾静脉血液各10 mL,低温保存,带回实验室后立即-20℃冷冻保存。采用传统的酚-氯仿抽提法[22]提取血液基因组DNA。
1.2 试验方法
1.2.1 引物设计 根据GenBank数据库中牛的DRA基因序列(登录号:AJ505000和M30120),利用NCBI在线软件Primer-BLAST设计DRA基因4对引物(表1),分别扩增4个外显子序列和部分内含子序列,引物由苏州金唯智生物科技有限公司合成。

表1 DRA基因引物信息表Table 1 DNA primers of DRA gene
1.2.2 基因组DNA混合池构建和PCR扩增 选取扩增效果良好的荷斯坦牛DNA样品237个,每50个样品构建1个DNA混合池,以混合池DNA为模板进行扩增。PCR扩增反应体系总体积20 μL,包括混合DNA 1 μL、2×PowerTaqPCR MasterMix(百泰克公司,北京)11 μL、上下游引物(10 μmol·L-1)各0.5 μL、灭菌超纯水7 μL。扩增反应程序:94℃预变性5 min;94 ℃变性30 s,退火(不同引物温度详见表1)30 s,72℃延伸30 s,30个循环;72 ℃终延伸10 min。利用1%琼脂糖凝胶电泳检测产物的扩增效果。
1.2.3 序列测定与比对DRA基因4个外显子的PCR扩增产物由江苏金唯智生物科技有限公司进行纯化后双向测序,采用Editseq软件检查测序峰图,利用MEGA6.0软件比对4个外显子序列,并进行拼接获得DRA基因编码区序列。
1.2.4 序列特征分析 对DRA基因编码区序列特征进行分析用到的工具包括:Expasy服务器上的ProtParam工具和Protscale程序;CBS的NetNGlyc和NetPhos在线软件;PredictProtein服务器;SWISS-MODEL同源建模构建蛋白质三级结构模型并绘制PyMOL软件视图。
2 结果与分析
2.1 荷斯坦牛DRA基因4个外显子扩增结果
由图1可知,PCR扩增产物电泳条带特异性良好,条带清晰,DRA基因4个外显子片段大小均与预期扩增片段相符。
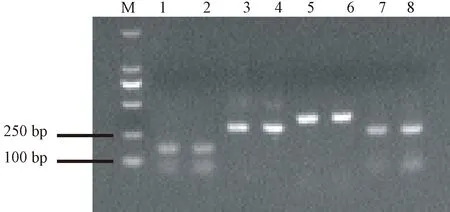
注:M:DL 2 000 DNA maker;泳道1,2:DRA外显子1; 泳道3,4:DRA外显子2;泳道5,6:DRA外显子3;泳道7,8:DRA外显子4。Note: M:DL 2 000 DNA maker. Lane 1,2:DRA exon1. Lane 3,4: DRA exon2. Lane 5,6:DRA exon3. Lane 7,8: DRA exon4.图1 荷斯坦牛DRA基因PCR扩增产物Fig.1 The PCR amplicons of DRA gene in Holstein cattle

注:方框内为外显子2序列。Note: The sequence of exon2 is showed in the box.图2 荷斯坦牛DRA基因编码区核苷酸序列与参考序列比对结果Fig.2 Alignment of the nucleotide sequences of DRA coding regions identified from Holstein cattle and reference sequence from Genbank
2.2 荷斯坦牛DRA基因编码区序列比对
荷斯坦牛DRA基因CDS区序列全长762 bp,与GenBank中牛的DRA基因序列(AJ505000和M30120)进行比对,结果发现荷斯坦牛DRA基因CDS区共有4个碱基突变(图2),均位于外显子2上,分别为 c.161A>T、c.195G>A、c.276C>T和c.312C>A,其中第161位的A>T突变为错义突变,导致第54位氨基酸由谷氨酸(E)变为缬氨酸(Ⅴ),其余均为同义突变。
2.3 序列特征分析
2.3.1 荷斯坦牛DRA基因编码氨基酸的理化特性和亲/疏水性 利用ProtParam工具预测荷斯坦牛DRA基因编码氨基酸的理化特性和组成,结果显示,荷斯坦牛DRA基因共编码253个氨基酸,氨基酸组成中亮氨酸比例最高,占所有氨基酸组成的10.30%,而半胱氨酸比例最低(1.20%)(表2、图3)。采用Protscale程序预测荷斯坦牛DRA基因编码氨基酸的亲/疏水性,结果表明,多肽链的第227位疏水性最强,评分为3.43,第103位亲水性最强,评分为-2.52(图4)。整条氨基酸肽链的亲水和疏水氨基酸分别占53.47%和46.53%,总平均亲水性为0.09。

图3 荷斯坦牛DRA基因编码氨基酸组成预测Fig.3 Putative amino acid composition of DRA gene in Holstein cattle

注:正值表示疏水;负值表示亲水。Note: Positive means hydrophobicity.Negative means hydropathicity.图4 荷斯坦牛DRA基因编码氨基酸的亲水性/疏水性预测Fig.4 Prediction of hydropathicity/hydrophobicity of amino acids encoded by DRA gene in Holstein cattle
2.3.2 荷斯坦牛DRA基因编码氨基酸的N-糖基化位点和磷酸化位点 NetNGlyc和NetPhos在线软件预测结果显示,荷斯坦牛DRA基因编码的氨基酸无潜在的N-糖基化位点,有15个潜在的磷酸化位点(表3)。
2.3.3 荷斯坦牛DRA蛋白质的二级结构和三级结构 PredictProtein预测结果显示,荷斯坦牛DRA蛋白二级结构组分中α-螺旋、延伸链、β-转角和无规则卷曲所占比例分别为18.97%、30.04%、7.51%和43.48%,其中无规则卷曲是荷斯坦牛DRA蛋白二级结构中的主要元件。利用SWISS-MODEL同源建模构建DRA蛋白三级结构模型并绘制PyMOL软件视图(图5)。
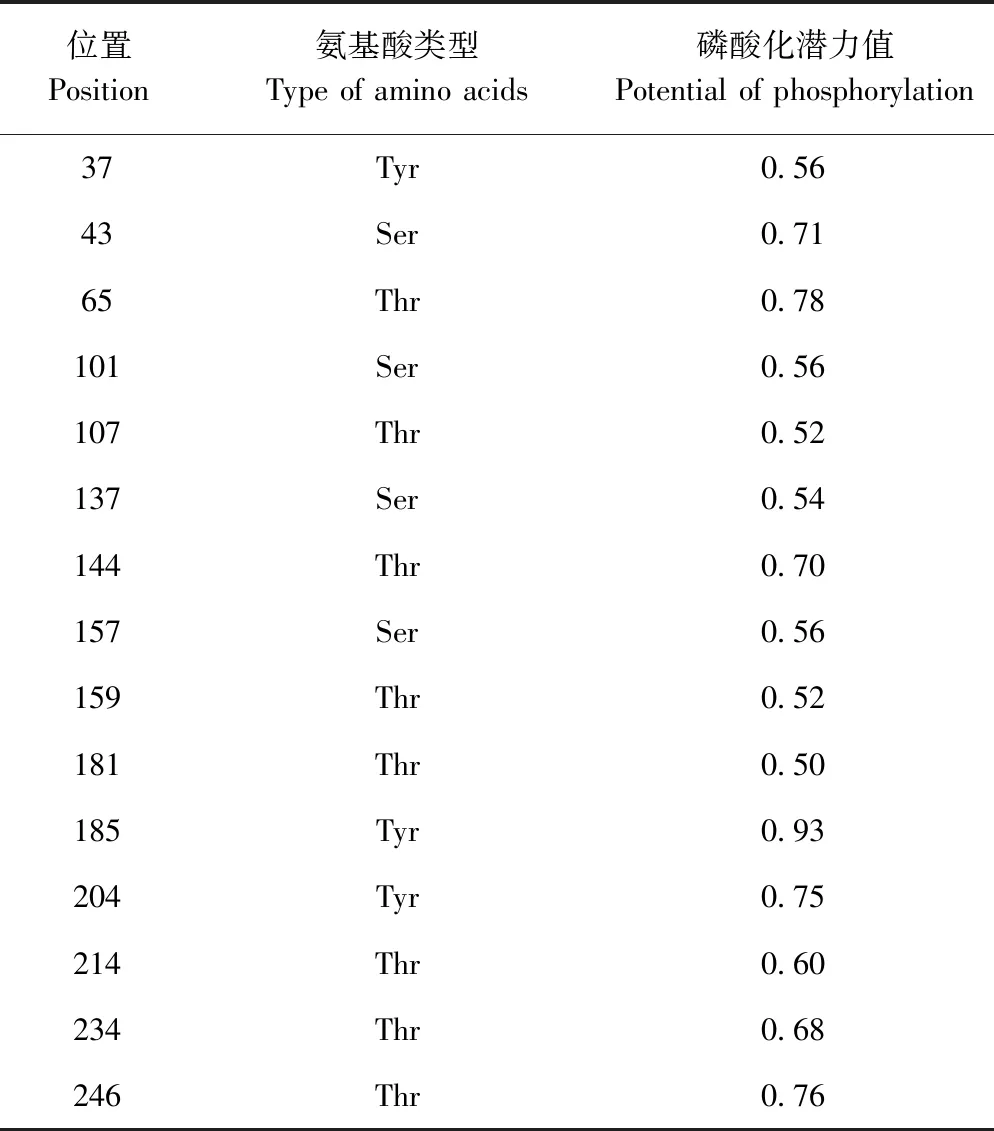
表3 荷斯坦牛DRA基因编码氨基酸的磷酸化位点Table 3 Phosphorylation sites of amino acids encoded by DRA gene in Holstein cattle

图5 荷斯坦牛DRA蛋白三级结构模型预测Fig.5 Tertiary structure of DRA protein for Holstein cattle
3 讨论
MHC基因在抗原特异性适应免疫反应中起着重要作用[23]。牛的DRA基因编码牛MHCⅡ类抗原分子的α链,该基因外显子2编码的抗原结合区在抗原识别与呈递中发挥着重要作用[24]。研究表明,猪DRA基因与腹泻之间存在显著的相关性[25-26],牛DRA外显子2与牛乳房炎的抗性和易感性有关[27-29]。因此,对动物DRA基因多态性和结构功能的研究是进一步研究该基因作为动物抗病相关候选基因可能性的基础。
基因的多态性与动物的生产性状间存在一定的相关性[30],对动物基因多态性的研究是探究其与生产性能间关系的基础。本研究中,荷斯坦牛DRA基因编码区具有4个核苷酸突变位点,包含1个错义突变和3个同义突变,比其他品种牛的突变位点多,但c.195G>A和c.276C>T位点在各牛种中均存在[11-14],表明荷斯坦牛DRA基因的多态性较为丰富,同时牛DRA基因在品种间表现出高度的保守性。
对基因特性的分析可揭示其在机体中可能发挥的作用[31]。荷斯坦牛DRA基因共编码253个氨基酸,根据其理论等电点(<7)和不稳定指数(<40)推断,该蛋白为酸性且稳定蛋白[32],胞内蛋白的稳定性直接影响着生命活动和细胞周期。蛋白质的疏水性对其稳定性、构象和功能具有一定的影响[33],荷斯坦牛DRA蛋白总平均疏水性大于0,由此推断荷斯坦牛DRA蛋白为不可溶蛋白,与南阳牛一致,而与犏牛不同[34]。蛋白质糖基化主要修饰天冬酰胺上的N端,影响免疫分子的结构和功能,进一步影响机体对抗原的应答反应[33,35],而磷酸化可以调节蛋白质在信号转导中的作用,从而对细胞生长、分化以及基因表达造成一定的影响[36],荷斯坦牛DRA蛋白无潜在的N-糖基化位点,而存在15个潜在的磷酸化位点,这表明DRA基因对荷斯坦牛的抗原免疫应答影响不大,但可能通过影响其他基因的表达、病毒的信号转导或者细胞的代谢从而改变机体的抗病能力。
蛋白质二级结构是指多肽链依赖氢键排列成具有周期性结构的构象,是氨基酸序列和三维构象之间的桥梁,对其进行预测和分析有助于认识蛋白的空间结构,进而了解蛋白的功能[26]。荷斯坦牛DRA蛋白二级结构为混合型(Hh<45%,Ee>20%)[37],该蛋白中较大比例的无规卷曲(43.48%)可能影响蛋白质肽链中配体和受体的结合,进而影响生物学功能。
4 结论
本研究利用基因组DNA混合池扩增并直接测序的方法获得荷斯坦牛DRA基因编码区序列并对其特征进行分析,结果表明,荷斯坦牛DRA基因编码区上仅有4个碱基突变,多态性较低。荷斯坦牛DRA基因共编码253个氨基酸,其编码产物是一种酸性且稳定的不可溶蛋白,具有15个潜在的磷酸化位点;二级结构为混合型,其中无规则卷曲所占的比例最高;三级结构由α-螺旋、β-折叠、β-转角和无规则卷曲组成。本研究结果为深入研究荷斯坦牛DRA基因分子结构和功能奠定了一定的理论基础。

