60Co-γ射线辐射对翠冠和玉露香梨枝条的生物损伤效应
石新杰 吴 潇 陈杨杨 曹 鹏 白 冰 李明智 殷 豪,* 张绍铃
(1 南京农业大学梨工程技术研究中心,江苏 南京 210095;2 南京集思慧远生物科技有限公司,江苏 南京 210014)
梨为蔷薇科(Rosaceae)梨亚科(Pomaceae)梨属(PyrusL.)多年生木本果树。我国不仅是梨的起源地,也是世界第一大产梨国,梨已成为我国第三大果树树种,具有极高的经济价值[1]。目前我国梨新品种选育主要是通过杂交育成,但木本果树杂交育种存在周期长、效率低等问题,而辐射诱变育种具有突变率高、突变谱宽、改良单一性状效果显著、性状能够快速稳定、育种周期短等优点,已成为创造果树新种质的有效途径[2]。1927年,Muller[3]首次发现X射线可以诱导果蝇某些性状发生突变。经过多年的发展,目前主要的物理诱变包括X、γ、β射线,热中子辐射、紫外线、激光、离子注入等[2],其中60Co-γ作为一种有效的物理诱变剂,在果蔬和花卉品种的培育与改良中得到了大量应用,包括柚子[4]、澳洲坚果[5]、苹果[6]、香蕉[7]、葡萄[8]、辣椒[9]、牡丹种子[10]、菊花[11]、小麦[12]、菠萝[13]等,并获得了一大批优质性状突变体,且部分经过诱变获得的品种已经在生产上得到了广泛的应用。
我国梨辐射诱变研究始于1980年,蒋洪业[14]通过辐射梨休眠枝得到抗寒辐向阳红梨;李志英等[15]利用60Co-γ射线辐射朝鲜洋梨和苹果梨枝条,并育成具有早果、丰产、抗寒、树体矮化、抗腐烂病、果品质优等特点的优良品系(如朝辐1号、朝辐2号等);孟玉平等[16]利用60Co-γ射线辐射普通巴梨自然杂交的种子,培育出丰产性和抗逆性优良的新品种晋巴梨。此外,对于砀山酥梨[17]和库尔勒香梨[18]的休眠枝辐射也进行了研究,发现随着辐射剂量的增加,萌芽率、新梢生长量和嫁接成活率均降低。国外对梨辐射诱变也进行了大量研究,如日本研究者通过60Co-γ射线分别辐射长二十世纪、二十世纪和新水梨获得了抗黑斑病的新品种长二十世纪IRB-502-12T[2]、金二十世纪[19]和寿新水[20]。荷兰和英国的果树育种家通过辐射处理获得了早熟、矮化突变系[21]。虽然当前国内外科研工作者在梨诱变育种取得一些成绩,但仍存在鉴定方法不完善、突变方向和性质难掌握等问题。
翠冠梨是浙江省农业科学院园艺研究所以幸水×(杭青×新世纪)杂交培育成的优质早熟丰产梨品种,其具有果个大、肉质酥脆、石细胞少、汁多味甜、抗逆性强等特点,已成为我国长江流域及其南方地区发展最为迅速的早熟梨品种之一[22]。玉露香梨是山西果树研究所以库尔勒香梨×雪花梨杂交培育成的优质、耐藏、中熟梨优质新品种,具有果个大、果心小、果肉细、风味佳、成熟早、供应期长等特点[23]。本试验利用60Co-γ射线对翠冠梨和玉露香梨的休眠枝条进行辐射诱变处理,研究辐射对二者的生物损伤效应,旨在通过辐射诱变改善翠冠梨表皮果锈和玉露香梨在南方区域种植僵芽、区域性强等缺点,以期为梨辐射诱变育种,创制优异梨种质资源提供一定的理论依据和技术支撑。
1 材料与方法
1.1 材料
试验材料取自南京农业大学梨工程技术中心湖熟试验基地6年生翠冠和玉露香梨树一年生枝条,于休眠期剪取,每个品种每个处理剪取30根枝条,每个枝条带3~4个饱满芽。枝条剪取后立即用报纸包裹严实,并用清水打湿,0℃保存备用。
剪取的枝条在南京航空航天大学材料科学与技术学院进行60Co-γ辐射处理,辐射剂量分别20、30、40、50 Gy,剂量率为1 Gy·min-1,辐射时间分别为20、30、40、50 min,以未经辐射处理的枝条为对照(control,CK)。经辐射处理的枝条于次日嫁接于江浦试验基地生长较好的7年生梨树,嫁接后其他措施同常规管理,观察其生长情况。
1.2 方法
1.2.1 生长指标及叶绿素含量测定 于嫁接6个月后调查各处理的嫁接成活率、新梢生长量、叶片形态、二叉枝和多叉枝分别占总枝量的比例。
嫁接成活率=成活的枝条数量/总的枝条数量×100%
(1)
二叉枝和多叉枝占总枝量的比例=二叉枝和多叉枝的数量/总的枝条数量×100%
(2)。
利用SPAD-502DL Plus叶绿素含量测定仪(日本Konica Minolta公司)测定叶片相对叶绿素(soil and plant analyzer development,SPAD)含量。
1.2.2 感病叶片病菌鉴定 采用组织分离法[24]。分别用刀切取2种梨叶片病健交界处组织,经表面消毒(75%乙醇、1%次氯酸钠)处理,从叶片上分离得到2种菌落形态的疑似真菌病原物。采用CTAB法分别提取菌丝DNA[25],以DNA为模板,利用ITS1和ITS4引物进行PCR扩增,产物经凝胶DNA纯化、测序公司测序,最终获得ITS序列。利用NCBI BLAST对2个菌株的ITS序列进行比对分析。
1.2.3 数据统计与分析 主成分分析(principal component analysis,PCA)和偏最小二乘判别分析(partial least squares-discriminant analysis,PLSS-DA)采用SIMCA-P软件(V11.0, Umetrics, Umeå, Sweden)进行计算和绘制。试验数据采用Microsoft Office Excel 2016软件进行统计和分析,所有图片通过Photoshop软件进行组合。
2 结果与分析
2.1 60Co-γ辐射对梨接穗成活率的影响以及对叶片、枝条的生物损伤效应
由表1可知,枝条嫁接成活率随辐射剂量的增加而降低。与CK相比,50 Gy处理的翠冠和玉露香枝条接穗成活率最低,分别为66.67%和60.00%。表明辐射处理具有一定致死效应,并随着辐射剂量的增加,致死效应越明显。CK和20 Gy处理的翠冠梨枝条嫁接后二叉枝数均为0,30、40和50 Gy处理的二叉枝数占总枝数的比例分别为15.35%、19.47%、40.32%;CK、20和50 Gy处理的翠冠梨枝条嫁接后的三叉枝数均为0,30和40 Gy处理的二叉枝数占总枝数的比例分别为23.79%和9.73%。CK玉露香梨枝条嫁接后的二叉枝数量为0,20、30、40、50 Gy处理后的二叉枝数占总枝数的比例分别为3.97%、5.24%、7.76%、8.73%;CK、20、40和50 Gy处理玉露香梨枝条嫁接后的三叉枝数均为0,30 Gy处理玉露香梨枝条嫁接后的三叉枝数占总枝数的比例为1.51%。说明辐射处理导致梨枝条发生了变异,且不同辐射剂量及不同品种的生物损伤效应存在差异。
由图1、图2可知,60Co-γ射线辐射使梨枝条和叶片形态出现畸形叶,如两尖叶(图1-B)、皱叶(图1-C、D)、黄化叶(图1-E)、半叶(图1-F)、桃形叶(图1-G~I)等。部分正常枝分离为二叉枝(图2-B),甚至多叉枝(图2-C)。
2.2 60Co-γ辐射处理梨叶片SPAD值的变化
通过对不同诱变处理的枝条长出的新叶片的SPAD值进行主成分分析,在翠冠梨叶片SPAD值中,第1和第2主成分方差贡献率分别为28.58%和16.50%,累计方差贡献率达到45.08%。CK与不同辐射处理组翠冠梨沿着PCA1坐标轴分开,表明诱变处理对翠冠梨产生了较明显的变异效果(图3-A);在玉露香梨叶片SPAD值中,第1主成分、第2主成分方差贡献率分别为33.12%和15.06%,累计方差贡献率达到48.18%。玉露香梨CK与40 Gy处理沿着PCA1坐标轴分开,与20 Gy处理沿着PCA2坐标轴分开,而其他处理与CK堆积在一起,表明20 Gy和40 Gy处理对玉露香梨叶片影响较大(图3-F)。
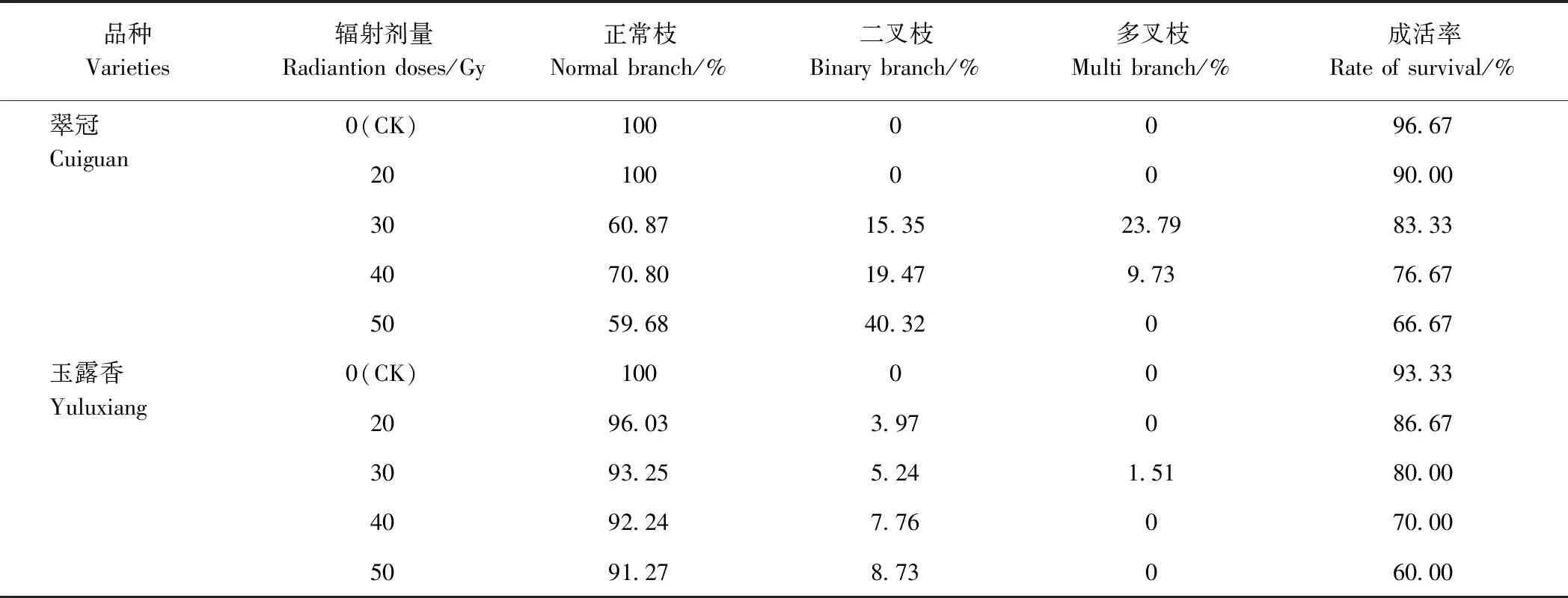
表1 辐射处理对枝条嫁接成活率以及枝梢形态的影响Table 1 Effects of radiation treatment on the survival rate and shoot shape of grafting shoots

注:A: 正常叶;B~I: 畸形叶。Note: A: Normal leaf. B-I: Deformed leaf.图1 辐照处理对新生叶片形态变化的影响Fig.1 Effects of radiation treatments on morphological changes of new leaves

注:A:正常枝;B:二叉枝;C:多叉枝。Note: A: Normal branch. B: Binary branch. C: Multi branch.图2 辐射处理对新生枝条形态变化的影响Fig.2 Effects of radiation treatments on the morphological changes of new branches
为进一步了解诱变处理对梨叶片叶绿素影响,将CK和不同辐射处理分别进行偏最小二乘判别分析。在翠冠梨所有处理中,PLS1和PLS2总贡献率达到了61.91%~77.16%,该贡献率较高,可代表所有变异量,且CK和辐射处理组均沿着PLS1分开,进一步说明辐射处理对翠冠梨影响较大(图3-B、C、D、E)。在玉露香梨所有处理中,PLS1和PLS2总贡献率达到70.98%~78.76%,该贡献率较高,可代表所有变异量。其中CK与20和40 Gy 2个处理沿着PLS1分开,进一步说明这2个处理对玉露香梨影响较大(图3-G、H、I、J)。
2.3 梨叶片病害样品病原菌分离鉴定
由图4可知,经过辐射处理的玉露香梨枝条的叶片病害较严重(枯死,病部有霉层),而枝条无明显病害症状(图4-A、B)。为明确病害类型,对疑似病害样品进行菌株分离鉴定。通过组织分离法从染病叶片中分离到2种菌落形态的疑似真菌病原物,分别命名为JP-1与JP-2。JP-1与JP-2的菌落早期形态类似,菌丝生长较快,菌落呈白色,气生菌丝呈绒毛状;2 d 后JP-2菌落中圈形成明显的黑色孢子层,而JP-1菌落仍为白色的绒毛状(图4-C、D)。
利用NCBI Blast对2个菌株ITS序列比对分析,发现JP-1为炭疽病菌(Colletotrichumgloeosporioides), JP-2为黑曲霉(Aspergillusniger)(图5)。结合ITS结果与叶片典型症状,确定该病原菌是炭疽病引起的,而黑曲霉为样品中的腐生菌,非致病菌,说明诱变会诱发一些致病因子导致玉露香梨叶片感染炭疽病。

注:A、B:病害叶片;C: JP-1;D:JP-2。Note: A、B: Disease leaf. C: JP-1. D: JP-2.图4 玉露香梨叶片病害样品形态以及病原菌分离Fig.4 Isolation and identification of pathogens from pear leaf diseases treated
3 讨论
肖鑫丽等[26]研究表明在不同果树种类、品种和不同研究条件下进行辐射诱变,辐射效果存在差异。大量研究表明,果树中的香蕉[27]、苹果[28-29]、梨[30]、猕猴桃[31]、龙眼[32],蔬菜中的生姜[33]、黄瓜[34]、番茄[35]、苋菜[36],花卉中的冬凤兰[37]、蝴蝶兰[38]、紫薇[39]和黄牡丹[40],草本植物中的钝叶酸模[41]等植株成活率均随着辐射剂量的增加而降低。辐射诱变引起植株性状改变的原因主要有:一是,辐射诱变引起染色体畸变、碱基替换等遗传物质的突变;二是,RNA、蛋白质的生物合成受到抑制,生长素及酶等生理活性物质的代谢受到破坏,进而影响个体表型;三是,辐照导致植物体内某些基因处于“打开”或者“关闭”的状态,进而影响该基因的活跃程度及强度[5, 42]。
本研究中,翠冠和玉露香梨休眠枝条成活率降低可能是因为60Co-γ辐射诱导休眠枝上的芽突变,同时导致芽体的顶端分生组织受到破坏,从而影响了嫁接成活率。而玉露香梨叶片易受炭疽病病菌侵害,可能是由于60Co-γ射线辐射启动了玉露香梨叶片体内的炭疽病致病相关基因,使该基因处于开启状态,表达强度加强,或者抑制了自身的炭疽病抗病相关基因,使该基因处于关闭状态,表达强度减弱,从而表现出感染炭疽病的表观性状。
目前根据梨种质资源的地域、品质特性以及遗传特点,将其栽培品种分为五大类,即白梨、砂梨、秋子梨、新疆梨和西洋梨[43]。翠冠属于砂梨类[44],而玉露香梨属于白梨类[45]。本研究所有辐射处理均对翠冠梨产生了较大的影响,而20和40 Gy 2个处理对玉露香梨影响较大。这可能是由于2种梨栽培区域、遗传背景差距较大,导致其对辐射的响应存在差异。闫海霞等[46]研究表明低剂量的60Co-γ辐射会使月季种子的发芽率提高,这可能由于辐射引起种子内部生物自由基或有关酶活性变化,从而提高了种子新陈代谢,促进了种子萌发。
半致死剂量通常被认为是适宜的辐射剂量,更容易获得有效的诱变效果[47]。如富士嫩枝和嘎啦苹果休眠枝条60Co-γ辐射半致死剂量分别为30[28]和60 Gy[29],砀山酥梨休眠枝条[14]和火龙果无菌苗[48]60Co-γ辐射半致死剂量均为40 Gy,猕猴桃枝条60Co-γ辐射半致死剂量为50.6~71.7 Gy[31]。本研究中,最高剂量50 Gy处理翠冠和玉露香梨枝条致死率分别为33.33%、40.00%,说明在翠冠和玉露香梨枝条中半致死剂量应该高于50 Gy,这与库尔勒香梨辐射研究结果一致[49]。本研究仅提供了辐射当代数据,且剂量选择偏小,未达到半致死剂量,下一步研究将提高辐射剂量,进一步分析辐射剂量对梨枝条的生物损伤效应。
4 结论
本研究通过60Co-γ射线辐射处理翠冠和玉露香梨枝条发现,枝条嫁接成活率随辐射剂量的增加而降低,辐射处理导致梨枝条和叶片变异,且不同辐射剂量处理及不同品种响应辐射变异的生物损伤效应存在差异。此外,本研究还发现经过诱变处理的玉露香梨叶片易受炭疽病病菌侵害,梨枝条物理诱变育种适宜的辐射剂量高于50 Gy。该研究结果为60Co-γ射线辐射诱变技术在梨上的应用提供了一定的理论依据。

