不同海拔高原鼠兔线粒体的适应特点*
宋 康, 曹雪锋, 张轶凡, 噶 琴, 白振忠△, 格日力△
(1青海大学高原医学研究中心, 2青海省人民医院, 青海 西宁 810001)
青藏高原被称为“世界屋脊”,平均海拔4 500 m,其气候特征为低温、低氧和低压。高原鼠兔是青藏高原典型的土生小型啮齿类哺乳动物,能够很好地适应高原环境[1]。
线粒体是细胞内重要的代谢场所,代谢体内的糖脂类物质,产生 ATP和热量,供机体能量的需求[2]。肝脏和骨骼肌含有大量的线粒体,同时也是糖脂代谢的场所。在不同低氧环境下高原鼠兔的肝脏和骨骼肌线粒体的呼吸功能的变化目前尚不清楚。本研究选取不同海拔高原鼠兔,观察其肝脏和骨骼肌线粒体呼吸功能的变化,了解不同海拔高原鼠兔的线粒体的适应特点。
材 料 和 方 法
1 动物
海拔4 300 m组的高原鼠兔(6只)捕捉于青海省果洛州玛多县星星海,捕捉季节为夏季;海拔2 900 m组的高原鼠兔(6只)捕捉于青海省垃脊山南麓,捕捉季节为夏季。2组高原鼠兔均为雄性,无性别差异。所有动物研究均符合中国卫生部的管理规定,经过青海大学医学院伦理委员会审核批准。
2 主要仪器及试剂
2.1仪器 高分辨线粒体呼吸测定仪和组织匀浆机购自Oroboros;兽用全自动血液细胞分析仪(深圳迈瑞生物医疗电子股份有限公司)。
2.2试剂 (1)MiR05呼吸液:110 mmol/L sucrose、60 mmol/L K-lactobionate、0.5 mmol/L EGTA、3 mmol/L MgCl2、20 mmol/L taurine、10 mmol/L K2H2PO4、 20 mmol/L HEPES和0.1% BSA[3]。(2)透化肌纤维原液(BIOPS):10 mmol/L Ca-EGTA buffer、0.1 μmol/L free calcium、20 mmol/L imidazole、20 mmol/L taurine、50 mmol/L K-MES、0.5 mmol/L DTT、6.56 mmol/L MgCl2、5.77 mmo/L ATP、15 mmol/L phosphocreatine[4]。(3)过氧化氢测定校准试剂(Sigma)。(4)氧化磷酸化(oxidative phosphorylation,OXPHOS)及脂肪酸氧化(fatty acid oxidative,FAO)试剂:丙酮酸盐、谷氨酸盐、苹果酸、琥珀酸盐、二磷酸腺苷、FCCP,鱼藤酮、抗霉素A和细胞色素C均购自Sigma。
3 实验方法
3.1取样 2组鼠兔分别在捕获地点进行实验。禁食12 h后给予2%戊巴苯妥钠腹腔注射麻醉,迅速在冰上取出肝脏和骨骼肌组织。肝组织称干重10 mg后放入 Shredder-Tube FT500-PS匀浆管中,加入预冷的MiR05呼吸液500 μL,进行匀浆(匀浆机底座提前在4 ℃冰箱中放置24 h),匀浆10 s。离心完毕后用吸液管将匀浆液转移到Falcon管中,然后用吸液管吸取呼吸液冲洗匀浆管,将清洗的液体也加入Falcon管中,将Falcon定容到5 mL,放置冰上待用。骨骼肌组织选取后肢腓肠肌的白肌,分别称干重各20 mg,一份20 mg骨骼肌组织用于匀浆(操作如上述肝组织);另一份20 mg骨骼肌组织用于骨骼肌纤维透化。
3.2骨骼肌纤维透化 骨骼肌纵向切成20 mg的样品,放入10 mL预冷BIOPS的培养皿中,使用尖锐的镊子去除所有连接的结缔组织,在冰上的培养皿中用镊子分离纤维束,可通过观察分离的纤维束从红色变成浅色来评估分离程度。取5 mg 皂苷放入1 mL BIOPS中配制母液,取配制好的母液21 μL加入到预冷的2 mL BIOPS中配制成透化液。组织分离后,将纤维束放入预冷的配制好的2 mL透化液中。在冰上轻微振荡30 min,后将纤维束从透化液中转移到提前预冷的2 mL MiR05呼吸液中,在冰上温和振荡10 min。透化后,对肌纤维进行称重,取肌纤维并接触滤纸5 s,同时用另一张滤纸擦去镊子尖端的液体,从滤纸上取下样品后,再次接触干燥的滤纸区域,立即将纤维束放置在天平称上的锡箔纸上称量,取3 mg骨骼肌纤维,放入预冷的MiR05呼吸液中。
3.3肝脏及骨骼肌OXPHOS的测定方法 将方法3.1匀浆好的肝组织及方法3.2透化好的骨骼肌纤维组织分别加入提前校正好的高分辨线粒体呼吸测定仪仓内,仓内温度37 ℃。依据底物-解偶联剂-抑制剂-滴定法(substrate -uncopler-inhibitor-titration,SUIT)原则加入丙酮酸(5 mmol/L)、苹果酸(5 mmol/L)、谷氨酸钠(10 mmol/L),待呼吸速率平稳后,得到呼吸链复合物Ⅰ的态4呼吸速率(CI-LEAK)(骨骼肌纤维中不加入丙酮酸)。再次加入 ADP(10 mmol/L),可得到线粒体呼吸链复合物Ⅰ态3呼吸速率(CI-OXPHOS)。滴定细胞色素C(10 μmol/L),以确定线粒体膜的完整性,如加入细胞色素C后O2消耗量增加超过15%,表示线粒体膜破坏,数据被剔除。加入琥珀酸(10 mmol/L)激活线粒体呼吸链复合物Ⅱ,呼吸速率平稳后得到线粒体呼吸链复合物Ⅰ和Ⅱ的态3呼吸速率(CI+II-OXPHOS),继续滴定解偶联剂FCCP(0.25~1.5 μmol/L),获得呼吸链复合物I和II的电子传递能力(CI+II-ETS),滴定复合物Ⅰ的特异抑制剂鱼藤酮(0.5 μmol/L)后,得到呼吸链复合物II的电子传递能力(CII-ETS)。
3.4肝脏及骨骼肌FAO的测定方法 脂肪酸滴定阶段:滴定棕榈酸肉碱和苹果酸后,测定线粒体态4呼吸速率(FAO-LEAK);之后滴定ADP,建立以棕榈酸肉碱为底物的脂肪酸代谢通路态3呼吸速率(FAO-OXPHOS)。
3.5骨骼肌H2O2的检测 选用绿色传感器(525 nm)。安装A、B两仓绿色传感器。将方法3.1匀浆好的骨骼肌组织加入提前校正好的高分辨线粒体呼吸测定仪仓内。校正完毕后,待基线平稳后,依据SUIT原则依次加入底物,解偶联剂及抑制剂。方法同3.3骨骼肌OXPHOS滴定方法,此过程中不加入细胞色素C。
3.6肝脏及骨骼肌偶联率(coupling efficiency)的测定方法 滴定ADP后测得的呼吸速率与ADP滴定前的呼吸速率两者的差值与滴定ADP后测得的呼吸速率的比值为偶联率。
4 统计学处理
用SPSS 23.0及Graphpad Prism 6统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,两组比较采用独立样本t检验。以P<0.05为差异有统计学意义。
结 果
1 两组高原鼠兔一般资料的比较
海拔4 300 m组的高原鼠兔血红蛋白明显低于海拔2 900 m的高原鼠兔(P<0.05),见表1。

表1 不同海拔高原鼠兔一般资料的比较
*P<0.05vs4 300 m group.
2 两组高原鼠兔肝脏和骨骼肌线粒体OXPHOS及FAO水平的比较
两组肝脏线粒体的OXPHOS水平相比,2 900 m组的CI-LEAK、CI-OXPHOS、CI+II-OXPHOS、CI+II-ETS和CII-ETS均较4 300 m组升高,但偶联率较4 300 m组低(P<0.05);2组肝脏线粒体的FAO水平比较,2 900 m组的FAO-LEAK较4 300 m组高(P<0.05),见图1、表2。
两组骨骼肌线粒体的OXPHOS水平相比,2 900 m组的CI-LEAK、CI+II-OXPHOS和CI+II-ETS较4 300 m组明显升高(P<0.05);2组骨骼肌的线粒体FAO水平比较,2 900 m组的FAO-LEAK和FAO-OXPHOS均较4 300 m组高(P<0.05),见图2、表3。
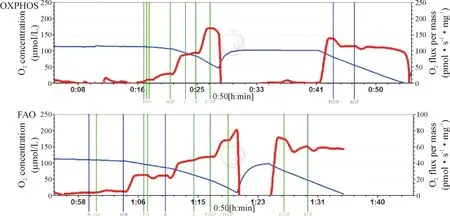
Figure 1. The mitochondrial oxidative phosphorylation (OXPHOS) and fatty acid oxidation (FAO) were showed for evaluating the change levels of oxygen consumption and O2flux determined by O2k-Fluorometry in pika liver homogenate using substrate-uncoupler-inhibitor titration (SUIT) protocols.
图1 肝脏线粒体OXPHOS 和FAO的氧耗率

Figure 2.The mitochondrial oxidative phosphorylation (OXPHOS) and fatty acid oxidation (FAO) were showed for evaluating the change levels of oxygen consumption and O2flux determined by O2k-Fluorometry in pika permeabilized muscle fibres using substrate-uncoupler-inhibitor titration (SUIT) protocols.
图2 骨骼肌线粒体OXPHOS 和FAO的氧耗率
表2 不同海拔肝脏线粒体OXPHOS及FAO的变化
Table 2.The changes of mitochondrial OXPHOS and FAO in the liver at different altitudes (Mean±SD.n=6)
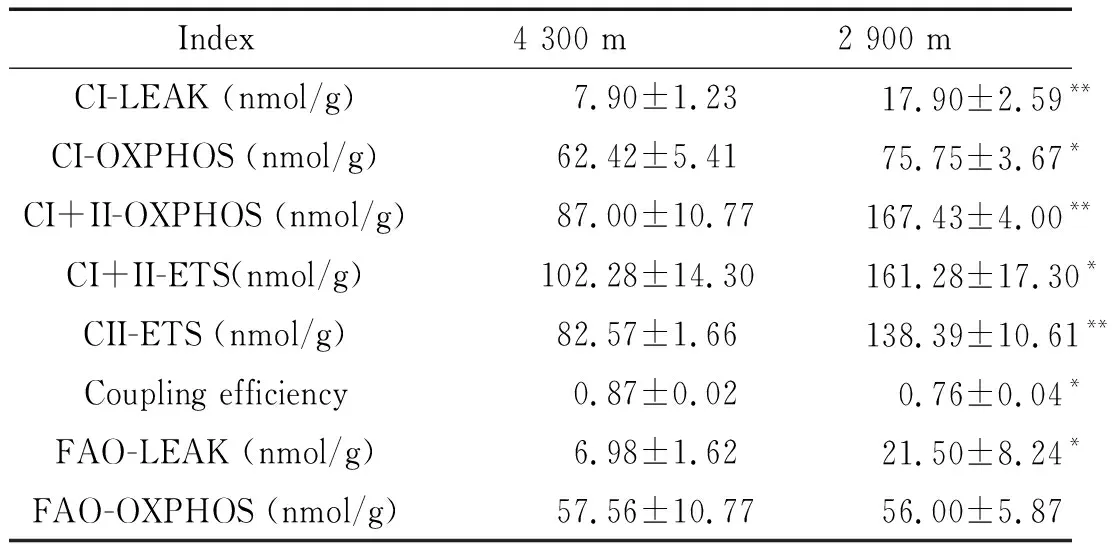
Index4 300 m2 900 mCI-LEAK (nmol/g)7.90±1.23 17.90±2.59**CI-OXPHOS (nmol/g) 62.42±5.41 75.75±3.67*CI+II-OXPHOS (nmol/g) 87.00±10.77167.43±4.00**CI+II-ETS(nmol/g)102.28±14.30161.28±17.30*CII-ETS (nmol/g) 82.57±1.66138.39±10.61**Coupling efficiency0.87±0.020.76±0.04*FAO-LEAK (nmol/g)6.98±1.62 21.50±8.24*FAO-OXPHOS (nmol/g) 57.56±10.77 56.00±5.87
*P<0.05,**P<0.01vs4 300 m group.
表3 不同海拔骨骼肌线粒体OXPHOS及FAO的变化
Table 3.The changes of mitochondrial OXPHOS and FAO in the skeletal muscle at different altitudes (Mean±SD.n=6)
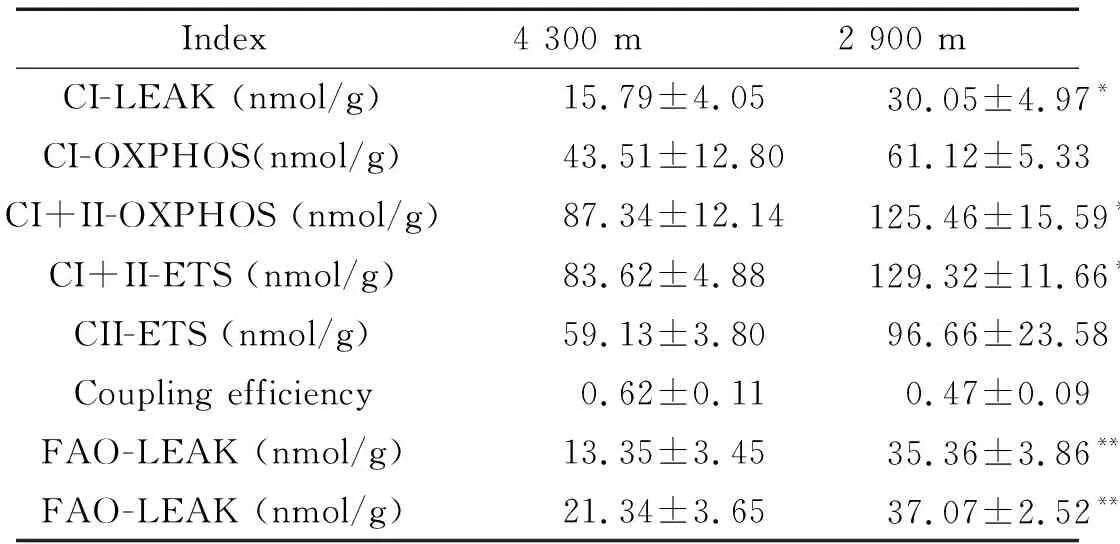
Index4 300 m2 900 mCI-LEAK (nmol/g)15.79±4.05 30.05±4.97*CI-OXPHOS(nmol/g)43.51±12.80 61.12±5.33CI+II-OXPHOS (nmol/g)87.34±12.14125.46±15.59*CI+II-ETS (nmol/g)83.62±4.88129.32±11.66**CII-ETS (nmol/g)59.13±3.80 96.66±23.58Coupling efficiency 0.62±0.11 0.47±0.09FAO-LEAK (nmol/g)13.35±3.45 35.36±3.86**FAO-LEAK (nmol/g)21.34±3.65 37.07±2.52**
*P<0.05,**P<0.01vs4 300 m group.
3 两组骨骼肌线粒体H2O2的比较
在呼吸链复合物I的态4呼吸(LEAK)、复合物I的态3呼吸(OXPHOS)、复合体I+II的态3呼吸(OXPHOS*)和复合体I+II的电子传递(ETS)过程中,2 900 m组的ΔH2O2均较4 300 m组低(P<0.05),见图3~4。
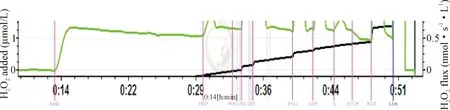
Figure 3.Skeletal mitochondrial H2O2levels and H2O2flux of pika skeletal muscle homogenate were determined using substrate-uncoupler-inhibitor titration (SUIT) protocols.
图3 骨骼肌H2O2水平测定
讨 论
O2是生物新陈代谢,维持生命活动不可缺少的物质。线粒体是真核生物O2代谢的终末端。机体内3大物质糖、蛋白质和脂肪的分解代谢最终在线粒体通过三羧酸循环和氧化磷酸化过程被消耗,为机体提供能量。而肝脏和骨骼肌是3大营养物质代谢的主要场所。同时线粒体是机体内产生活性氧簇(reactive oxygen species,ROS)的主要部位,ROS增多可损伤线粒体的功能[5]。本研究选用低氧环境不同海拔同一季节下的土著生物高原鼠兔,对其肝脏及骨骼肌线粒体OXPHOS、FAO呼吸功能进行测定,同时检测骨骼肌H2O2的产生水平,了解不同海拔高原鼠兔线粒体的适应特点。
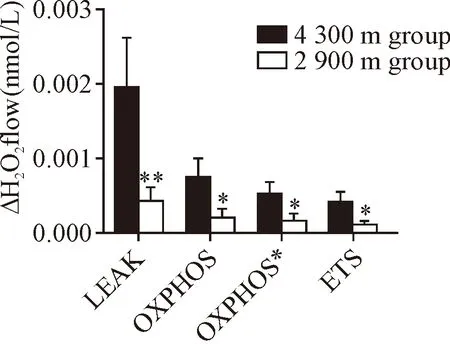
Figure 4.H2O2flux corrected for minimal observed slope. The fluorescence signals were calibrated using the H2O2titrations at the corresponding state (see Figure 1). Mean±SD.n=6.*P<0.05,**P<0.01vs4 300 m group.
图4 2组ΔH2O2的变化
本研究通过检测肝脏及骨骼肌线粒体OXPHOS水平发现,海拔4 300 m组高原鼠兔的肝脏和骨骼肌CI-LEAK水平均较海拔2 900 m组降低,海拔4 300 m组的肝脏及骨骼肌线粒体的偶联率较2 900 m组高,考虑海拔4 300 m组的鼠兔能更有效利用氧气。海拔4 300 m组肝脏线粒体CI-OXPHOS、CI+II-OXPHOS,骨骼肌线粒体CI+II-OXPHOS均较2 900 m组下降,其原因可能是在低氧环境下高原鼠兔经过长期自然选择,机体对齐对无氧呼吸的依赖性减弱,三羧酸循环反应效率有所提高[6]。有文献报道[7],在一些高海拔低氧环境土著生物中,细胞线粒体数目减少,考虑原因可能是长期低氧环境选择下机体会通过提高能量利用效率,减小体型等来减少机体能量消耗。
本研究提示海拔4 300 m组肝脏线粒体CI+II-ETS和CII-ETS及骨骼肌线粒体CI+II-ETS较2 900 m组降低,分析原因可能是在长期低氧环境下,糖酵解作用增强,丙酮酸更多地进入无氧呼吸,三羧酸循环过程中产生的还原当量减少,电子传递减少[8]。实验发现肝脏及骨骼肌线粒体FAO-LEAK、骨骼肌FAO-OXPHOS在海拔4 300 m组较2 900 m组明显降低,分析原因考虑脂肪酸氧化分解耗氧量大,低氧时线粒体内膜上的肉碱脂酰转移酶减少,内皮PAS结构域蛋白1刺激脂肪存储,减弱脂肪酸分解代谢强度[9]。
线粒体呼吸链是细胞内ROS产生的主要来源[10]。正常情况下,细胞吸收的 O2绝大部分在线粒体呼吸链被还原生成水,但同时也有2%的氧可在呼吸链中途接受电子被部分还原生成超氧阴离子和H2O2。本研究发现,海拔4 300 m组骨骼肌线粒体LEAK、OXPHOS、OXPHOS*、ETS ΔH2O2较2 900 m组升高。分析考虑低氧下,低氧诱导因子1激活丙酮酸脱氢酶激酶基因和乳酸脱氢酶A基因,阻止丙酮酸进入三羧酸循环途径,从而减少电子流的产生[8]。同时,低氧诱导因子通过调控线粒体呼吸链的效率提高电子的有效利用,减少电子泄漏,减少ROS的产生。
综上所述,在低氧环境下,线粒体复合体I的态4呼吸速率更低,但偶联率明显增高,故考虑高原鼠兔能更好地利用氧气,适应低氧环境。脂肪酸代谢水平在低氧环境下受到抑制。长期低氧环境下,高原鼠兔ROS产量减少,从而保护线粒体功能。

