质子感知受体OGR1介导酸化环境对内皮祖细胞活力和成管作用的影响*
徐 吉, 丁声龙, 陈方毅, 张继红, 桂柯科, 熊 敏, 李 炳, 赵明东△
(复旦大学金山医院 1骨科, 2中心实验室, 上海 201508; 3复旦大学附属中山医院青浦分院, 上海 200032)
股骨头缺血性坏死(avascular necrosis of the femoral head,ANFH)的特征是微循环血供损伤后发生骨细胞死亡,由于局部微循环障碍,股骨头缺血,导致局部微环境pH降低(酸化)[1]。研究证实, ANFH的发生发展是一个涉及多因素、多途径和多阶段的复杂过程,局部血管功能失调被认为是股骨头发生缺血坏死的始动因素和中心环节,被称为是“髋关节的冠心病”[2],而血管内皮祖细胞(endothelial progenitor cells,EPCs)在维持血管稳定及血管新生过程中起着关键作用。
在ANFH 的股骨头血管修复及新生过程中,各种危险因素对EPCs的影响至关重要,越来越多的学者关注并对骨髓EPCs调控ANFH发生机制进行了深入研究[3]。由于各种骨内、外致病因素引起骨组织营养血流减少、骨内血管网受压或流出静脉阻塞,造成局部血供障碍,骨组织缺血,乳酸浓度升高,质子(H+)增加[4],但是缺血缺氧性酸化如何调控EPCs在ANFH的作用途径尚未清楚。
2003年,Ludwig等[5]在 Nature 杂志上首次报道了卵巢癌G蛋白偶联受体1(ovarian cancer G-protein-coupled receptor 1,OGR1)为质子感知受体(proton-sensing receptor)。OGR1是细胞膜上感知酸性环境的受体之一,对H+敏感,并负责细胞内的信号转导,进而调控胞内一些病理生理反应[6]。在一些组织酸化的病理条件下,如哮喘等炎症性疾病的气道组织中,pH降低可激活OGRl,引发气道平滑肌细胞分泌炎症因子和气道黏液分泌增多等病理反应[7]。Saxena等[8]发现气道平滑肌细胞表达OGR1并介导酸诱导的细胞Ca2+信号,敲除OGR1基因明显抑制酸诱导的气道平滑肌收缩,表明OGR1在哮喘气道平滑肌收缩过程中发挥了重要的作用。以上学者的研究为防治由pH值降低(酸化)引起气道阻力增加的非特异性哮喘等疾病提供了新思路。那么,EPCs是否表达OGR1,深入探讨OGR1在EPCs的表达对防治血管损伤性疾病,如ANFH,有重要意义。本研究分析EPCs中OGR1的表达水平,并分析OGR1介导的酸化效应对EPCs的生长、迁移和成管作用的影响。
材 料 和 方 法
1 实验动物
健康雄性BALB/c小鼠,体重18~20 g,由复旦大学上海医学院实验动物中心提供,合格证编号为20170005011053。实验室温度控制在20~25 ℃,湿度在50%~60%,自由饮水。
2 主要试剂与仪器
DEPC、N-乙酰-L-半胱氨酸(N-acetyl-L-cysteine,NAC)和单丹磺酰戊二胺(monodansylcadaverine,MDC)(Sigma);TRIzol(Invitrogen);Reverse Transcription System逆转录试剂盒和PCR试剂盒(Fermentas);抗DiI-Ac-LDL和FITC-UEA-Ⅰ抗体及II抗(Santa Cruz);硝酸纤维素膜(Whatman);EGM-2 Single Quots培养液、胎牛血清(fetal bovine serum,FBS)和0.25%胰蛋白酶(HyClone);Matrigel基质胶(Thermo Scientific);碘化丙锭(propidium iodide,PI)、结晶紫溶液和总蛋白提取试剂盒(碧云天生物技术有限公司);抗OGR1抗体(CST);抗β-actin抗体及II抗(上海生工生物工程有限公司)。Hema18R冷冻离心机和压缩机制冷式基因扩增仪均为珠海黑马医学仪器有限公司产品。
3 方法
3.1小鼠骨髓源性EPCs的分离与培养 根据已发表文献[9],简述如下:每次取雄性BALB/c小鼠6只,麻醉后颈椎脱臼法迅速处死并置入75%乙醇中浸泡45 min。用注射器冲洗小鼠胫、股骨的骨髓腔,冲洗获得的骨髓细胞悬液以2 500 r/min离心30 min,后可观察到离心管内液体分为3层:底层为红细胞层;中层可观察到约2~3 mm厚的白膜层,此即为单个核细胞层;上层为血清层。将白膜层吸出,PBS洗涤2次,并以1 mL EGM-2 Single Quots培养液定容、混匀,制成母液。以每孔5×106个的细胞量接种于人纤维连接蛋白包被的6孔培养板中,并置于37 ℃、5% CO2细胞培养箱中培养。
3.2免疫荧光法鉴定小鼠EPCs 取培养至第21天的EPCs,接种细胞于纤维连接蛋白包被的载玻片上。21 d后取出载玻片,4%多聚甲醛固定20 min,PBS漂洗3次,山羊封闭血清30 min, 加入抗DiI-Ac-LDL和FITC-UEA-Ⅰ抗体(1 ∶100)于4 ℃孵育过夜。次日,PBS漂洗3次,加入羊抗大鼠IgG-FITC(1 ∶200)及羊抗兔IgG-PE(1 ∶500),常温下孵育1 h。PBS漂洗2遍后,以10%缓冲甘油封片。于倒置荧光显微镜下观察细胞DiI-Ac-LDL和FITC-UEA-Ⅰ的表达情况。
3.3实验分组 分别采用pH 7.4,7.0,6.8,6.4和6.2的培养基处理EPCs 24 h,后用Western blot和real-time PCR分析OGR1的蛋白和mRNA表达;并分析OGR1在酸性环境中对EPCs的活力、迁移和成管能力的影响,分为pH 7.4对照(control)组、pH 6.4组、pH 6.4+干扰序列对照(control small interfering RNA, control-siRNA)组和pH 6.4+OGR1-siRNA组,处理时间为24 h。
3.4RT-PCR和real-time PCR实验 按试剂盒说明操作,用TRIzol 提取总RNA,无RNA酶活性的DNA 酶消化以降解基因组DNA,酚仿抽提纯化,电泳检测完整性,RNA浓度测试后置于-70 ℃冰箱保存。后各取2 μg 总RNA和Oligo (dT) 16 (10 pmol/L) 1 μL,用M-MLV 逆转录酶逆转录成cDNA,加入ASICs特异性引物,引物由上海生工生物公司合成,见表1。反应条件:94 ℃ 预变性5 min;94 ℃变性30 s, 58 ℃退火 30 s,72 ℃延伸 1 min,40个循环;72 ℃延伸10 min结束反应。结果以2-ΔΔCt法分析。对于RT-PCR实验,取6 μL PCR产物与2 μL Loading Buffer 混合,进行琼脂糖凝胶电泳并拍照。

表1 RT-PCR 引物序列
3.5Western blot实验 收集细胞加入细胞裂解液,提取细胞的总蛋白样品经Larry 法定量,取50 μg 蛋白上样,行15 % 的SDS-PAGE(100 V,1.5 h)。待溴酚蓝进入凝胶底部后,把蛋白质再印迹到硝酸纤维素膜上,分别用抗OGRI和β-actin抗体孵育过夜,后加入用碱性磷酸酶标记的相应 II 抗,显色剂显色,凝胶成像分析。
3.6OGR1-siNRA的转染 OGR1-siRNA的设计参考文献[1],正义序列为5′-UAGAAAGCAAGCCAGGAAGAUGACC-3′,非特异性的非靶向control-siRNA作为对照。OGR1-siRNA和control-siRNA均由上海吉玛公司合成。EPCs经胰酶消化重悬后计数,在6孔板中铺板,每孔加入2×105个细胞,培养过夜。转染使用Lipofectamine 2000(Invitrogen)进行,具体转染方法依据Invitrogen的操作手册。转染后48 h,根据实验分组设计的处理方法进行干预。转染后,提取细胞总蛋白行Western blot检测分析转染效果。
3.7CCK-8 实验检测细胞活力 在96孔板每孔铺5 000个细胞,EPCs按照实验分组进行处理24 h后,将培养基更换成100 μL新鲜的培养基,然后在每孔中加入10 μL的CCK-8试剂,在37 ℃培养箱中孵育2 h,最后在酶标仪上于450 nm波长处测量并读取吸光度(A)值。
3.8流式细胞术分析细胞周期分布 EPCs按照实验分组处理后,用胰蛋白酶消化各组细胞并重悬于70%乙醇中,将细胞在-20 ℃中培养过夜。然后将固定的细胞用预冷PBS洗涤2次,加入含40 mg/L的PI和200 mg/ mL 的RNase A的碘化丙啶染色液,避光在37 ℃中孵育30 min。DNA含量用流式细胞仪(FACSCalibur,BD Biosciences)和细胞周期分布由FlowJo 7.6.1(Tree Star Inc)测定。
3.9划痕实验 胰酶消化细胞,并将细胞均匀接种至6孔板。待细胞生长至90%融合度时,将培养液换成无FBS培养液,放入培养箱中培养1 h。每孔用200 μL枪头比着直尺画一“十”字形划痕,尽量保证划痕宽度一致。PBS漂洗3次,去除漂浮的细胞,并加入无FBS培养液。培养48 h后在显微镜下于固定位置取样并拍照。使用ImageJ软件测量细胞迁移距离。
3.10Transwell迁移实验 迁移实验使用未铺Matrigel胶的8 μm Transwell小室。Transwell小室下室中加入600 μL含1% FBS的DMEM培养液,胰酶消化细胞,1 000 r/min离心5 min后去上清,DMEM完全培养液重悬细胞。细胞计数后,调整细胞浓度后,在Transwell小室上室加入100 μL细胞悬液,迁移实验中,每个小室加入的细胞数为3×104个。将Transwell小室放入培养箱中培养24 h后,弃去培养液,上室放入4%多聚甲醛中,室温固定15 min。吸干固定液,将上室放入0.1%的结晶紫溶液中,室温染色15 min。显微镜下取3个随机高倍视野计数细胞,使用ImageJ软件统计结果。
3.11成管实验 按照试剂盒说明书配制ECMatrix胶,将配好的ECMartrix胶添加到在4 ℃预冷的96孔板中,每孔50 μL,4 ℃,1 000 r/min离心10 min,使其平铺于板底,并去除气泡,后在37 ℃培养箱中孵育超过1 h,放至ECMartrix胶完全凝固。使用EPCs的细胞悬液(方法同上),细胞浓度调整为(2.5~5)×107/L,每孔加入200 μL[每孔约(5~10)×103个细胞],根据不同实验组添加不同pH的培养液,在细胞培养箱(37 ℃、5% CO2)内培养,6 h后在相差显微镜下拍照,观察管腔形成情况。
4 统计学方法
应用SPSS 18.0统计软件进行分析。计量资料以均数±标准差(mean±SD)表示,多组间数据比较采用单因素方差分析,如方差分析的结果具有统计学意义,再使用SNK-q方法进行各组均数间的两两比较。以P<0.05为差异具有统计学意义。
结 果
1 内皮祖细胞的形态观察及鉴定
原代培养的骨髓源性EPCs呈圆形,形态饱满,折光性好;培养2 d后的内皮祖细胞开始贴壁,形态变为短梭状;3 d 后开始增殖,体积增大。用DiI-Ac-LDL和FITC-UEA-Ⅰ双荧光染色法鉴定分化中的内皮祖细胞,在激光共聚焦显微镜下,DiI标记的ac-LDL为红色荧光,而FITC标记的UEA-Ⅰ为绿色荧光,红、绿荧光双染的细胞即为EPCs,见图1。
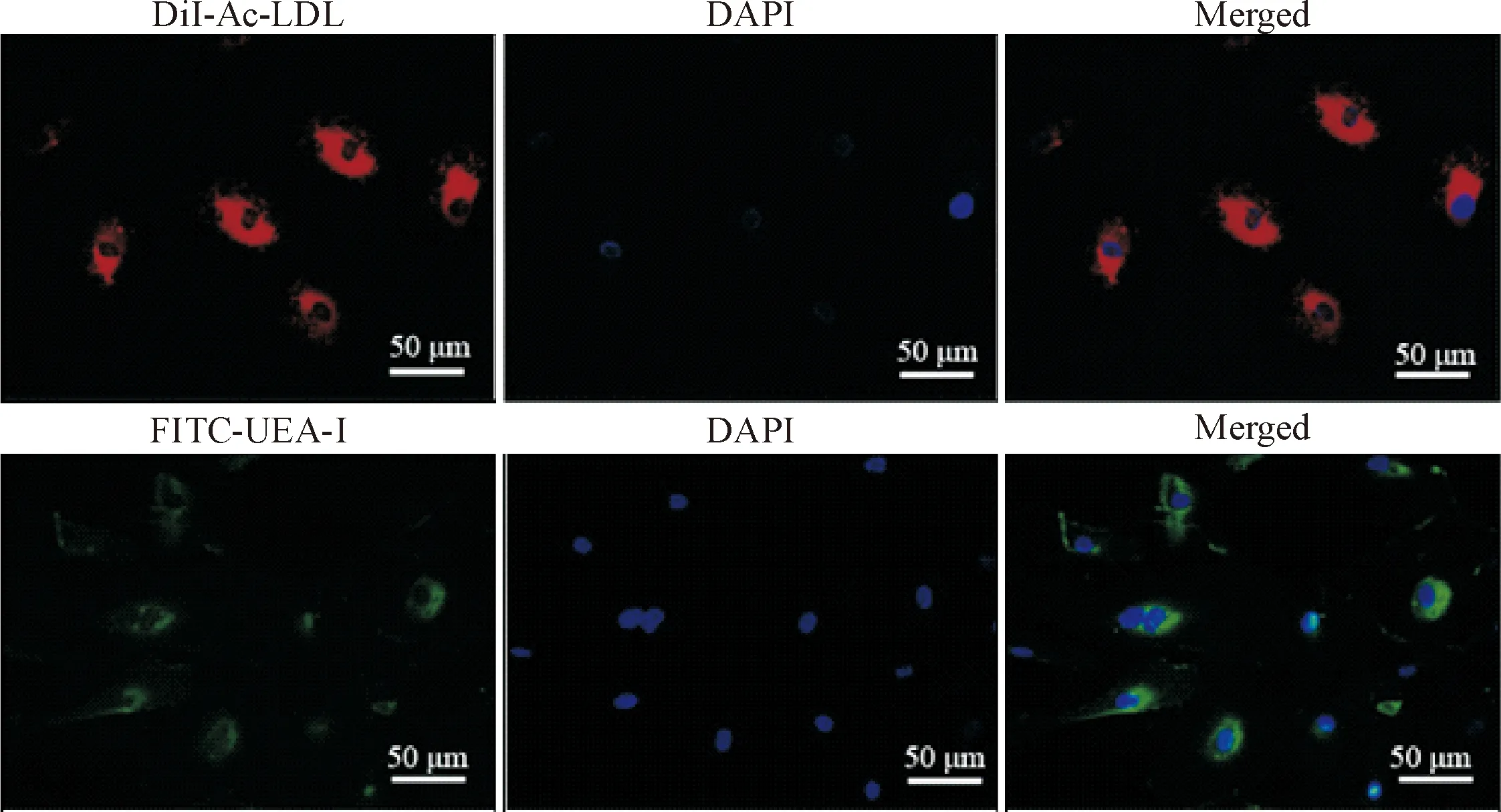
Figure 1.The EPCs were stained with DiI-Ac-LDL and FITC-UEA-Ⅰ.
图1 EPCs摄取DiI-Ac-LDL和结合FITC-UEA-Ⅰ的双荧光染色鉴定
2 OGR1在EPCs的表达
提取EPCs总RNA后逆转录成cDNA,用RT-PCR检测,以肝作为阳性对照,发现EPCs中质子感知受体OGR1、G2A、GPR4和TDAG8的mRNA均有表达,其中OGR1和TDAG8表达最高,见图2A。而采用real-time PCR并以OGR1为对照组后分析发现,EPCs中G2A和GPR4的mRNA含量明显低于OGR1(P<0.05),见图2B。为进一步证实OGR1在EPCs的表达,根据real-time PCR结果,分别提取EPCs的总蛋白,采用Western blot的方法检测OGR1的蛋白表达,结果表明EPCs中有OGR1的蛋白表达,见图2C。免疫荧光细胞化学双标记实验结果可以看出,FITC配体荧光检测可见EPCs细胞膜有明显蓝色免疫荧光,OGR1在细胞膜中有表达,见图2D。
3 酸性环境促进OGR1在EPCs上的高表达
为分析酸性环境对EPCs上OGR1表达的影响,用不同pH的培养基处理EPCs 24 h,Western blot分析OGR1的表达是否随着pH值而改变,结果发现细胞外环境的pH值从7.4到6.4逐渐下降过程中,OGR1表达逐渐升高,而pH达6.2时OGR1表达却反而下降(P<0.05),见图3A。Real-time PCR结果与Western blot的结果相似,pH 6.4处理后EPCs中OGR1的表达比对照组明显升高,而pH 6.2处理后EPCs中OGR1的表达比pH 6.4处理后更低(P<0.05),见图3B,说明酸性环境可以明显促进OGR1的表达,因此后续研究使用pH 6.4的培养基作为处理EPCs的酸性环境。
4 OGR1介导酸对EPCs细胞活力的抑制作用
RNAi方法敲减OGR1的表达,进一步分析OGR1在EPCs中的作用。Western blot发现与转染control-siRNA的细胞相比,转染OGR1-siRNA 48 h后细胞中的OGR1表达明显下降(P<0.05),见图4A。CCK-8实验结果显示,pH 6.4的培养基明显抑制EPCs的细胞活力,但是敲减OGR1表达后却可以明显逆转酸性环境对EPCs的作用,证实OGR1可能介导了酸对EPCs细胞活力的抑制作用(P<0.05),见图4B。流式细胞术分析细胞周期分布发现,与对照组相比,在pH 6.4的培养基中,处于G0/G1期细胞的百分率明显升高,而S+G2/M期细胞的百分率却明显下降,说明酸性环境可以导致EPCs的生长停滞;然而敲减OGR1表达后G0/G1期细胞的百分率下降,而S+G2/M期细胞的百分率上升(P<0.05),见图4C,因此OGR可能介导酸对EPCs生长周期的作用。
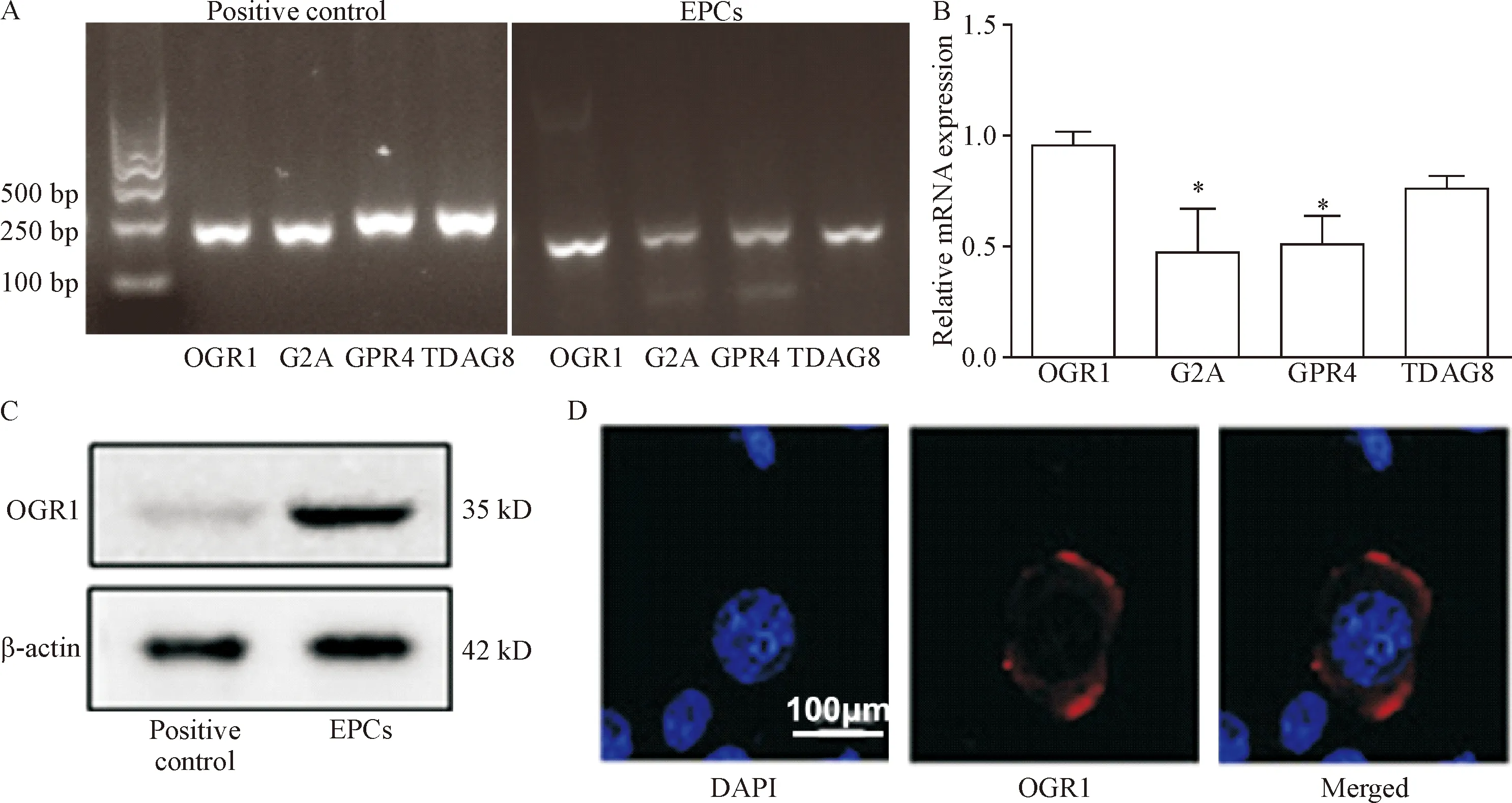
Figure 2.The expression of OGR1 in the EPCs. A: RT-PCR was used to detect the mRNA expression of proton-sensing receptor. The liver tissue was used as positive control; B:the mRNA expression of proton-sensing receptor expression was detected by real-time PCR; C: Western blot was used to determine the protein expression of OGR1; D: immunofluorescence staining was used to detect the OGR1 expression in the EPCs. Mean±SD.n=6.*P<0.05vsOGR1 group.
图2 OGR1在EPCs的表达
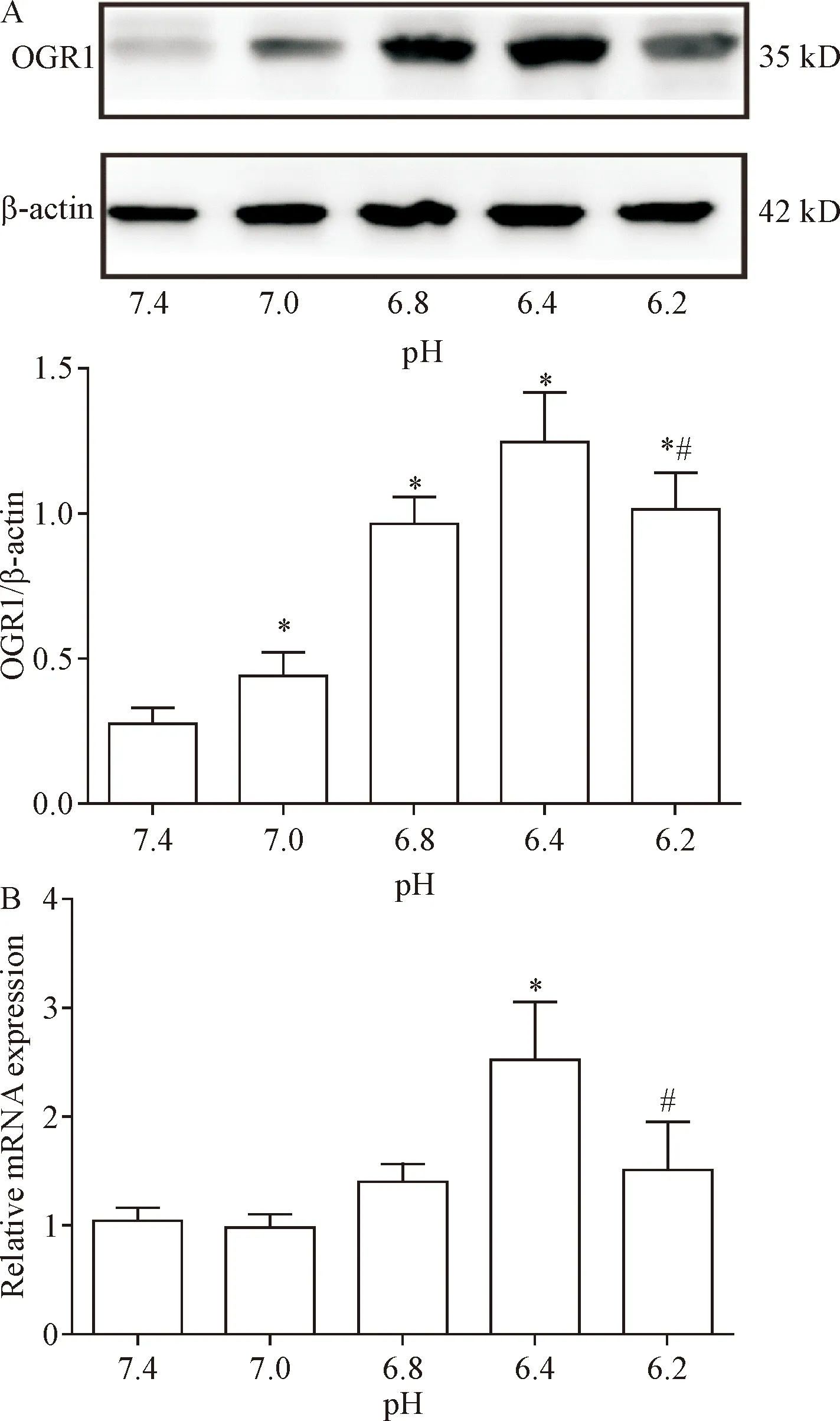
Figure 3.The effect of acid medium on the expression of OGR1 in the EPCs. A: the results of Western blot for determining the protein expression of OGR1 in the EPCs; B: the result of real-time PCR for detecting the mRNA expression of OGR1. Mean±SD.n=6.*P<0.05vs7.4 group;#P<0.05vspH 6.4 group.
图3 酸性环境培养基对EPCs中OGR1表达的影响
5 OGR1介导酸性环境对EPCs的迁移和成管能力的抑制作用
最后通过划痕实验、Transwell迁移实验以及成管实验分析酸性环境对EPCs的迁移和成管能力以及OGR1在其中的作用。划痕实验发现pH 6.4的培养基明显抑制EPCs的迁移,但是敲减OGR1的表达后可以部分逆转上述作用(P<0.05),见图5A,这说明OGR1可能介导了酸性环境对EPCs迁移的抑制作用;Transwell迁移实验结果与划痕实验的结果相似,进一步证实了OGR1在酸性环境抑制EPCs迁移中的作用,见图5B;成管实验发现酸性环境明显抑制EPCs的成管能力,但是敲减OGR1表达后EPCs的成管能力明显增强(P<0.05),见图5C,这说明OGR1可能介导了酸性环境对EPCs成管能力的抑制作用。
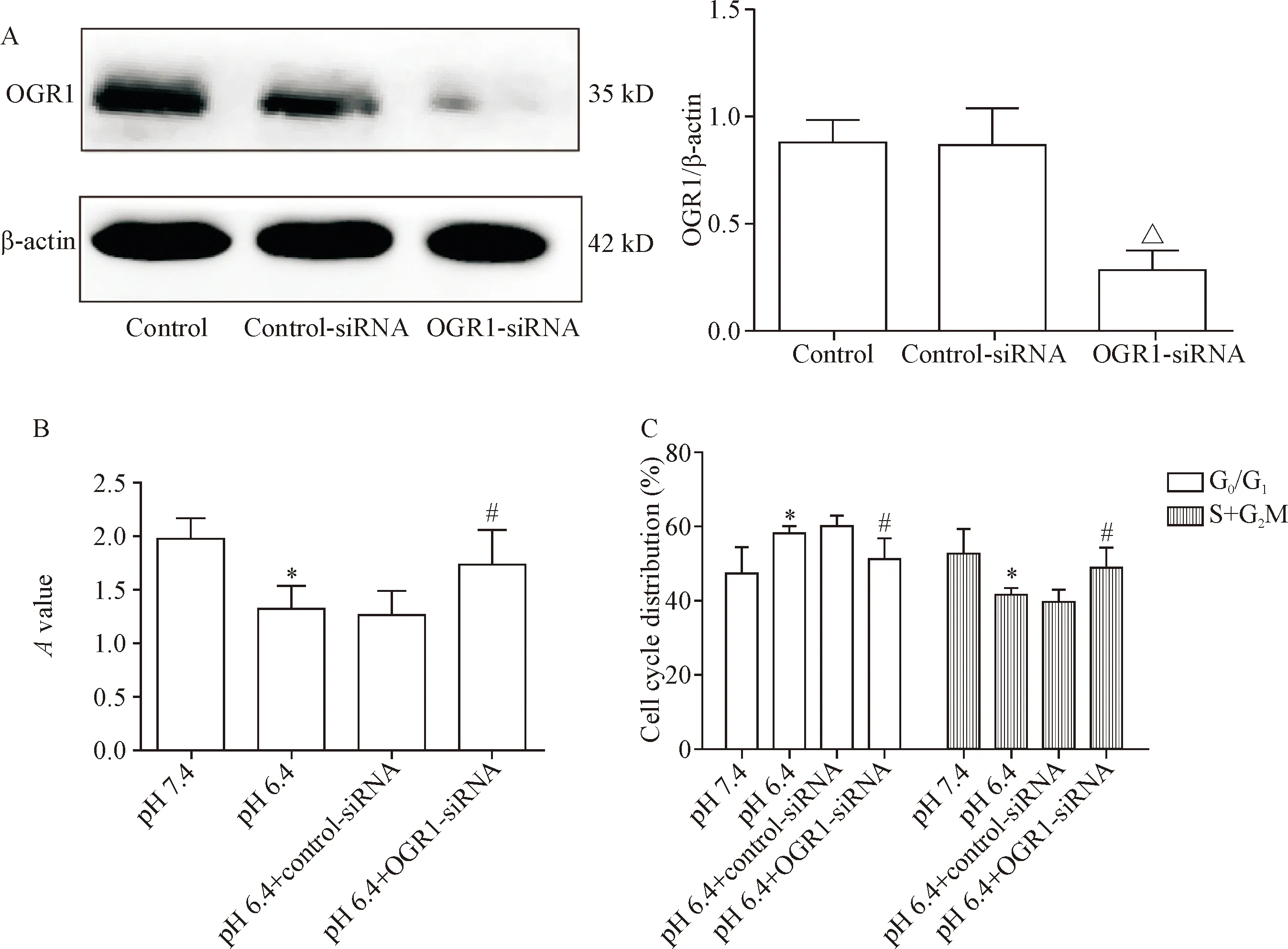
Figure 4.The involvement of OGR1 expression in the inhibitory effects of acidic environment on the viability and the cell cycle distribution of EPCs. A:the results of Western blot for determining the protein level of OGR1 in the EPCs after transfection; B:the result of CCK-8 assay for detecting the cell viability; C:the quantification of cell cycle distribution was detected by flow cytometry. Mean±SD.n=6.△P<0.05vscontrol-siRNA group;*P<0.05vspH 7.4 group;#P<0.05vspH 6.4+control-siRNA group.
图4 OGR1介导酸性环境对EPCs活力和周期分布的影响
讨 论
局部微循环的受损和功能失调被认为是ANFH的始动因素,而血管的自我修复往往对最终的骨坏死和骨塌具有重要作用[10]。骨修复的有效性依赖于血管损伤的程度和侧枝血管的建立。因此,既往对于ANFH的研究主要着眼于血管内皮细胞的改变[11],但是近来的研究发现骨髓源性EPCs相较于成熟的内皮细胞更多地参与血管化的过程以及血管的修复[12]。
EPCs主要来源于骨髓,是一种能直接分化为血管内皮的前体细胞,具有促进新生血管形成及提高微血管密度、促进内皮再生和提高血管通畅率等作用;其不仅参与胚胎期的血管发育,也在成体血管新生及维持血管稳定中起着重要的作用。此外,有研究发现富含EPCs的细胞系也能向成骨定向分化[13]。而且,越来越多的研究聚焦于骨骼损伤和骨修复中,提升EPCs水平能有助于血管新生,并利于新骨的形成,且在骨骼损伤或骨骼牵引术中,均可动员骨髓的EPCs释放到血液循环,并促进血管新生,从而达到骨修复和骨愈合[14]。EPCs作为骨再生修复医学的热点很大程度上取决于骨骼发育的细胞水平,血管新生与新生骨互相促进。最近的研究发现股骨头缺血性坏死患者的循环EPCs数目和功能都显著降低[4, 10],这些都强烈提示EPCs功能失调可能是股骨头缺血性坏死发病机制的始动因素和中心环节及治疗的关键靶点。本课题使用DiI-Ac-LDL和FITC-UEA-l双荧光染色法成功鉴定了内皮祖细胞,为后续的实验奠定基础。
已证实质子感知受体OGR1在哮喘等炎症性疾病中发挥重要作用,而缺血性坏死与炎症酸化具有相似病理基础,那么EPCs中是否有OGR1的表达?本研究中利用RT-PCR技术发现OGR1在EPCs中mRNA的表达,进一步用Western blot也证实OGR1蛋白的存在。OGR1在EPCs中的研究有助于我们对疾病的认识,尤其是病变组织酸化常常与病理变化呈现一定程度的相关性。
Figure 5.The involvement of OGR1 expression in the inhibitory effect of acidic environment on the migration and tube formation ability of EPCs. A: scratch wound-healing assay was conducted in the EPCs with indicated treatment;B:Transwell migration assay was conducted in the EPCs with indicated treatment; C:the representative results of tube structure formation in cultured EPCs.Mean±SD.n=6.*P<0.05vspH 7.4 group,#P<0.05vspH 6.4+ control-siRNA group.
图5 OGR1介导酸性环境对EPCs的迁移和成管能力的抑制作用
各种因素引起的股骨头血供少、血管网受压或流出静脉阻塞引起的局部血供障碍,导致股骨头乳酸浓度升高,质子增加从而成为酸性微环境[4],但是酸化的环境对EPCs的作用以及其中的具体机制仍然未知。OGR1是一种酸环境的感知受体,属于质子感知受体的一员。最近发现的质子感知受体包括OGR1,G蛋白偶联受体G2A(G2 accumulation),T 细胞死亡相关基因8(T cell death-associated gene 8,TDAG8)和G 蛋白偶联受体4(G-protein-coupled receptor 4,GPR4)[15],这些受体均是卵巢癌G蛋白偶联受体(G-protein-coupled receptors,GPCR)亚家族成员,GPCR介导细胞内多种信号通路的传递作用,并参与一些病理生理过程[16]。
GPCR亚家族在体内分布广泛,其中OGR1因在破骨细胞表达且介导细胞内Ca2+的释放被关注[16]。细胞外酸性环境能诱导终板软骨细胞和破骨细胞Ca2+的水平迅速升高。用OGR1 的拮抗剂处理细胞,或用siRNA 抑制OGR1表达时,此效应被减弱,这证实OGR1可能介导了酸性环境对细胞作用,负责细胞内的一系列信号转导并调控细胞功能[17]。本实验通过Western blot及real-time PCR首次证实酸性环境诱导EPCs上的OGR1高表达,并且pH 6.4的培养基中OGR1表达最高,并以此作为下一步实验的基础。
不同的微环境对EPCs的增殖和成管能力可以产生不同的影响。Kim等[18]发现低氧微环境可以促进人EPCs增殖、迁移和成管能力,并且线粒体分裂及相关的信号通路参与其中。但是Wu等[19]发现在高糖和低氧的微环境却可以抑制大鼠骨髓源性EPCs增殖、迁移和成管能力,并促进EPC的凋亡。而本课题通过Transwell、划痕实验和成管实验等证实pH 6.4的酸环境抑制EPCs的活力、迁移和成管能力。更重要的是,我们通过siRNA沉默OGR1后证实OGR1可能介导了酸性环境对EPCs的作用,但是具体的OGR1下游的信号机制上需要进一步研究。
结合上述实验结果,我们发现酸性环境促进小鼠骨髓来源EPCs高表达OGR1,然而酸性环境却抑制EPCs生长、迁移和成管能力,敲减OGR1的表达可逆转酸性环境对EPCs的作用,因此OGR1可能介导了酸性环境对EPCs生物学功能的抑制作用。OGR1在EPCs表达及作用有望为ANFH防治研究开辟新的突破点。

