蜕膜巨噬细胞通过外泌体调控滋养细胞生物学行为参与不明原因复发性流产*
应 翔, 金筱筱, 张紫娟, 王 凯, 丁陈静, 郑灵芝
(温州医科大学附属台州医院产科, 浙江 台州 317000)
复发性流产(recurrent spontaneous abortion,RSA)的发病率在全部妊娠中占1%~5%,严重危害女性生育健康,其中,将近50%的患者病因不明,称为不明原因复发性流产(unexplained recurrent spontaneous abortion,URSA)。妊娠的成功有赖于滋养细胞功能正常和母胎免疫耐受平衡。目前研究表明,破坏滋养细胞生物学行为参与复发性流产的发生[1]。巨噬细胞构成母胎免疫耐受微环境[2],而其参与URSA的机制尚未阐明。新近研究表明,外泌体内富含蛋白、核酸和脂质等生物活性分子,参与母胎间交流[3]。本研究拟探讨蜕膜巨噬细胞外泌体对滋养细胞的生长和迁移功能的调节作用,为URSA发病机制研究提供新思路。
材 料 和 方 法
1 材料
1.1材料来源 收集2017年2月~2019年1月在浙江省台州医院就诊的URSA患者(URSA组)及正常早孕人工流产妇女[正常对照,(normal control, NC)组]的蜕膜组织。URSA组选择自然流产2次及以上的患者,年龄在25~35岁之间,B超提示胚胎停止发育,且排除绒毛染色体异常和夫妻双方外周血染色体核型异常、甲状腺功能异常、糖尿病、性激素异常、生殖道畸形、凝血功能异常、生殖道感染、免疫紊乱、子宫动脉血流异常和男方精液异常等因素所致的流产。正常组选择年龄25~35岁,既往无不良孕产史,B超提示胚胎发育正常的早孕人工流产妇女。
1.2实验试剂 外泌体分离试剂盒购自 Invitrogen; 抗CD63抗体购自Abcam;PKH67染色剂购自Sigma;MTS染色剂购自Promega;钙黄绿素 AM 染料购自Invitrogen;CD14 细胞磁珠分离试剂盒购自Miltenyi Biotec。
1.3细胞系 滋养细胞系HTR8/Snveo由上海第一妇婴保健院中心实验室馈赠。
2 方法
2.1蜕膜巨噬细胞的分离和原代培养 收集正常早孕妇女及URSA患者流产后的蜕膜组织,置于DMEM/F12培养液中,30 min内带回实验室,予PBS漂洗干净后剪碎、研磨、过滤,制成细胞悬液。Ficoll密度梯度离心法获得单个核细胞,免疫磁珠法分选CD14+细胞即为蜕膜巨噬细胞,洗涤后加入含10% 胎牛血清的RPMI-1640培养液(含 100 mg/L青霉素和100 mg/L链霉素),置于37.5 ℃、含5% CO2的细胞培养箱培养,2组均取5×105个巨噬细胞。本研究经过伦理委员会批准,且取得患者的知情同意。
2.2蜕膜巨噬细胞外泌体的制备 收集正常早孕妇女及URSA患者蜕膜CD14+巨噬细胞培养1 d后的上清,2 000 r/min离心30 min去除细胞及细胞碎片,转移离心后细胞上清至新的离心管,加入细胞上清的外泌体提取试剂,按照试剂说明书要求分离获得蜕膜巨噬细胞的外泌体,BCA蛋白定量法检测外泌体浓度。
2.3蜕膜巨噬细胞外泌体的鉴定 分离蜕膜CD14+巨噬细胞的外泌体,透射电镜观察巨噬细胞外泌体的大小和形态学特点。Western blot法检测巨噬细胞外泌体的外泌体标志蛋白CD63的表达水平。
2.4蜕膜巨噬细胞与HTR8/Snveo滋养细胞共培养 取对数生长期的HTR8/Snveo细胞,按每孔 5×105铺于含5% 胎牛血清的DMEM/F12的6 孔板中。正常早孕人工流产和URSA蜕膜巨噬细胞外泌体以100 mg/L的浓度与HTR8/Snveo细胞共培养。
2.5HTR8/Snveo细胞摄取外泌体的示踪实验 将HTR8/Snveo细胞按每孔5 × 105个接种于6孔板。将染色剂 PKH67 加入巨噬细胞外泌体中,室温孵育 5 min,加入1 mL 含 1% 牛血清白蛋白的无血清培养基终止标记反应。在混合物中加入20 mL PBS,4 ℃、100 000×g离心2 h,重复2次。用2 mL培养基重悬,加入HTR8/Snveo细胞培养皿中, 37 ℃ 培养24 h,荧光显微镜观察样本。
2.6MTS法检测共培养后HTR8/Snveo滋养细胞的活力 建立蜕膜巨噬细胞外泌体和滋养细胞的共培养体系,将共培养后的HTR8/Snveo细胞按每孔2×103个接种于96孔板,每组设3个复孔。共培养1 d、2 d和3 d后,每孔加入20 μL的MTS染色剂,继续培养1 h,在酶标仪上检测490 nm处各孔的吸光度(A)值。实验重复3次。
2.7Transwell法检测共培养后HTR8/Snveo滋养细胞的迁移能力 选用8 μm孔径的Transwell板检测细胞的迁移能力。将HTR8/Snveo细胞按每孔5×104个接种于 Transwell的专用孔板中,上室加200 μL含1%胎牛血清的DMEM/F12培养基,下室加正常早孕人工流产或URSA蜕膜巨噬细胞外泌体。24 h后对下室细胞使用钙黄绿素 AM 染料染色,荧光显微镜观察并对细胞进行计数,每孔取6个视野计数。
3 统计学处理
采用 SPSS 20.0软件进行统计学处理,计量资料以均数±标准差(mean±SD)表示,采用独立样本t检验和单因素方差分析。以P<0.05 为差异有统计学意义。
结 果
1 蜕膜巨噬细胞外泌体的鉴定
透射电子显微镜下显示,外泌体近似圆形,直径40~80 nm,见图1A;Western blot法结果表明,蜕膜巨噬细胞外泌体高表达CD63,见图1B。

Figure 1. Representative transmission electron microscopy micrograph of exosomes derived from decidual macrophages (A) and immunoblot of CD63 in exosomes derived from decidual macrophages (B).
图1 蜕膜巨噬细胞电镜图及外泌体标志蛋白CD63在蜕膜巨噬细胞及蜕膜巨噬细胞来源外泌体中的表达水平
2 巨噬细胞外泌体可被滋养细胞HTR8/Snveo摄取
PKH67染色巨噬细胞外泌体,将其与滋养细胞HTR8/Snveo共培养,荧光显微镜显示HTR8/Snveo胞质内出现荧光,见图2,表明外泌体可被滋养细胞摄取。
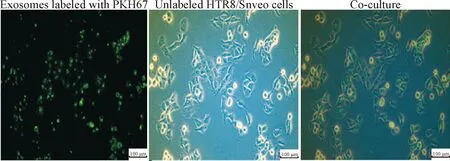
Figure 2. Unlabeled HTR8/Snveo cells were incubated with decidual macrophage-derived exosomes that were labeled with PKH67. Data exhibits typical image of 3 independent experiments.
图2 外泌体被滋养细胞摄取
3 URSA蜕膜巨噬细胞外泌体抑制滋养细胞HTR8/Snveo的活力
将蜕膜巨噬细胞外泌体和HTR8/Snveo 共培养,MTS法检测结果显示,同正常早孕人工流产蜕膜巨噬细胞外泌体组比较,共培养2 d和3 d后URSA蜕膜巨噬细胞外泌体组HTR8/Snveo细胞的活力明显下降(P<0.05),见图3。这表明URSA蜕膜巨噬细胞外泌体能够抑制滋养细胞的活力。
4 URSA蜕膜巨噬细胞外泌体抑制滋养细胞的迁移能力
Transwell实验表明,URSA蜕膜巨噬细胞外泌体组的HTR8/Snveo细胞迁移数较正常早孕人工流产蜕膜巨噬细胞组下降(P<0.01), 见图4。这提示URSA蜕膜巨噬细胞外泌体抑制滋养细胞的迁移能力。
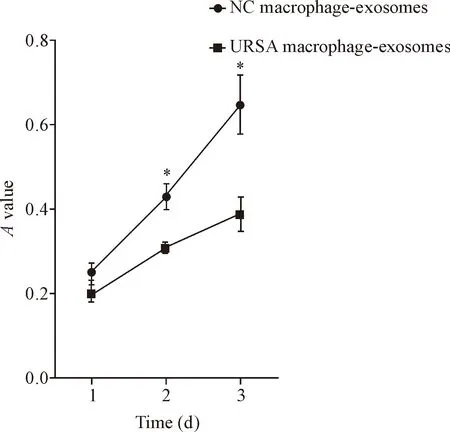
Figure 3.Cell viabitility of HTR8/Snveo cells which incubated with the supernatants of decidual macrophage-derived exosomes from normal pregnant induced abortion women or URSA women was detected by MTS assay. Mean±SD.n=3.*P<0.05vsURSA macrophage-exosomes group.
图3 蜕膜巨噬细胞外泌体对滋养细胞 HTR8/Snveo的细胞活力的影响
讨 论
目前,URSA病因及发病机制尚不清楚。正常妊娠的建立维持需要母胎免疫耐受微环境的建立和滋养层细胞生物学功能有序可控地进行。母胎界面的细胞大致由胎儿来源的滋养细胞和母体来源的蜕膜免疫活性细胞、蜕膜基质细胞及腺上皮细胞构成。研究表明,滋养细胞生物学行为的破坏可引起流产等病理性妊娠的发生[1, 4]。本研究选用的滋养细胞系HTR8/Snveo的生物学行为接近原代滋养细胞,被广泛应用于复发性流产滋养细胞功能的研究。
母胎免疫耐受失衡可引起母体对胎儿的免疫排斥,临床上表现为复发性流产、胎儿发育受限等病理性妊娠[5],其中,蜕膜的免疫活性细胞群由NK细胞、T 细胞和巨噬细胞组成,是母胎免疫耐受形成的基础。子宫内的巨噬细胞具有吞噬、抗原递呈、分泌细胞因子等作用,占妊娠期间免疫职能细胞的20%~30%,在母胎界面稳态的建立及维持中扮演重要角色[2, 6]。然而,蜕膜巨噬细胞和胚胎滋养细胞之间的相互作用参与妊娠的具体机制尚未明了。
外泌体可存在于母胎界面,作为母胎间信息交流的载体[7],在妊娠维持、子痫前期、妊娠期糖尿病等正常及病理妊娠中发挥相应作用。有研究报道,巨噬细胞通过外泌体影响胎盘细胞因子的产生[8]。此外,外泌体可存在于母体的外周血中,有望成为病理性妊娠诊断的生物新标记[9-10]。近年来,很多研究表明,外泌体被靶细胞内吞后,可将其内容物传递给靶细胞并发挥相应的生物学活性[11]。本研究结果证实,蜕膜巨噬细胞的外泌体可被滋养细胞内吞。分离正常早孕人工流产和URSA的蜕膜巨噬细胞的外泌体,分别同滋养细胞HTR8/Snveo细胞共培养,结果发现URSA蜕膜巨噬细胞的外泌体抑制滋养细胞的活力和迁移能力。由此提示蜕膜巨噬细胞可通过外泌体调控滋养细胞生物学行为,造成胚胎停止发育,参与URSA的发生。

Figure 4.Migration capacity of HTR8/Snveo cells which incubated with the decidual macrophage-derived exosomes from normal pregnant induced abortion women or URSA women was detected by Transwell assay. Mean±SD.n=3.*P<0.05vsNC macrophage-exosomes group.
图4 蜕膜巨噬细胞外泌体对滋养细胞 HTR8/Snveo迁移能力的影响
本研究为针对URSA的巨噬细胞靶向治疗提供了实验依据,今后的研究重点是进一步探讨外泌体调节滋养细胞的分子机制并探索URSA血清分离的外泌体情况及内容物,为URSA早期诊治开辟新思路。

