长链非编码RNA-671对食管鳞癌细胞增殖和侵袭的影响*
郝跃鹏, 赵梓彤, 杨成园, 宋咏梅△, 王晓霞△
(1山西医科大学生物化学与分子生物学教研室,山西 太原 030001; 2国家癌症中心,国家肿瘤临床医学研究中心,中国医学科学院北京协和医学院肿瘤医院,分子肿瘤学国家重点实验室, 北京 100021)
食管癌是全球范围内常见的消化道恶性肿瘤之一,其发病率和死亡率均居世界前列[1]。食管癌常见的组织病理分型为食管鳞癌和食管腺癌,我国以食管鳞癌为主[2]。长链非编码RNA(long non-coding RNA, lncRNA)是指一类长度超过200个核苷酸且不编码蛋白的RNA[3]。lncRNA在肿瘤中发挥着重要作用,其表达异常可以影响肿瘤细胞的增殖、凋亡、转移和血管生成[4-8]。因此,lncRNA在肿瘤的发生发展中有重要的作用,其作为肿瘤治疗的靶点具有广泛应用前景[9]。虽然已经报道了多种lncRNA能够调节肿瘤发生和转移,但是lncRNA在食管鳞癌中的功能作用在很大程度上仍是未知的。lnc671(SHANK2-AS3)是1个长1 683 bp,位于11q13.4上,有3个外显子区的lncRNA。目前,尚无lnc671在癌症中作用的研究报道。本文主要探讨lnc671在食管鳞癌细胞系中的表达水平以及使用siRNAs干扰lnc671的表达后观察其对食管鳞癌细胞增殖、迁移和侵袭的影响,为今后进一步研究其在食管癌中发生发展的作用机制提供参考资料。
材 料 和 方 法
1 细胞及培养
人食管鳞癌细胞系由分子肿瘤学国家重点实验室保存,用含10%胎牛血清、100 mg/L青霉素和100 mg/L链霉素的RPMI-1640培养液,在5%CO2的细胞培养箱中37℃恒温培养。
2 方法
2.1生存分析 在基因表达谱交互分析(GEPIA)网站(www.gepia.cancer-pku.cn)上检索关键词“SHANK2-AS3,Survival Plots,ESCA”,得到lnc671的表达水平与食管癌患者生存长短的关系图。
2.2小干扰RNA(small interfering RNA, siRNA)的设计及转染 本研究中使用的3条siRNAs序列(si-1、 si-2和si-3)由Invitrogen生物有限公司设计合成。si-1上游序列为5′-CCACACACCUUGCUUUCUUTT-3′,下游序列为5′-AAGAAAGCAAGGUGUGUGGTT-3′;si-2上游序列为5′-CCUUGUGACUUGGAGGAUUTT-3′下游序列为5′-AAUCCUCCAAGUCACAAGGTT-3′;si-3上游序列为5′-GGAGGUAAGCAAGUCAUAATT-3′,下游序列为5′-UUAUGACUUGCUUACCUCCTT-3′。取对数期生长细胞于转染前一天接种于6孔板中,按LipofectamineTM2000转染试剂盒要求配置siRNAs及脂质体稀释液,转染至细胞中。转染4~6 h后弃去无血清培养液,更换为含10%胎牛血清的RPMI-1640培养液。
2.3RT-qPCR 用TRIzol法提取细胞总RNA(Invitrogen),利用逆转录试剂盒逆转录为cDNA(Promega)。使用TaKaRa的TB GreenTMPremix Ex TaqTM,以cDNA为模板进行RT-qPCR,选择管家基因18sRNA作为内参照,计算lnc671相对表达量。lnc671上游引物序列为5′-GGAGCTGATCTAAGCACCAGA-3′,下游引物序列为5′-CAGGTGGGCGAGTCCTAGAG-3′;18sRNA上游引物序列为5′-CAGCCACCCGAGATTGAGCA-3′,下游引物序列为5′-TAGTAGCGACGGGCGGGTGT-3′。每个样本设置3个复孔。反应条件为95 ℃ 30 s;95℃ 5 s,60 ℃ 31 s,40个循环。
2.4细胞增殖实验 将转染siRNAs 36 h后的细胞用胰酶消化并计数,按每孔1 500~2 000个细胞接种于特制的E-Plate 96孔板内,使用xCELLigence Real-time Cell Analyzer(RTCA)-MP system(Acea Biosciences/Roche Applied Science)仪器实时检测细胞增殖情况,仪器可根据贴壁细胞对电阻的影响来检测细胞的增殖情况,每隔15 min记录1次,自动生成细胞的增殖曲线。
2.5细胞克隆形成实验 取转染36 h后的细胞用胰酶消化并计数,每孔800~1 000个细胞接种于6孔板中,于培养箱中培养10~15天后,弃掉旧培养液,用PBS洗2次,甲醇固定10 min,1%结晶紫染色10 min后洗净烘干并计算克隆形成的数目,每种细胞3个复孔。
2.6Transwell法细胞迁移和侵袭实验
2.6.1迁移实验 将转染36 h后的细胞使用胰酶消化离心,用无血清的RPMI-1640培养液重悬细胞计数,将(2~5)×104个细胞(200μL细胞悬液)加入Transwell上室,下室加入600 μL含30%血清的RPMI-1640培养液。细胞培养箱中培养18~24 h,弃去上室培养液后在甲醛中固定10 min,1%结晶紫染色10 min,清水洗净后使用棉棒轻轻擦拭小室内部,然后用正置显微镜拍照,计数每个小室的细胞数。
2.6.2侵袭实验 用无血清RPMI-1640培养液配成2%基质胶,每个上室加入100 μL,孵育4 h以上,后续实验与细胞迁移实验基本相同。
3 统计学处理
使用GraphPad Prism 7软件进行统计学分析,实验数据用均数±标准差(mean±SD)表示,组间采用t检验进行比较,以P<0.05为差异有统计学意义。
结 果
1 lnc671的表达水平和食管癌患者生存期的相关性
网络数据库GEPIA(www.gepia.cancer-pku.cn)分析显示,89例高表达lnc671的食管癌患者和67例低表达lnc671的食管癌患者比较,log-rank检验显示lnc671的高表达的食管癌患者的生存期要明显低于lnc671低表达组(P=0.01),Cox回归分析显示,lnc671的风险比(hazard ratio,HR)为2,见图1。
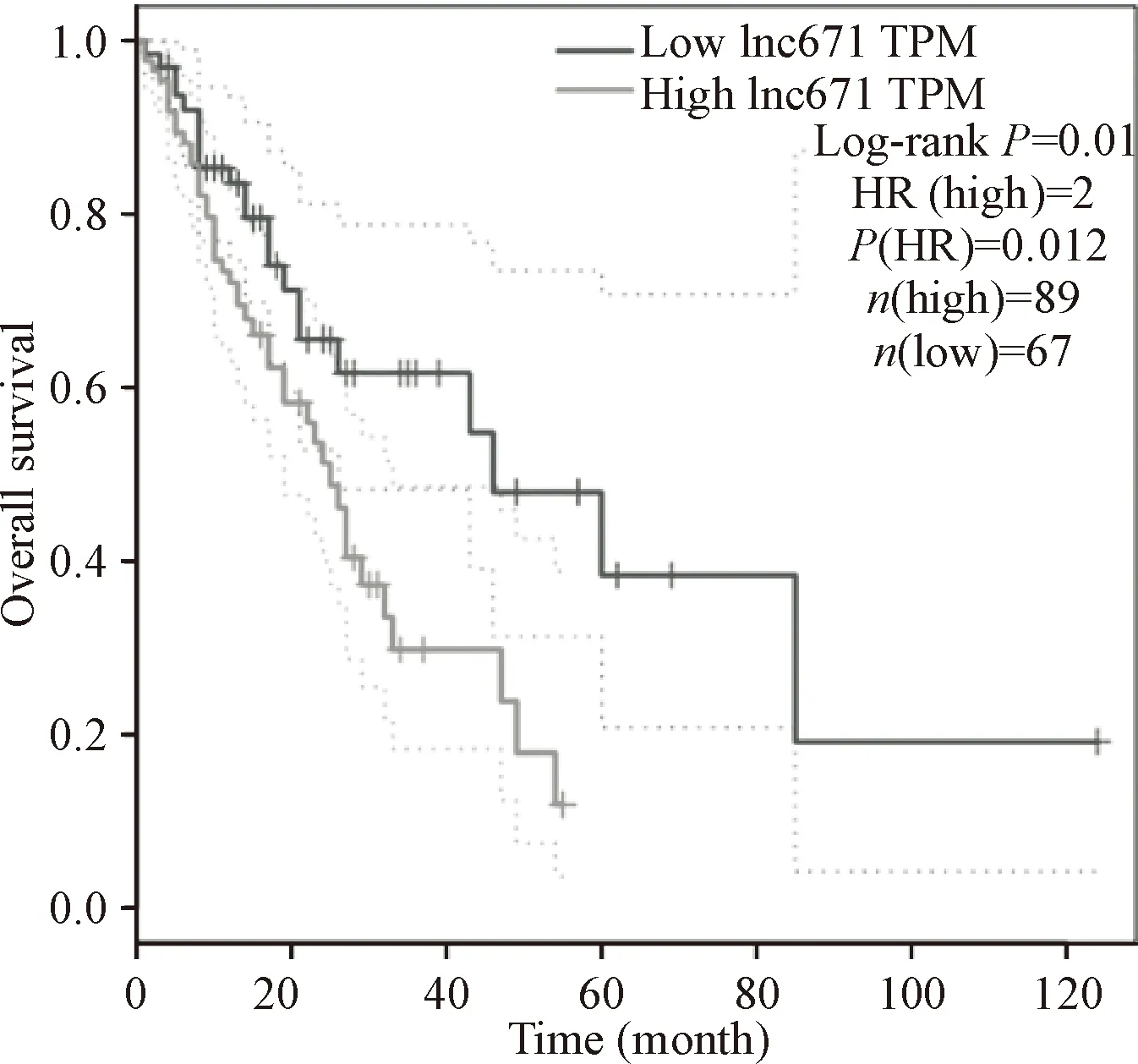
Figure 1.The relationship between the level of lnc671 expression and the survival of esophageal cancer patients.
图1 lnc671表达水平的高低与食管癌患者生存的关系
2 lnc671在食管鳞癌细胞中的表达情况
RT-qPCR检测结果显示,与正常的永生化食管上皮细胞NE3相比,lnc671在食管鳞癌细胞株KYSE140、KYSE70、KYSE450、KYSE150、YES2和KYSE180中表达水平显著上调,见图2。
3 siRNA抑制食管鳞癌细胞中lnc671的表达

Figure 2.Relative expression level of lnc671 in different esophageal squamous-cell carcinoma cells.
图2 lnc671在不同的食管鳞癌细胞中相对表达水平
为了研究lnc671在食管鳞癌中的功能,我们设计了3条siRNA序列干扰lnc671的表达,并选用lnc671相对表达比较高的2株食管鳞癌细胞KYSE70和KYSE450进行转染。在食管鳞癌细胞株KYSE70中,3条siRNAs均显著干扰了lnc671的表达(P<0.01);在KYSE450中,也得到了相似的结果,表明设计的siRNAs成功干扰了lnc671在食管鳞癌细胞中的表达,见图3。
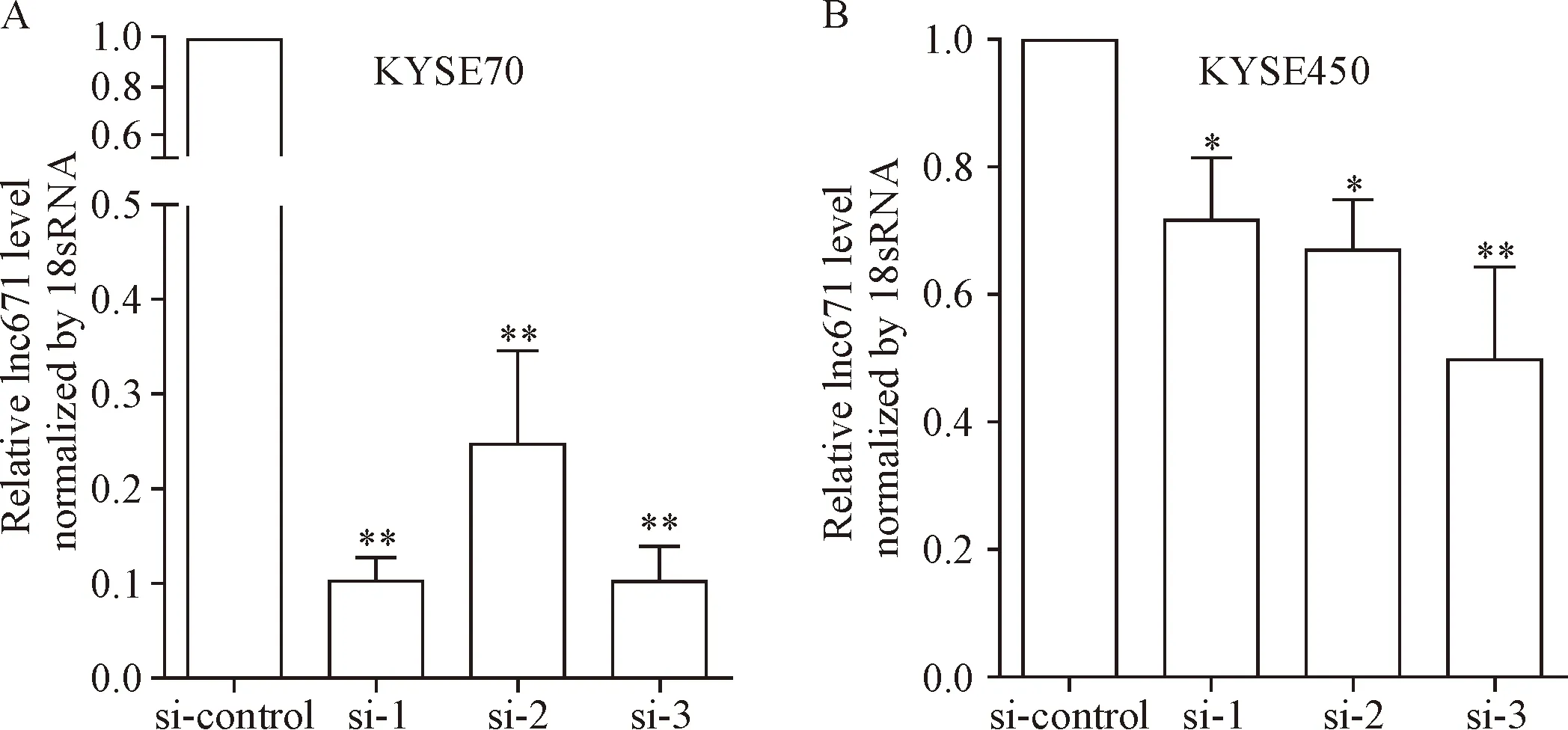
Figure 3.Detection of lnc671 knockdown efficiency by siRNA. Mean±SD.n=3.*P<0.05,**P<0.01vssi-control group.
图3 siRNA对lnc671干扰效率的检测
4 干扰lnc671的表达抑制食管鳞癌细胞的生长
在KYSE70和KYSE450细胞中分别转染si-control、si-2和si-3来干扰lnc671的表达,36 h后种入E-Plate 96孔板中,使用RTCA-MP实时检测细胞的生长情况,结果显示,与对照(si-control)组相比,干扰lnc671表达后的食管鳞癌细胞株KYSE70和KYSE450的生长能力受到了抑制,见图4。
5 干扰lnc671的表达抑制食管鳞癌细胞的集落形成能力
与对照组相比,干扰lnc671表达后的食管鳞癌细胞株KYSE70和KYSE450的集落形成数目明显减少(P<0.01),见图5。
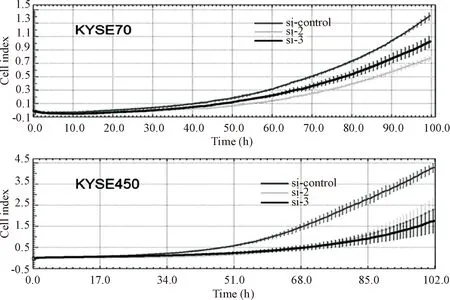
Figure 4.Effect of interference with lnc671 expression on growth of esophageal squamous-cell carcinoma cells.
图4 干扰lnc671表达后对食管鳞癌细胞生长的影响

Figure 5.Effect of lnc671 siRNAs on colony formation ability of esophageal squamous-cell carcinoma cells. Mean±SD.n=3.**P<0.01vssi-control group.
图5 干扰lnc671表达后对食管鳞癌细胞集落形成能力的影响
6 干扰lnc671的表达抑制食管鳞癌细胞的迁移和侵袭能力
使用siRNAs转染KYSE70和KYSE450 36 h后,接种于Transwell小室中,24 h后固定染色。结果观察到KYSE70和KYSE450的迁移和侵袭能力均受到了明显的抑制(P<0.05),见图6、7。
讨 论
食管癌是一种我国常见的消化道恶性肿瘤,其发病具有明显的地域分布特征[10]。食管癌具有恶性程度高,发病隐匿、进展快、预后差等特点,因此食管癌的早期诊断和治疗是亟待解决的难题。近年来,随着测序技术的发展,越来越多的长链非编码RNA被人们发现。lncRNA的主要功能是在表观遗传修饰、核内转运、转录及转录后等多个层面调控基因的表达[11],其表达异常与包括癌症在内的多种疾病相关。目前,在食管癌发生发展中能够发挥重要作用的lncRNA鲜有报道,本实验探讨了在食管鳞癌中高表达的lnc671对食管鳞癌细胞恶性表型的影响。

Figure 6.Effect of lnc671 siRNAs on invasion and migration of KYSE70 cells. The scale bar =200 μm. Mean±SD.n=3.*P<0.05,**P<0.01vssi-control group.
图6 干扰lnc671表达后对KYSE70细胞侵袭和迁移能力的影响

Figure 7.Effect of lnc671 siRNAs on invasion and migration of KYSE450 cells. The scale bar =200 μm. Mean ±SD.n=3.*P<0.05,**P<0.01vssi-control group.
图7 干扰lnc671表达后对KYSE450细胞侵袭和迁移能力的影响
研究发现,某些lncRNA在肿瘤组织中的表达水平会发生改变,而这种变化有可能作为肿瘤诊断以及预后判断的标志物,例如,非小细胞肺癌患者外周血中MALAT-1的表达水平显著高于健康人群[12],其检测灵敏度为56%,特异性为96%;前列腺癌是男性泌尿生殖系统最常见的恶性肿瘤之一,参与前列腺癌发生的 lncRNA主要代表为前列腺癌抗原3(PCA3)[13],PCA3在前列腺癌细胞中呈高表达状态,在正常前列腺以及良性前列腺增生细胞中几乎不表达,而在其他器官或肿瘤组织中不表达[14];其诊断前列腺癌的灵敏度、特异性和准确性显著,可作为诊断前列腺癌新的标志物[15]。本实验的研究对象lnc671表达水平的高低与食管癌患者的预后密切相关,而且在多种食管鳞癌细胞株中呈现出表达水平升高的情况,这些特征提示lnc671在指示患者预后以及作为癌症诊断标志物方面有着一定的潜力。
lncRNA在肿瘤的发生发展中起着重要的作用,其中,同源盒基因转录反义RNA是首个被发现的反义转录的长链非编码RNA[16],可结合多梳蛋白抑制复合体2(Polycomb repressive complex 2,PRC2),导致H3组蛋白第27位赖氨酸(H3K27)甲基化,使PRC2相关的基因重新定位,从而促进了肿瘤的侵袭和转移[17-18]。结肠癌相关转录因子1(colon cancer associated transcript 1, CCAT1)是Nissan等[19]在结肠癌中发现的一种lncRNA,研究显示,CCAT1的表达水平的高低与结直肠癌患者的生存长短,结直肠肿瘤大小和肿瘤浸润深浅密切相关[20-21],另外,CCAT1在包括胃癌[22],肝癌[23],肺癌[24]和乳腺癌[25]等多种恶性肿瘤中表达水平显著升高,并且与肿瘤生长和分期、淋巴结转移及预后密切相关。在本研究中,我们设计了siRNAs来干扰lnc671的表达。实验证实,干扰lnc671的表达可以抑制食管鳞癌细胞KYSE70和KYSE450的增殖、侵袭和迁移能力。

