黄芪甲苷对EPCs中SDF-1α/CXCR4的调控作用*
杨 雷, 刘 萍, 刘 暖, 陶玲玲, 李 星, 毛秉豫
(南阳理工学院河南省张仲景方药与免疫调节重点实验室, 张仲景国医国药学院, 河南 南阳 473004)
心肌梗死是心脏冠状动脉的血流中断造成心肌的缺血缺氧坏死,坏死的心肌组织被致密的纤维疤痕所取代,不仅造成心脏收缩功能的严重下降,还严重影响心肌的电生理活动,可能引发致死性的心律失常。心肌梗死后缺血心肌组织血运的重建十分困难,外源性内皮祖细胞(endothelial progenitor cells,EPCs)的移植和内源性EPCs的募集被认为是解决这一难题的理想手段之一[1-2]。而EPCs表面可以表达CXC趋化因子受体4(CXC chemokine receptor 4,CXCR4),CXCR4和基质细胞衍生因子1α(stromal cell-derived factor 1α,SDF-1α)一起构成特异性的SDF-1α/CXCR4轴,通过募集EPCs在心肌梗死后血管新生和心肌修复的进程中发挥着重要的作用[3-4]。AMD3100是CXCR4的特异性阻断剂,通过竞争SDF-1α与CXCR4的结合位点阻断SDF-1α结合CXCR4,从而阻断SDF-1α/CXCR4轴的生理功能[4]。
黄芪甲苷(astragaloside IV,AS-IV)是中药黄芪的有效成分之一,黄芪通常用于预防和治疗心脑血管疾病、免疫紊乱、肺纤维化、肝癌、糖尿病和肾脏疾病,并具有减少衰老的作用[1-2]。AS-IV可抑制血小板聚集,并促进前列环素和一氧化氮的释放,从而发挥其抗血栓形成的作用[5-6]。AS-IV还具有增加大鼠缺血心脏的微血管密度的作用[5-7]。然而AS-IV对SDF-1α/CXCR4的作用目前研究不多。本研究拟探讨AS-IV对EPCs中SDF-1α/CXCR4的调控作用,为心肌梗死等缺血性心肌疾病的治疗提供新的策略。
材 料 和 方 法
1 实验动物、仪器、药物与试剂
SPF级Wistar大鼠购自北京维通利华实验动物技术有限公司,8周龄,重约200~220 g,动物生产许可证号为SCXK(京)2016-0011。所有动物在标准饲养的环境下饲喂食物和饮水,并在南阳理工实验动物伦理委员会监控下进行。
FACSCanto II型流式细胞仪(BD);Bullet Blen-der Storm组织细胞破碎仪(Next Advance);TiS型倒置荧光显微镜及NIS-Elements Software BR分析系统(Nikon)。
AS-IV和抗BrdU抗体(上海宝曼公司);EBM-2培养基(北京达科为公司);Ficoll细胞分离液,抗SDF-1α、CXCR4和p-CXCR4抗体,AMD3100(Santa Cruz);抗CD133、CD34和VEGFR-2抗体(Affinity)。
2 方法
2.1EPCs的体外分离、培养和鉴定 应用EBM-2培养基分别冲洗大鼠肱骨、股骨和胫骨的骨髓腔3~5次,应用Ficoll细胞分离液,采用密度梯度离心法获得EPCs单核细胞。用添加了5%胎牛血清的EBM-2培养基将分离后的细胞重悬,按照5×104/cm2的密度接种于25 cm2的培养瓶中。选取培养7 d的细胞,弃去非贴壁细胞,制备密度为1×1010/L的细胞悬液,分别加入兔抗大鼠CD133、CD34和VEGFR-2抗体,避光条件下应用流式细胞仪检测各组阳性细胞所占比例。
2.2EPCs增殖的检测 将EPCs用EBM-2基础培养基重悬,调至每孔1×104个的密度加入96孔培养板中。实验分4个组:空白对照(control)组(不加药物)、AS-IV(20 g/L)组、AMD3100-AS-IV组(5 mg/L AMD3100+20 g/L AS-IV,先加入AMD3100作用1 h后,再加入AS-IV,下同)和AMD3100(5 mg/L)组。每组设置3个复孔,实验重复3次。培养24 h后,加入1 ∶100稀释的BrdU鼠单克隆抗体(每孔100 μL),室温孵育1 h,PBS冲洗2次,加入1 ∶2 000稀释的辣根过氧化物酶标记的羊抗小鼠IgG孵育1 h,PBS再次冲洗2次,加入100 μL的TMB过氧化物酶底物避光孵育30 min,加入100 μL终止液,450 nm波长处读取各孔吸光度(A)值。
2.3EPCs黏附的检测 将EBM-2的基础培养基重悬的EPCs细胞以每孔1×104个接种于铺有人工基底膜的96孔培养板中,实验分组同2.2。37 ℃、5% CO2培养箱中培养6 h后,弃去未黏附于基底膜上的细胞,每孔加入5 g/L的MTT溶液10 μL,避光孵育4 h,加入150 μL DMSO终止培养,568 nm波长处读取各孔吸光度(A568) 值。
2.4EPCs迁移能力的检测 应用24孔的Transwell小室(滤膜直径为6.5 mm,孔径8.0 μm)进行检测。EBM-2培养基将EPCs调至密度为5×107/L,实验分组同2.2。每孔上室接种200 μL细胞悬液,下室加入500 μL含药或者空白对照的EGM-2培养基,37 ℃下孵育12 h,用棉签擦去上室的非迁移细胞,将迁移过膜的细胞用2%多聚甲醛固定30 min,0.1%的结晶紫染色,400倍倒置显微镜下随机取5个视野,计数迁移过膜的细胞数量,取其平均值。
2.5EPCs管状结构形成能力的检测 将EPCs用EBM-2培养基重悬,每孔5×104个加入Matrigel预处理的24孔板中,实验分组同2.2。培养72 h后,400×倒置显微镜下观察形成的管状结构数量,随机选择5个视野计数,取其平均值。
2.6氧糖剥夺(oxygen-glucose deprivation,OGD)-复氧下EPCs凋亡的检测 EPCs细胞以每孔5×104个接种在24孔板中,用20 g/L 的AS-IV预处理2 h后,暴露于缺氧缺糖条件下培养1 h,然后在含有95%空气和 5% CO2的复氧条件下继续培养1 h。实验分control组、OGD组、AS-IV组、AMD3100-AS-IV组和AMD3100组。前2个组不加药物,仅加入等量的培养基;AS-IV和AMD3100的剂量和用法同前。72 h后,弃去培养液,0.1%胰蛋白酶消化后加入4%的多聚甲醛固定25 min,滴加100 μL蛋白酶K(20 mg/L)溶液,孵育20 min。根据TUNEL试剂盒说明书染色标记,DAPI复染,用含荧光淬灭剂的封片液封片,400×倒置荧光显微镜下分析凋亡细胞的数量,随机选择5个视野计数,取其平均值。
2.7EPCs中SDF-1α/CXCR4的mRNA表达检测 TRIzol法提取总RNA,设计SDF-1α的上游引物为5′-TCTTTGGCCTCCTGTAGAATGG-3′,下游引物序列为5′-TCACGGCAAGATTCTGGCTTA-3′,产物长度为240 bp;CXCR4的上游引物为5′-CGTGAATGAGTGTCTAGGCAGG-3′,下游引物序列为5′-GGCTTTGGTTTTAAGTGCCATC-3′,产物长度为177 bp;β-actin的上、下游引物为5′-AGACCTTCAACACCCCAG-3′和5′-CACGATTTCCCTCTCAGC-3′,产物长度为94 bp。实验分组同2.2。每组细胞取2 μg总RNA,根据试剂盒的说明书逆转录合成cDNA,以cDNA为模板普通PCR扩增,取10 μg扩增产物1%琼脂糖凝胶电泳,AlphaView SA软件摄图并分析SDF-1α/CXCR4与β-actin的灰度比值。
2.8EPCs中SDF-1α/CXCR4和p-CXCR4蛋白水平的检测 实验分组同2.2。应用Next Advance Bullet Blender Storm细胞破碎仪将EPCs打碎,匀浆,4 ℃下12 000×g离心2 min,提取组织总蛋白后Bradford法测浓度,取20 μg进行SDS-PAGE,转移至硝酸纤维素膜上,5%脱脂奶粉封闭2 h后洗膜,标记1 ∶ 200稀释的抗SDF-1α、CXCR4、p-CXCR4和β-actin抗体,4 ℃过夜,洗膜,与辣根过氧化物酶标记的羊抗兔IgG(1 ∶ 2 000)孵育1 h后TBST洗膜,暗室曝光显影。分析并记录各样本与β-actin灰度比值。
3 统计学处理
采用SPSS 16.0软件,计量资料以均数±标准差(mean±SD)表示,多组间均数比较用单因素方差分析,组间多重比较用LSD-t检验,以P<0.05为差异有统计学意义。
结 果
1 EPCs的鉴定
培养7 d的EPCs用流式细胞术分别鉴定细胞表型,EPCs表面抗原CD34、CD133和VEGFR-2表达率分别为39.51%、23.75%和17.75%,符合EPCs特征,见图1。
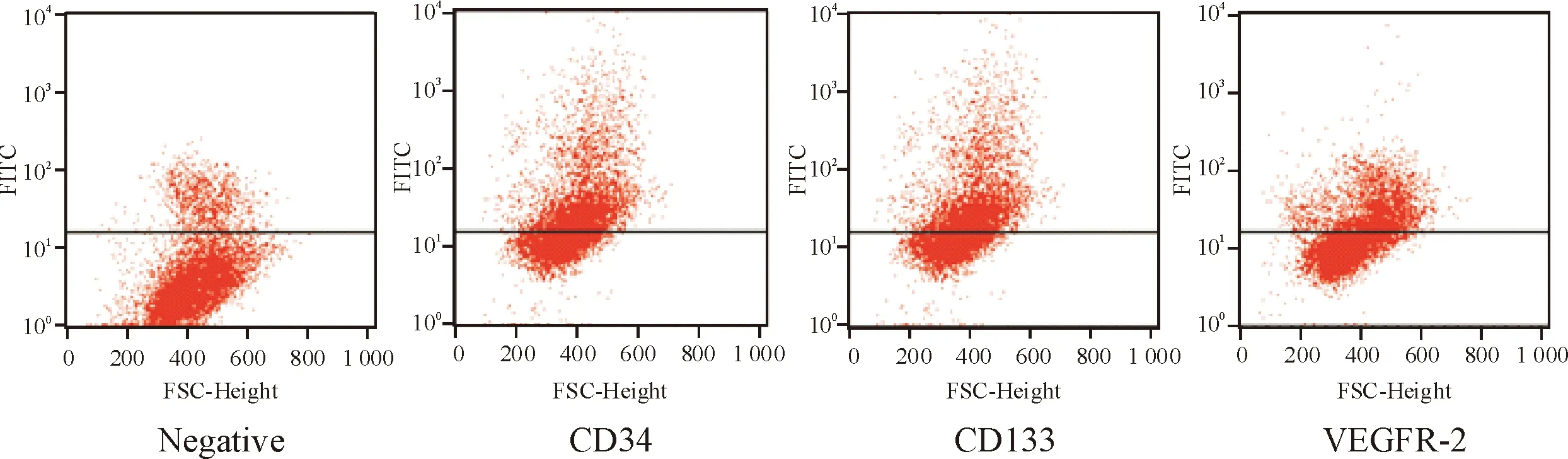
Figure 1.Detection of CD34, CD133 and VEGFR-2 expression on EPCs by flow cytometry.
图1 流式细胞术检测分析EPCs的表面抗原CD34、CD133和VEGFR-2表达率
2 AS-IV对EPCs的增殖、黏附和迁移能力的影响
和control组相比,AS-IV组EPCs细胞的增殖、黏附和迁移能力显著升高(P<0.01);和AS-IV组相比,AMD3100-AS-IV组和AMD3100组EPCs的增殖、黏附和迁移能力显著下降(P<0.01),见图2、3。这表明,AS-IV可以提升EPCs的增殖、黏附和迁移能力,但这一作用能够被AMD3100阻断。
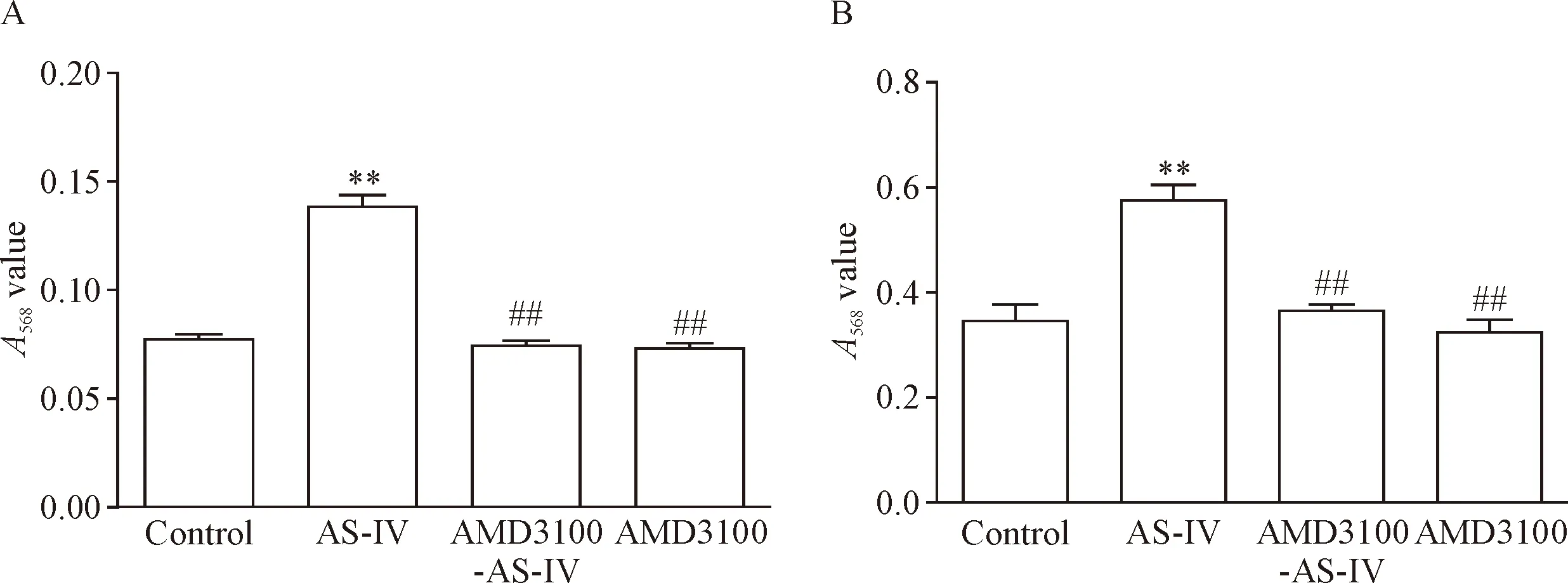
Figure 2.The effect of AS-IV on the abilities of adhension and proliferation of the EPCs in each group. A: the adhension assay; B: the proliferation assay. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsAS-IV group.
图2 AS-IV对EPCs黏附和增殖能力的影响

Figure 3.The effect of AS-IV on the migration ability of EPCs in each group. The scale bar = 40 μm. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsAS-IV group.
图3 AS-IV对EPCs迁移能力的影响
3 AS-IV对EPCs管状结构形成能力的影响
和control组相比,AS-IV组形成管腔样结构的结点数量更多,管腔长度更长(P<0.01);和AS-IV组相比,AMD3100-AS-IV组和AMD3100组EPCs的管腔结点数量、管腔长度明显下降(P<0.01),见图4。这表明AS-IV可以提升EPCs的成管能力,而AMD3100可以阻断这一作用。
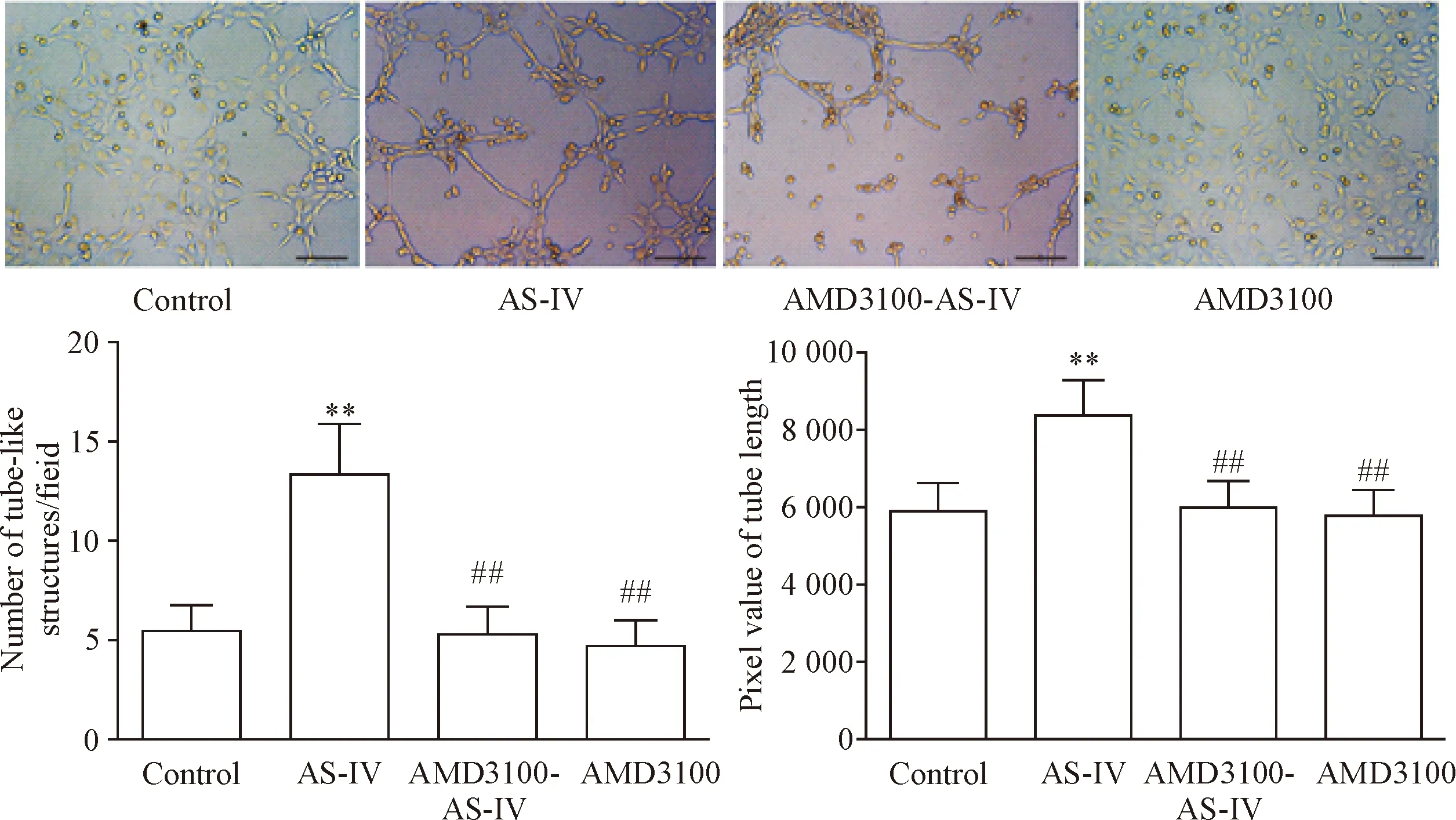
Figure 4.The effect of AS-IV on the number of tube-like structures and value of tuber length of the EPCs in each group. The scale bar=40 μm. Means±SD.n=3.**P<0.01vscontrol;##P<0.01vsAS-IV group.
图4 AS-IV对EPCs管状结构形成能力的影响
4 AS-IV对OGD-复氧下EPCs凋亡的影响
和control组相比,OGD-复氧下EPCs的凋亡细胞数量显著升高(P<0.01);和OGD组相比,AS-IV组EPCs细胞的凋亡数量显著下降(P<0.01);和AS-IV组相比,AMD3100和AMD3100-AS-IV组EPCs的凋亡细胞数量再次显著升高(P<0.01),见图5。这表明AS-IV可以抑制EPCs的凋亡,而AMD3100可以阻断这一效应。
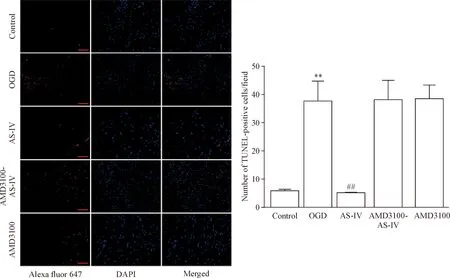
Figure 5.The effect of AS-IV on the number of TUNEL-positive EPCs in each group. The scale bar = 40 μm. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsOGD group;△△P<0.01vsAS-IV group.
图5 AS-IV对EPCs凋亡细胞数量的影响
5 AS-IV对EPCs中SDF-1α、CXCR4表达和p-CXCR4蛋白水平的影响
和control组相比,AS-IV组EPCs中SDF-1α和CXCR4的mRNA和蛋白水平及p-CXCR4蛋白水平均显著升高(P<0.01);和AS-IV组相比,AMD3100-AS-IV组EPCs中CXCR4的mRNA和蛋白及p-CXCR4蛋白水平均显著下降(P<0.01),但SDF-1α的mRNA和蛋白表达并不下降;而AMD3100组EPCs中SDF-1α和CXCR4的mRNA和蛋白及p-CXCR4蛋白水平均较AS-IV组显著下降(P<0.01),接近于control组,见图6、7。这表明AS-IV具有上调EPCs中SDF-1α和CXCR4表达的作用,并上调p-CXCR4蛋白的水平,AMD3100可以显著抑制AS-IV对CXCR4表达的上调作用,但不能抑制AS-IV对SDF-1α表达的上调作用。
讨 论
心肌梗死等缺血性心肌疾病会导致内源性EPCs的募集困难,数量减少和功能下降,影响受损心肌组织的修复[8],因此,恢复和增强EPCs的数量及功能十分重要,这也为缺血性心肌疾病的治疗提供了新的思路和方法。基于此,我们探讨了AS-IV对EPCs的调控作用及其作用机制。
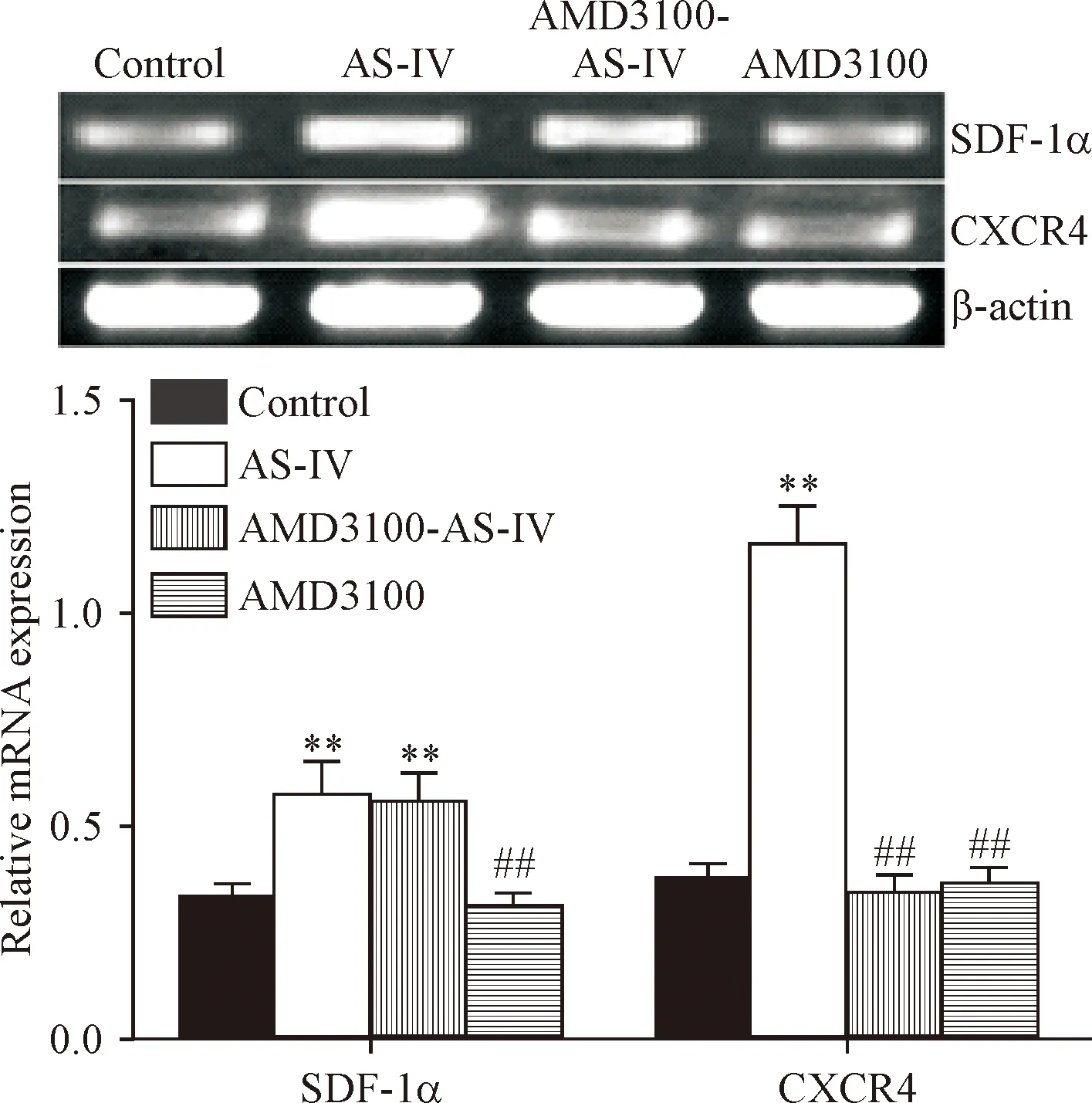
Figure 6.The effect of AS-IV on the mRNA expression of SDF-1α and CXCR4 in the EPCs of each group. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsAS-IV group.
图6 AS-IV对EPCs中SDF-1α和CXCR4 mRNA表达的影响
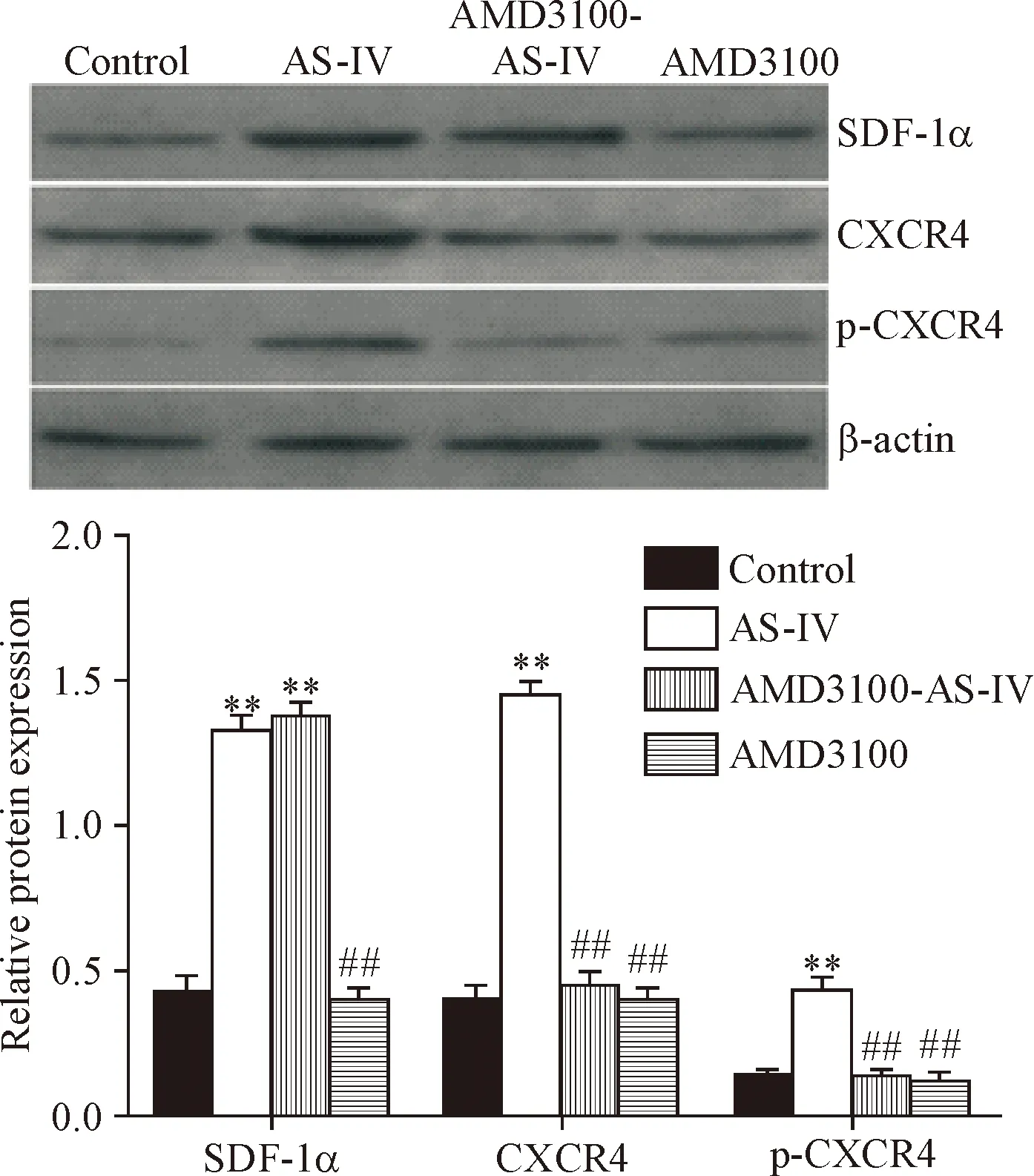
Figure 7.The effect of AS-IV on the protein levels of SDF-1α, CXCR4 and p-CXCR4 in the EPCs of each group. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsAS-IV group.
图7 AS-IV对EPCs中SDF-1α、CXCR4和p-CXCR4蛋白水平的影响
本研究中,为确保研究的可信程度,我们首先应用特异的兔抗大鼠CD133、CD34和VEGFR-2抗体对分离的EPCs进行了鉴定,结果表明提取分离的细胞具备经典的EPCs细胞标志物特征,符合实验要求。
课题组之前的研究表明,黄芪提取物可以显著上调EPCs的数量、黏附和迁移能力,增强EPCs的成管能力[1]。本研究中,我们发现AS-IV也有相似的作用,这和前期的实验结果相一致。并发现AS-IV还具有抑制OGD-复氧环境下所引发的EPCs凋亡的作用。我们应用Western blot法进一步分析了AS-IV对EPCs中SDF-1α和CXCR4蛋白表达的作用,发现AS-IV可以上调EPCs中SDF-1α和CXCR4蛋白的表达,并同时上调p-CXCR4的蛋白水平,而p-CXCR4是CXCR4的活化状态,这表明AS-IV可以上调SDF-1α和CXCR4的水平,进而可能影响SDF-1α/CXCR4信号通路调控EPCs的募集。研究还发现,应用AMD3100后并不能阻断AS-IV对于SDF-1α诱导的过表达状态,但是能够阻断AS-IV对CXCR4表达的上调作用,这可能是AMD3100的作用位点主要是CXCR4,而不是SDF-1α,因此并不影响SDF-1α的表达。同时,AMD3100对于CXCR4的可能作用,一方面是由于封闭了CXCR4活化的作用位点[3],影响SDF-1α/CXCR4信号通路的激活;另一方面,AMD3100的阻断使CXCR4处在低能量失活的构象状态[3],AS-IV无法诱导活化CXCR4,促使其表达上调。这表明,AS-IV增强EPCs的生物学功能可能和其对SDF-1α/CXCR4的调控密切相关。
EPCs是一类特异性归巢损伤区域并能分化为成熟内皮细胞的一类干/祖细胞,不仅在体外可以被诱导分化成内皮细胞,而且在心肌梗死动物模型中被发现其参与血管生成,修复缺血受损的心肌组织,但产生这一作用的前提是EPCs被募集至受损部位。EPCs被募集的进程需要血管管腔的输送,并且能够透过管腔迁移至损伤组织[9-10]。在稳态生理条件下,EPCs基本处在静止的状态,而且,EPCs也不易穿过正常生理状态下的血管壁进入血管腔内[9-10]。心肌梗死后引发心肌组织缺血缺氧并产生炎症等病理反应,激活SDF-1α/CXCR4等趋化因子,并激活选择素和整合素等细胞黏附分子[4, 9-10]。同时,上述病理反应还可激活TGF-β、IL-1等炎症因子,破坏血管基膜的完整性,导致血管内皮细胞间隙增大、通透性增强[9]。细胞黏附分子和炎症因子对接之后,介导EPCs与内皮细胞紧密黏附、循环滚动,经损伤和通透性增强的毛细血管输送至损伤的心肌组织中[4, 9-10]。同时,SDF-1α/CXCR4可以上调局部损伤心肌组织中内皮细胞E-选择素的表达,并诱导EPCs表达E-选择素配体,通过旁分泌或者内分泌途径募集更多的EPCs到损伤部位,从而增强EPCs对缺血创伤组织的选择性归巢,诱导EPCs分化为血管内皮细胞,进而形成新生的毛细血管,促进受损心肌组织的修复[11-12]。
也有研究证实,在局部伤口组织中生成或聚集的SDF-1α/CXCR4在参与局部损伤部位和损伤组织周围的动态促血管生成进程的协调中起着关键作用[13]。同时,有研究表明,骨髓源性EPCs在SDF-1α/CXCR4的作用下可被诱导分化成新生毛细血管,丰富了兔缺血后肢的微循环血运,增强了缺血损伤后肢的功能[14]。这表明,基于SDF-1α/CXCR4作用靶点可能是EPCs等干细胞归巢缺血损伤组织治疗心肌梗死等心血管系统疾病的重要治疗方式之一。SDF-1α结合CXCR4后可激活下游的PKC信号通路[15],而PKD1又是PKC信号通路激活后的关键效应蛋白之一,PKD1可以促进EPCs的增殖、黏附、迁移和血管形成能力[2],并且有明确的促血管新生修复缺血心肌组织的能力[2, 7]。我们前期实验也证实,黄芪提取物具有促EPCs迁移、运动和成管作用[1],结合本研究结果,我们推断AS-IV很可能是通过调控SDF-1α/CXCR4这一信号通路而抑制EPCs的凋亡,促进EPCs的增殖、黏附、迁移,上调EPCs的血管形成能力。这丰富了中药黄芪治疗心肌梗死等循环系统疾病的作用机理,为推动中药黄芪的现代化提供了部分实验支撑依据。

