miR-204通过靶向Sirt1/p53信号通路抑制霍奇金淋巴瘤细胞增殖*
郑晓强, 芮红兵, 张光辉
(福建医科大学附属第一医院血液风湿科, 福建 福州 350000)
霍奇金淋巴瘤(Hodgkin lymphoma,HL)是一种常见的淋巴系恶性疾病,也称为霍奇金病或淋巴肉芽肿病。霍奇金淋巴瘤的发病率呈现双峰曲线,多见于年轻人(15~35岁)和年龄超过55岁的老年人,且男性比例多于女性[1]。虽然中国的霍奇金淋巴瘤的发病率显著低于欧美国家,但随着生活饮食习惯的改变,近年来发病率有增加的趋势[2-3]。
微小RNA(microRNA,miRNAs,miR)是一类由18~25个核苷酸组成的短链非编码RNA,通过与目标mRNA分子的3’端非翻译区域(3’-untranslated region,3’-UTR)完全或非完全互补匹配、参与基因转录后蛋白表达水平的调控,在生物体内发挥十分重要的作用[4]。miR-204在胃癌、结肠癌和急性白血病等多种肿瘤组织中的低表达,且与肿瘤细胞的增殖、迁移、侵袭、化疗抵抗以及不良预后等方面密切相关[5-7]。但是miR-204在霍奇金淋巴瘤中的研究尚少,因此,本研究观察miR-204对霍奇金淋巴瘤L428细胞增殖的影响,并探讨其可能的机制。
材 料 和 方 法
1 患者资料
收集2015年1月1日~2017年12月30日福建医科大学附属第一医院病理切除的30例霍奇金淋巴瘤患者病灶淋巴瘤组织和配对癌旁淋巴组织(距离肿瘤侵润边缘2.5 cm),同时收集同期穿刺活检的30例颈部淋巴结肿大患者的淋巴组织。这些霍奇金淋巴瘤患者的年龄为25~61岁,平均年龄(42.3±8.9)岁;患者未进行过化疗,均是首次确诊;表现为颈部淋巴结肿大和纵隔淋巴结肿大;淋巴瘤分型:13例混合细胞型,15例结节硬化型,1例富于淋巴细胞型,1例淋巴细胞消减型;临床分期(Ann Arbor 分期):16例Ⅰ~Ⅱ期,14例Ⅲ~Ⅳ期。配对癌旁淋巴组织经病理科检验为正常淋巴组织。穿刺活检的30例颈部淋巴结肿大患者:年龄为28~57岁,平均年龄(40.6±9.3)岁,其中淋巴组织经病理科检验为炎性病变的淋巴组织。本研究通过本院伦理委员会以及患者本人同意。
2 实验试剂
胎牛血清、RPMI-1640培养基和Opti-MEM培养基购自Gibco;CCK-8细胞计数试剂盒和BCA蛋白定量试剂盒购自江苏碧云天生物技术有限公司;BrdU细胞增殖检测试剂盒购自北京中昊生物科技公司;LipofectamineTM2000转染试剂购自Invitrogen;miR-204 mimic与和配对阴性对照(NC mimic)购自Ambion;Sirt1siRNA和配对阴性对照siRNA(NC siRNA)购自CST;Sirt1过表达质粒(pcDNA3.1-Sirt1)由上海吉玛公司构建;野生型Sirt1萤光素酶报告载体和突变型Sirt1萤光素酶报告载体由赛业生物科技有限公司构建;TaqMan MicroRNA逆转录试剂盒和TaqMan MicroRNA分析试剂盒购自Qiagen;双萤光素酶报告基因检测试剂盒购自Promega;抗 Sirt1、p53、乙酰化p53(acetylated p53,ac-p53)和β-actin抗体购自Sigma。
3 实验方法
3.1细胞培养 L428细胞株由美国布拉斯加州医学中心Chan教授馈赠。细胞培养于含有10%胎牛血清的RPMI-1640培养基中,至于37 ℃、5% CO2的细胞培养箱中培养。每3 d更换含有10%胎牛血清的新鲜培养基1次,1周传代1次。待细胞再次处于对数期时,收集细胞,用于后续实验。
3.2细胞分组 L428细胞分为对照组(control组,不进行转染)、NC mimic转染组、miR-204 mimic转染组、NC siRNA转染组、Sirt1siRNA转染组和共转染组(miR-204 mimic和pcDNA3.1-Sirt1共转染)。
3.3瞬时转染 根据厂商说明书采用LipofectamineTM2000转染试剂辅助细胞转染miR-204 mimic、Sirt1siRNA和pcDNA3.1-Sirt1。转染前 1 d用胰酶消化L428细胞,计数,按照5×107/L的密度接种于6孔板中。次日,用无血清Opti-MEM培养液稀释LipofectamineTM2000转染试剂,混匀,并分别加入NC mimic、miR-204 mimic、NC siRNA和Sirt1siRNA中,再次混匀并室温孵育20 min。将混合物分别加入细胞中,并于37 ℃,5% CO2的细胞培养箱培养孵育6 h后,更换含有10%胎牛血清的RPMI-1640培养基继续培养24 h。对于共转染,取已转染miR-204 mimic的细胞,再次转入pcDNA3.1-Sirt1后,更换含有10%胎牛血清的RPMI-1640培养基继续培养24 h。经过RT-qPCR和Western blot鉴定转染效率后,已转染的细胞用于后续实验。
3.4CCK-8法检测细胞活力 在96孔板中接种转染后的L428细胞,细胞密度为每孔1×104个,将培养板至于培养箱中分别培养0、12、24和48 h。每个时点加入10 μL CCK-8溶液,37 ℃孵育2 h,弃去培养液,用酶标仪测定在450 nm波长处的吸光度(A)值。
3.5BrdU检测细胞增殖 在96孔板中接种转染后的L428细胞,细胞密度为每孔1×104个,将培养板至于培养箱中分别培养0、12、24和48 h。每个时点首先加入10 μL BrdU标记结合试剂,37 ℃孵育2 h,弃去培养液;其次加入100 μL FixDenat 试剂37 ℃孵育30 min,弃去 FixDenat 试剂;再次加入抗BrdU-POD试剂37 ℃孵育1 h,加入底物反应液37 ℃孵育15 min;PBS洗涤2次,最后加入终止反应液停止反应。用酶标仪测定在450 nm波长处的(A)值。
3.6RT-qPCR实验 对于组织采用 RNAiso Plus试剂按照说明书步骤提取组织的总RNA。对于细胞采用Trizol试剂按照说明书步骤提取细胞的总RNA。对于miR-204逆转录,取2 μg组织或细胞的总RNA按照TaqMan MicroRNA逆转录试剂盒说明书步骤逆转录为cDNA;取2 μL cDNA和各4 μL正反引物序列,按照TaqMan MicroRNA分析试剂盒说明书步骤利用ABI PRISM 7500 PCR仪进行RT-qPCR反应。对于组织Sirt1逆转录,取2 μg组织的总RNA按照ReverseAid 逆转录试剂盒说明书步骤逆转录为cDNA;取2 μL cDNA和各4 μL正反引物序列,按照SuperReal PreMix分析试剂盒说明书步骤利用7500 Fast Real-time PCR仪进行RT-qPCR反应。miR-204 的正向引物序列为5’-TTCCCTTTGTCATCCTATGTGCCT-3’, 反向引物序列为 5’-GTGCAGGGTCCGA GGT-3’; U6的正向引物序列为5’-GCTTCGGCAGCACATATACTAAAAT-3’,反向引物序列为5’-CGCTTCAGAATTTGCGTGTCAT-3’; Sirt1的正向引物序列为5’-TCG CAACTATACCCAGAACATAGACA-3’, 反向引物序列为5’-CTGTTGCAAAGGA ACCATGACA-3’;GAPDH的正向引物序列为5’-CACCCACTCCTCCACCTTTG-3’,反向引物序列为5’-CCACCACCCTGTTGCTGTAG-3’。反应条件为:94 ℃预变性30 min;然后进行40个循环(95 ℃ 5 s、60 ℃ 30 s、74 ℃ 30 s)。以U6作为miR-204的内参照,以GAPDH作为Sirt1的内参照,采用2-ΔΔCt法计算miR-204和Sirt1 mRNA的相对表达量。
3.7萤光素酶活性检测 依据双萤光素酶报告基因检测试剂盒说明书检测萤光素酶活性。将miR-204 mimic与野生型Sirt1萤光素酶报告载体和突变型Sirt1萤光素酶报告载体采用LipofectamineTM2000转染试剂辅助共转染到HEK-293T 细胞中,转染48 h后,PBS洗涤1次,每孔细胞加入100 μL裂解液,室温振摇15 min,收集细胞裂解液。取20 μL细胞裂解液与10 μL萤光素酶检测试剂快速混匀后,用生物发光检测仪检测萤光信号;读值完毕后,每样品再加入100 μL Stop & Glo® Reagent,快速混匀后,检测萤光信号,保存数据。
3.8Western blot法检测蛋白表达水平 组织经过匀浆后和已处理的细胞分别加入RIPA裂解液冰上裂解30 min,4 ℃,12 000×g离心20 min,弃沉淀,用BCA法检测上清液中蛋白浓度。用PBS调整蛋白浓度为5 g/L,每孔加入5 μL样品,同时加入5 μL 5×上样缓冲液,100 ℃变性5 min后,进行SDS-PAGE。电泳结束后用300 mA电流将蛋白转移至PVDF膜上,在5%脱脂奶粉中封闭1 h,加入I 抗Sirt1(1 ∶2 000稀释)、p53(1 ∶5 000稀释)、ac-p53(1 ∶1 000稀释)和β-actin(1 ∶1 000稀释),4 ℃孵育过夜,TBST洗膜3次,每次10 min;再加入对应的II 抗(1 ∶4 000稀释),37 ℃孵育1 h,TBST洗3次,每次10 min;在暗室中浸入ECL液显色,进行胶片曝光。以β-actin作为目的条带的内参照,采用Quantity One软件分析蛋白条带的相对表达量。目的蛋白的相对表达量=目的条带灰度值/β-actin条带灰度值。
4 统计学分析
采用SPSS 17.0统计软件对数据结果进行分析, 霍奇金淋巴瘤患者的临床数据呈偏态分布,实验数据采用中位数表示,多组间数据两两比较用Kruskal-WallisH检验。其余数据符合正态分布,实验数据采用均数±标准误(mean±SEM)表示,多组间定量资料数据方差齐,两两比较用Bonferroni法;以P<0.05表示差异具有统计学意义。
结 果
1 霍奇金淋巴瘤组织中miR-204低表达,Sirt1 mRNA高表达
采用RT-qPCR法检测了霍奇金淋巴瘤组织、配对癌旁淋巴组织和其它疾病淋巴结肿大的炎性病变的淋巴组织中miR-204表达,发现miR-204在霍奇金淋巴瘤组织中低表达(P<0.01),见图1A;同时,对上述组织中Sirt1表达进行了检测,发现Sirt1 mRNA在霍奇金淋巴瘤组织中高表达(P<0.01),见图1B。这提示miR-204和Sirt1可能在霍奇金淋巴瘤病变中发挥作用。
2 上调miR-204表达抑制L428细胞增殖
通过转染miR-204 mimic,上调L428细胞的miR-204表达,见图2A。进一步分别通过CCK-8法和BrdU法检测上调miR-204表达对L428细胞活力和BrdU掺入量的影响,结果如图显示,与control组或NC mimic转染组相比,miR-204 mimic转染组L428细胞在各时点的细胞活力降低,BrdU掺入量下降(P<0.05);与control组相比,NC mimic转染组L428细胞细胞活力和BrdU掺入量无显著变化(P>0.05),见图2B、C。这提示上调miR-204表达抑制L428细胞增殖。
3 Sirt1是miR-204的靶基因
在线生物学软件预测miR-204与Sirt1 3’ UTR存在相互结合位点,见图3A。通过野生型Sirt1萤光素酶报告载体或突变型Sirt1萤光素酶报告载体与miR-204 mimic共转染,运用双萤光素酶报告基因活性检测技术检测miR-204与Sirt1的相互作用,结果显示,与NC mimic转染组相比,共转染miR-204 mimic+野生型Sirt1萤光素酶报告载体组萤光素酶活性明显下降(P<0.05),而共转染miR-204 mimic+突变型Sirt1萤光素酶报告载体组萤光素酶活性无显著变化(P>0.05),见图3B。进一步研究发现,转染miR-204 mimic能抑制Sirt1的蛋白表达(P<0.05),见图3C。上述结果提示miR-204抑制靶基因Sirt1的表达。
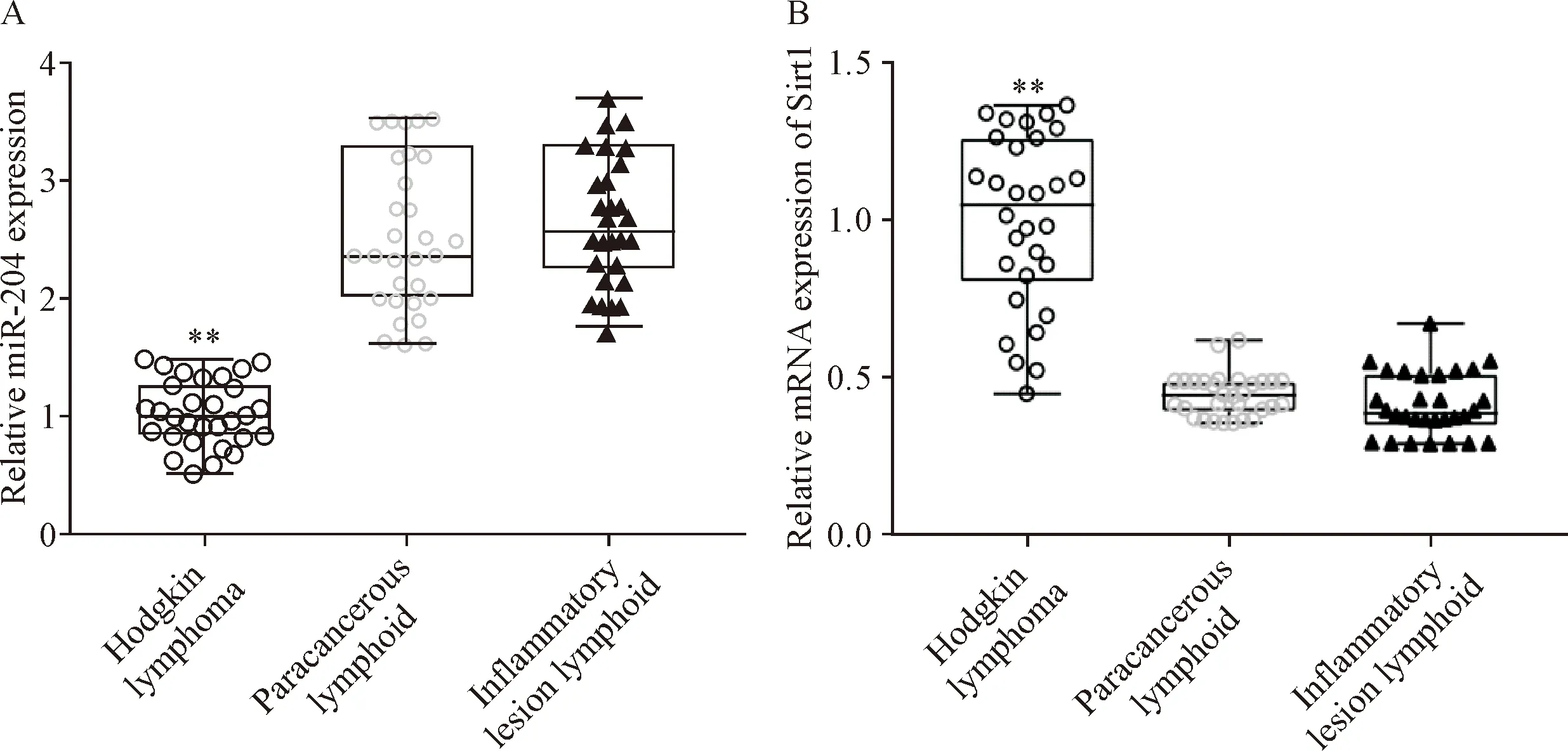
Figure 1.The expression levels of miR-204 (A) and Sirt1 mRNA (B) in the Hodgkin lymphoma tissues, paracancerous lymphoid tissues and inflammatory lesion lymphoid tissues detected by RT-qPCR. Mean±SEM.n=30.**P<0.01vsparacancerous lymphoid tissues or inflammatory lesion lymphoid tissues.
图1 霍奇金淋巴瘤组织、癌旁淋巴组织和炎性病变的淋巴组织中miR-204和Sirt1 mRNA的表达水平
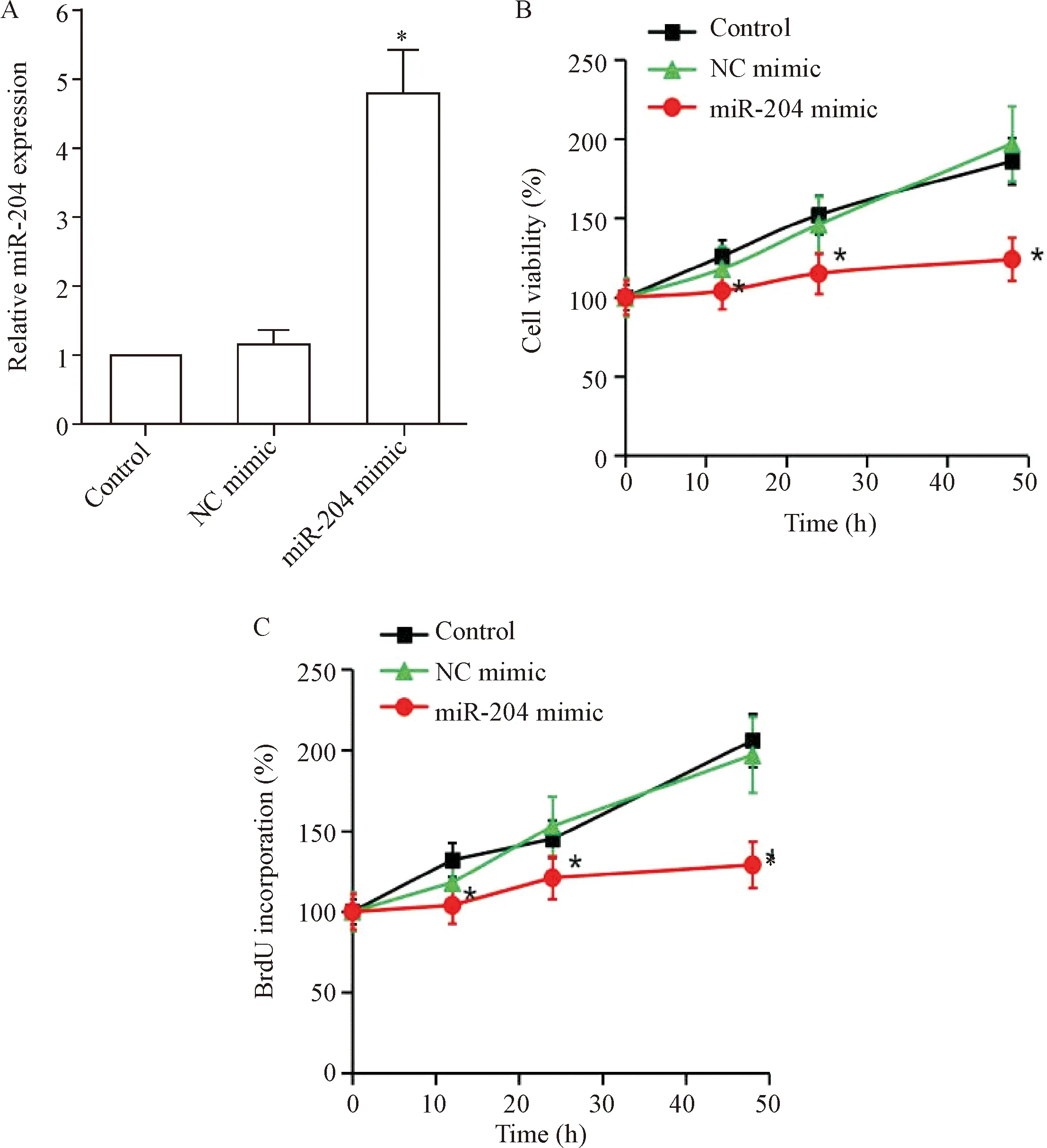
Figure 2.Up-regulation of miR-204 inhibited the proliferation of L428 cells. After transfection with miR-204 mimic, the transfection efficiency of miR-204 mimic was detected by RT-qPCR (A), cell viability was measured by CCK-8 assay (B) and BrdU incorporation was measured by BrdU assay (C). Mean±SEM.n=4.*P<0.05vscontrol group or NC mimic group.
图2 上调miR-204表达抑制L428细胞增殖

Figure 3.Sirt1was a target gene of miR-204. A: the putative mRNA target site in Sirt1 3′UTR; B: the relative luciferase activity of Sirt1-WT and Sirt1-MUT; C: after transfection with miR-204 mimic, the expression level of Sirt1 was detected by Western blot in the L428 cells. Mean±SEM.n=4.*P<0.05vsNC mimic group.
图3Sirt1是miR-204的靶基因

Figure 4. Knockdown ofSirt1expression inhibited the proliferation of L428 cells. A: after transfection withSirt1siRNA, the transfection efficiency ofSirt1siRNA was detected by Western blot; B: the cell viability was measured by CCK-8 assay; C: BrdU incorporation was measured by BrdU assay. Mean±SEM.n=4.*P<0.05vscontrol group or NC siRNA group.
图4 敲减Sirt1表达抑制L428细胞增殖
4 下调Sirt1表达抑制L428细胞增殖
通过转染Sirt1siRNA,下调L428细胞的Sirt1表达,见图4A。进一步分别通过CCK-8法和BrdU法检测下调Sirt1表达对L428细胞活力和BrdU掺入量的影响,结果显示,与control组或NC mimic转染组相比,Sirt1siRNA转染组L428细胞在各时点的细胞活力降低和BrdU掺入量下降(P<0.05),见图4B、C;与control组相比,NC siRNA转染组L428细胞细胞活力和BrdU掺入量无显著变化(P>0.05)。这些结果提示下调Sirt1表达抑制L428细胞增殖。
5 Sirt1过表达取消miR-204对L428细胞增殖的抑制作用
取已转染miR-204 mimic的L428细胞,再次转入pcDNA3.1-Sirt1,进一步分别通过CCK-8法和BrdU法检测共转染miR-204 mimic和pcDNA3.1-Sirt1对L428细胞活力和BrdU掺入量的影响,结果显示,与单纯miR-204 mimic转染组相比,miR-204 mimic+pcDNA3.1-Sirt1共转染组L428细胞的Sirt1表达显著升高(P<0.05),见图5A;且在各时点的细胞活力升高,BrdU掺入量增加(P<0.05),见图5B、C。这提示miR-204对L428细胞增殖的抑制作用是通过抑制靶基因Sirt1表达实现的。
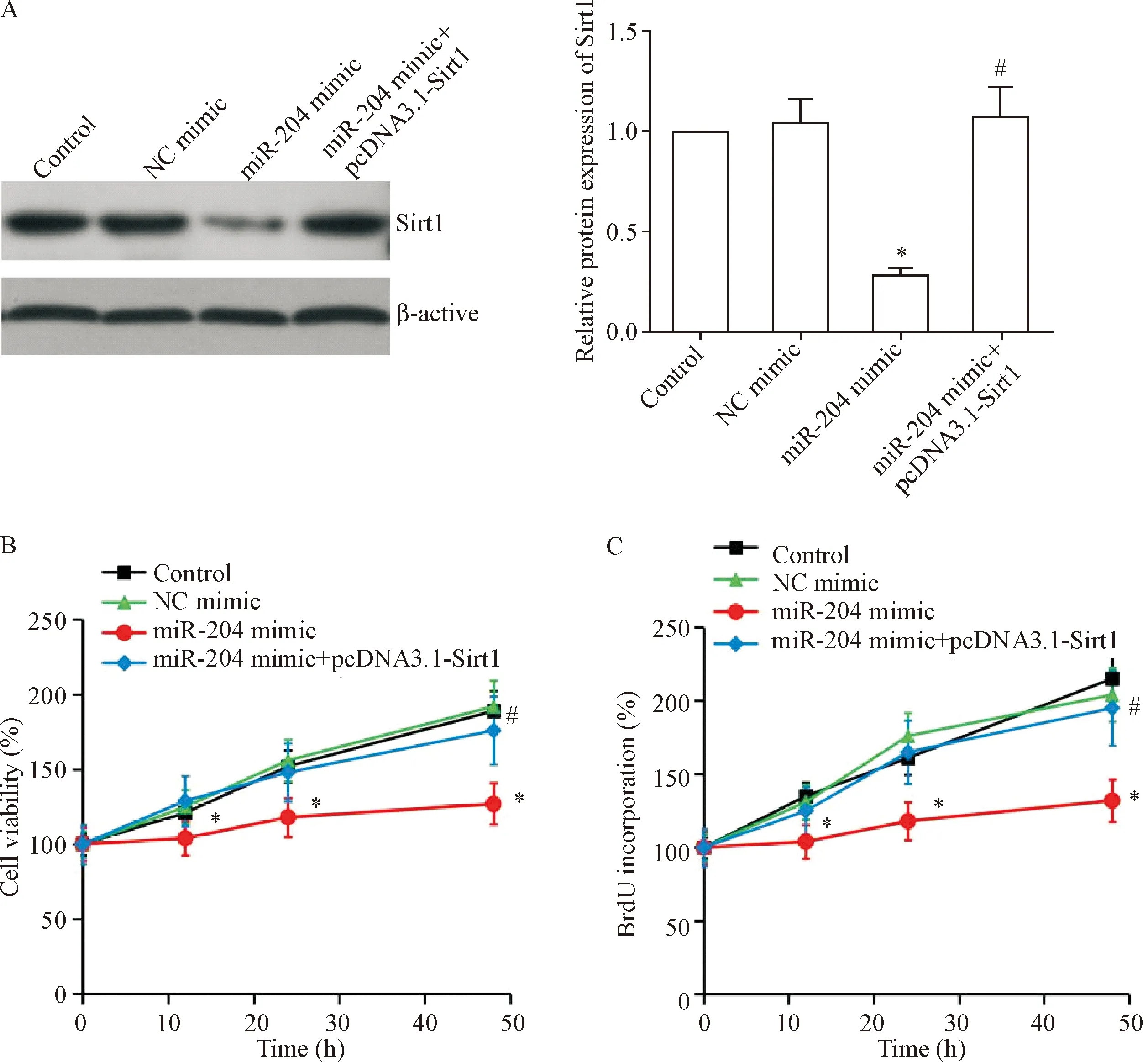
Figure 5.Sirt1 was involved in regulating the inhibitory effect of miR-204 on the proliferation of L428 cells. After the L428 cells were transfected with miR-204 mimic with/without pcDNA3.1-Sirt1, the expression level of Sirt1 was detected by Western blot (A), the cell viability was measured by CCK-8 assay (B) and BrdU incorporation was measured by BrdU assay (C). Mean±SEM.n=4.*P<0.05vscontrol group;#P<0.05vsmiR-204 mimic group.
图5 Sirt1参与调控miR-204对L428细胞增殖的抑制作用
6 miR-204与Sirt1对乙酰化p53蛋白水平的影响
Western blot结果显示,与control组相比,转染Sirt1siRNA或miR-204 mimic均能上调L428细胞中ac-p53的蛋白水平(P<0.05),见图6A;与单纯miR-204 mimic转染组相比,miR-204 mimic+pcDNA3.1-Sirt1共转染组L428细胞中ac-p53的蛋白水平显著降低(P<0.05),见图6B。
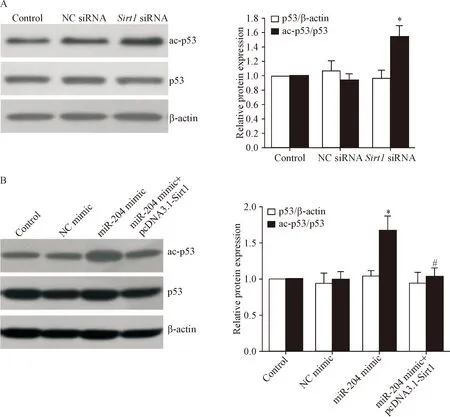
Figure 6.The effects of miR-204 and Sirt1 on the protein levels of ac-p53 in the L428 cells. A: after transfection withSirt1siRNA, the protein level of ac-p53 in the L428 cells was determined by Western blot; B: after the L428 cells were transfected with miR-204 mimic with/without pcDNA3.1-Sirt1, the protein level of ac-p53 was determined by Western blot. Mean±SEM.n=4.*P<0.05vscontrol group;#P<0.05vsmiR-204 mimic group.
图6 miR-204与Sirt1对L428细胞乙酰化p53表达的影响
讨 论
miR-204在总多肿瘤细胞的增殖,凋亡,转移与侵袭等生物过程中具有重要的作用,影响肿瘤的发生发展[5-7]。本研究结果显示,霍奇金淋巴瘤组织中的miR-204的表达显著低于癌旁淋巴组织和炎性病变淋巴组织,提示了miR-204在霍奇金淋巴瘤组织中特异性低表达。过表达miR-204导致L428细胞活性和BrdU掺入随时间增加而显著下降,提示过表达miR-204具有抑制L428细胞生长的作用。
miRNAs通过调控靶基因,参与下游的基因转录来发挥生物学效应[4]。本研究发现,Sirt1是miR-204的靶基因。Sirt1是一种高度保守的NAD+依赖的蛋白脱乙酰酶,与转录共调控因子、染色质以及多种重要的转录因子相互作用,通过去乙酰化作用调控基因转录,调节多种生物学行为[8]。且已有研究证明,Sirt1可以参与调控肿瘤细胞发生和肿瘤细胞免疫反应[9-10]。本研究发现,miR-204可以下调Sirt1表达,而Sirt1敲低能发挥抑制L428细胞增殖的作用。p53作为Sirt1的底物之一,在与Sirt1结合以后,使其C端的赖氨酸残基脱乙酰基,导致p53失活,进而阻止p53从细胞质移位至线粒体,使得不再释放促凋亡蛋白,达到促进细胞增殖的效果[11]。p53是重要的抑癌因子,具有调控线粒体凋亡和细胞周期的作用,并参与调控线粒体外模的渗透性[12]。乙酰化p53作为p53蛋白的一种活化形式,通过诱导不同位点的基因表达,导致细胞周期停滞或凋亡[13]。且Shu等[14]研究发现,miR-204可以抑制靶基因Sirt1表达,促进p53乙酰化,增强阿霉素对前列腺癌的敏感性,提示Sirt1可作用于p53,影响乙酰化p53激活,进而控制细胞的生物学效应。本研究发现,上调miR-204表达后,L428细胞中Sirt1的蛋白表达水平显著下降,p53的乙酰化水平明显上升;同样,Sirt1敲低后,p53的乙酰化水平明显上升。推测,miR-204发挥抑制L428细胞增殖的作用,是通过靶向结合Sirt1/p53信号通路。此外,共转染miR-204 mimic 和pcDNA3.1-Sirt1能逆转过表达miR-204的作用,重新恢复L428细胞增殖;且与单独miR-204 mimic转染组相比,ac-p53蛋白表达明显降低。此结果确认了miR-204抑制L428细胞增殖是Sirt1/p53信号通路介导的。
综上所述,miR-204在霍奇金淋巴瘤组织中呈特异性低表达。过表达miR-204可抑制L428细胞增殖,其机制可能与下调Sirt1表达进而激活乙酰化p53有关。

