CASC2/miR-18a/BTG3信号抑制非小细胞肺癌迁移和侵袭*
陈兴峰, 王应琼, 陈亚红, 王茂泽, 陈 山, 许铁峰, 石慧芳△
(1海南医学院第二附属医院呼吸内科, 海南 海口 570311; 2海南医学院肿瘤研究所附属医院肿瘤外科, 海南 海口 570102)
肺癌是世界范围内危害最为严重的恶性肿瘤,具有较高的发病率和死亡率[1]。据2013年的统计结果显示,在我国约73.28万人被确诊为肺癌,该病死亡的人数多达58.07万人,其中男性的发病率约为女性的1.5倍[2]。肺癌可分为非小细胞肺癌(non-small-cell lung cancer,NSCLC)和小细胞肺癌(small-cell lung cancer,SCLC)2种不同的亚型,其中NSCLC占所有肺癌病例的80~85%[3]。NSCLC在发病早期多不表现明显的临床症状,被许多患者及家属忽视从而延误病情,约65%的病人在确诊时已发展为晚期肺癌或癌细胞发生转移[4]。目前,手术和化疗是治疗NSCLC常用的方法,随着临床治疗技术的不断改善,患者的总生存时间在一定程度上也有所提高,但预后效果仍不十分理想,患者5年的生存率低于16%[5-6]。因此,研究NSCLC的发生机制并提出一种潜在的生物学靶点将为NSCLC的早期诊断和临床治疗提供新思路。
长链非编码RNA(long non-coding RNA,lncRNA)是一类超过200个核苷酸长度的不具有蛋白编码能力的RNA。在早期,lncRNA常被认为是基因转录的“噪音”,随着研究的深入,lncRNA在表观遗传学、转录和翻译、蛋白修饰中的功能被广泛证实。CASC2(cancer susceptibility 2)是位于染色体10q26上的一种lncRNA,最早于2004年在子宫内膜癌中被鉴定[7],可在转录或转录后水平调控基因的表达,进而调控个体发育、细胞分化、增殖和迁移等过程[8]。CASC2是一种重要的肿瘤抑制因子,在多种肿瘤中均发现CASC2的异常低表达,如胶质瘤[9]、胃癌[10]、结肠直肠癌[11]等,但CASC2在NSCLC发生展中的作用机制还有待深入研究。本研究探讨CASC2过表达对NSCLC细胞迁移和侵袭能力的影响,并分析CASC2、微小RNA-18a (micro-RNA-18a,miR-18a)和BTG3(B-cell translocation gene 3)三者的靶向关系及相互调控作用。通过分析CASC2在NSCLC细胞中的表达、功能和调控机制,揭示NSCLC的发生机制,为该病的临床诊断提供可靠的生物学靶点。
材 料 和 方 法
1 材料
人胚胎肾细胞系293T、人支气管上皮细胞系16-HBE及人非小细胞肺癌细胞系A549和H1299购自中国科学院典型培养物保藏委员会细胞库。
2 实验方法
2.1细胞培养和传代 293T、16-HBE、A549和H1299细胞均培养在含10%胎牛血清(Gibco)和1%青链霉素(Invitrogen)的RPMI-1640培养液(Gibco)中,并置于37 ℃、5% CO2的细胞培养箱中培养,每48 h更换1次培养基。当细胞融合度达85%以上时,弃去培养基,PBS洗涤2次,加入0.25%的胰蛋白酶(Sigma)消化后,将细胞悬液转移到新的离心管中,1 000 r/min离心5 min,弃去培养基,再加入完全培养基重悬细胞。
2.2细胞转染 CASC2重组过表达质粒(pcDNA-CASC2)、CASC2干扰质粒(si-CASC2)、miR-18a 模拟物(miR-18a)及阴性对照(miR-NC)、miR-18a抑制剂(anti-miR-18a)及阴性对照(anti-miR-NC)均购自GenePharma。将处于对数生长期的细胞接种于6孔板中,过夜培养后,利用Lipofectmine 2000脂质体转染试剂(Invitrogen)将上述质粒或寡核苷酸转染到细胞中,培养48 h后,检测各指标的变化。
2.3RT-qPCR检测RNA表达 采用TRIzol法提取细胞总RNA,NanoDrop 2000测RNA浓度,分别利用Reverse Transcription System Kit(TaKaRa)和miRNA First-Stand cDNA Synthesis Kit(GeneCopoeia)对lncRNA和miRNA进行逆转录;使用2×SYBR Green Master Mix(Invitrogen)在萤光定量PCR仪上测定各lncRNA和mRNA的相对表达水平,分别以GAPDH和U6作为内参照。CASC2的上游引物序列为5′-GCACATTGG ACGGTGTTTCC-3′,下游引物序列为5′-CCCAGTCCTTCACAGGTCAC-3′;BTG3的上游引物序列为5′-GCAGTTGAGAGGTTTGCTGA-3′,下游引物序列为5′-TAACTTTCCTGGAGATCTCATT-3′;内参照GAPDH的上游引物序列为5′-AGAAGGCTGGGGCTCATTTG-3′,下游引物序列为5′-AGGGGCCATCCACAGTCTTC-3′。miR-18a及内参照U6的引物由Applied Biosystems合成。
2.4Transwell小室法检测细胞的侵袭和迁移能力 侵袭实验开始前,需要在小室内膜铺上EMC胶以模仿细胞外基质,而迁移实验不要加入EMC胶。将质粒或寡核苷酸转染至A549细胞中,48 h后用0.25%的胰酶消化细胞,PBS洗涤后加入不含血清的培养液重悬细胞,调整细胞密度为5×108/L。向Transwell上室内加入100 μL的细胞悬液,下室内加入500 μL含10%血清的完全培养液,将培养板放入37 ℃、5% CO2培养箱中培养48 h后取出,用甲醇固定10 min,再用0.1%结晶紫染色10 min,倒置显微镜下观察结果并拍照,选取10个视野并计算每个视野中的平均细胞数。
2.5双萤光素酶报告基因实验 使用特异性引物扩增CASC2和BTG3 3′-UTR片段中含miR-18a结合位点的序列,之后克隆到psiCHECKTM-2报告质粒中分别构建CASC2-WT和BTG3-WT报告质粒。使用点突变试剂盒(TaKaRa)对CASC2-WT和BTG3-WT报告质粒上的miR-18a结合位点进行突变,构建CASC2-MUT和BTG3-MUT报告载体。将CASC2和BTG3野生型或突变型报告质粒与miR-18a或miR-NC共转染至293T细胞中,48 h后利用双萤光素酶报告分析试剂盒检测各组细胞的萤光素酶活性。
2.6Western blot检测蛋白表达 转染48 h后收集细胞并加入RIPA裂解液裂解细胞,离心取上清,BCA法测蛋白含量。取相同含量的蛋白加入上样缓冲液煮沸5 min,之后进行10% SDS-PAGE分离蛋白,并转至PVDF膜上,37 ℃、 5%的脱脂奶粉封闭2 h,加入抗BTG3抗体孵育2 h,再加入相应 II 抗孵育1.5 h,最后进行ECL化学发光显色,β-actin作为内参照,蛋白相对表达量采用ImageJ软件进行分析。
3 统计学分析
采用SPSS 20.0软件进行分析,实验数据用均数±标准差(mean±SD)表示,两组间比较采用t检验,多组比较采用单因素方差分析,各组均数间的两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 CASC2在NSCLC细胞中的表达和功能分析
采用RT-qPCR检测NSCLC细胞中CASC2的表达,结果显示,与正常支气管上皮16-HBE细胞相比,NSCLC细胞系A549和H1299中的CASC2表达水平均显著降低,其中,A549细胞中CASC2的表达水平最低(P<0.05),见图1A,因此,后续实验选择A549细胞为研究对象。为进一步研究CASC2对肺癌细胞迁移和侵袭的影响,我们在A549细胞中转染pcDNA-CASC2,并采用RT-qPCR检测CASC2表达,结果显示,与pcDNA3.1转染组相比,pcDNA-CASC2转染组细胞中CASC2的表达水平显著升高(P<0.05),见图1B,由此证实通过转染pcDNA-CASC2可成功构建CASC2过表达模型。转染48 h后采用Transwell小室法分析CASC2过表达对细胞迁移和侵袭能力的影响,结果显示,与pcDNA3.1转染组相比,CASC2过表达后NSCLC细胞的迁移和侵袭细胞数明显降低(P<0.05),见图1C、D。上述结果表明,CASC2过表达可抑制NSCLC细胞的迁移和侵袭能力。
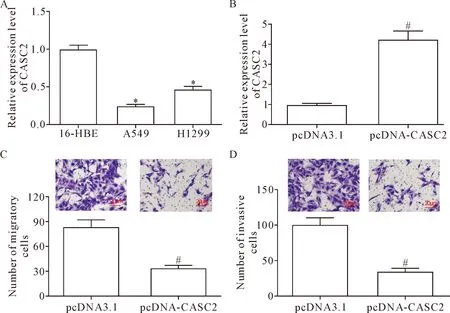
Figure 1.The expression of CASC2 in NSCLC cells and its effects on the cell migration and invasion abilities. A: the expression of CASC2 in the NSCLC cell lines; B: the transfection efficiency of CASC2-overexpressing plasmid in A549 cells; C: the effect of CASC2 overexpression on A549 cell migration ability; D: the effect of CASC2 over-expression on A549 cell invasion ability. Mean±SD.n=3.*P<0.05vs16-HEB cells;#P<0.05vspcDNA3.1 group.
图1 CASC2在NSCLC细胞中的表达及对NSCLC细胞迁移和侵袭的影响
2 CASC2与miR-18a的靶向验证
本研究利用StarBase软件预测与CASC2互补结合的miRNA,结果显示,miR-18a序列中存在与CASC2互补结合的核苷酸位点,见图2A。之后采用双萤光素酶报告基因实验进一步探究CASC2与miR-18a的靶向关系,结果显示,与miR-NC组相比,miR-18a过表达显著抑制了CASC2-WT的萤光素酶活性(P<0.05),但对CASC2-MUT萤光素酶活性无影响(P<0.05);与anti-miR-NC组相比,敲减miR-18a表达显著促进了CASC2-WT的萤光素酶活性,但对CASC2-MUT萤光素酶活性无影响,见图2B、C。由此得知,CASC2能够通过互补结合位点与miR-18a发生相互作用。
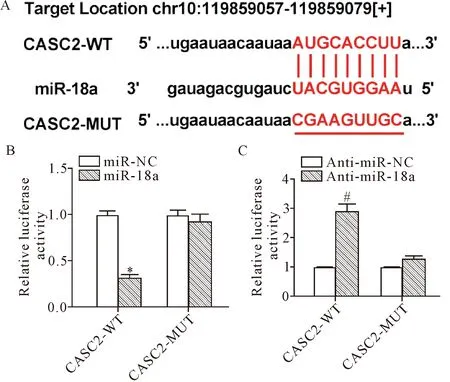
Figure 2.The interaction between CASC2 and miR-18a. A: the predicted result of StarBase software; B: the effect of miR-18a over-expression on CASC2 luciferase activity in 293T cells; C: the effect ofmiR-18aknockdown on CASC2 luciferase activity in 293T cells. Mean±SD.n=3.*P<0.05vsmiR-NC group;#P<0.05vsanti-miR-NC group.
图2 CASC2与miR-18a的靶向关系的验证
3 CASC2靶向miR-18a调控肺癌细胞的迁移和侵袭能力
在本研究中,我们首先采用RT-qPCR对miR-18a在肺癌细胞中的表达水平进行分析,结果显示,与16-HBE细胞相比,A549细胞和H1299细胞中miR-18a的表达水平均显著升高,其中A549细胞中的miR-18a水平升高最显著(P<0.05),见图3A。之后,采用RT-qPCR法测定CASC2对miR-18a表达的影响,结果显示,与pcDNA3.1组相比,CASC2上调明显抑制miR-18a表达(P<0.05),与si-NC组相比,敲减CASC2表达明显促进miR-18a表达(P<0.05),说明CASC2能够负调控miR-18a表达,见图3B。为进一步研究CASC2是否通过抑制miR-18a表达参与肺癌细胞功能的调控,我们分别在A549细胞中过表达CASC2或共表达CASC2和miR-18a,并采用Transwell小室法测定各组细胞的迁移和侵袭情况,结果显示,CASC2过表达抑制了A549细胞的迁移和侵袭能力,而外源回补miR-18a可逆转CASC2对细胞迁移和侵袭的抑制作用(P<0.05),见图3C、D。由此可知,CASC2通过调控miR-18a表达抑制A549细胞的迁移和侵袭能力。
4 BTG3与miR-18a的靶向关系验证
本研究利用TargetScan软件对miR-18a的靶基因进行预测,结果显示,BTG3是miR-18a的一个潜在靶基因,见图4A。之后采用双萤光素酶报告基因实验进一步探究miR-18a与BTG3的靶向关系,结果显示,与miR-NC组相比,miR-18a过表达显著抑制了BTG3-WT的萤光素酶活性(P<0.05),但对BTG3-MUT萤光素酶活性无影响;与anti-miR-NC组相比,miR-18a敲低显著促进了BTG3-WT的萤光素酶活性(P<0.05),但对BTG3-MUT萤光素酶活性无影响,见图4B、C。由此得知,miR-18a能够与BTG3发生靶向结合。
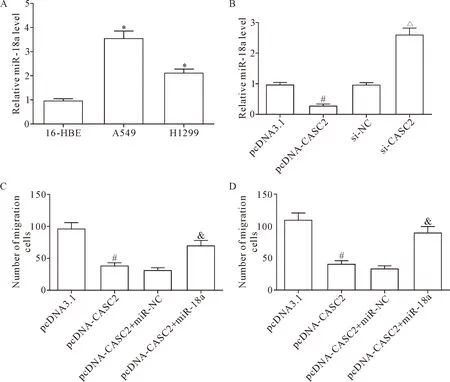
Figure 3.The regulatory effects of CASC2 on miR-18a expression and functions. A: the expression of miR-18a in the NSCLC cell lines; B: the effect of CASC2 overexpression or knockdown on miR-18a expression in A549 cells; C: the effect of exogenous restoration of miR-18a on CASC2-inhibited A549 cell migration; D: the effect of exogenous restortaion of miR-18a on CASC2-inhibited A549 cell invasion. Mean±SD.n=3.*P<0.05vs16-HEB cells;#P<0.05vspcDNA3.1 group;△P<0.05vssi-NC group;&P<0.05vspcDNA-CASC2+miR-NC group.
图3 CASC2对miR-18a表达和功能上的调控
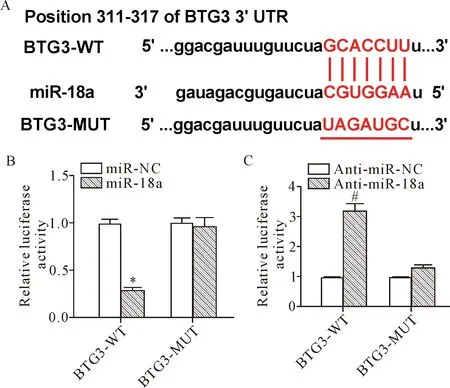
Figure 4.The interaction between miR-18a and BTG3. A: the predicted result of TargetScan software; B: the effect of miR-18a overexpression on BTG3 luciferase activity in 293T cells; C: the effect ofmiR-18aknockdown on BTG3 luciferase activity in 293T cells. Mean±SD.n=3.*P<0.05vsmiR-NC group;#P<0.05vsanti-miR-NC group.
图4 miR-18a与BTG3的靶向关系验证
5 CASC2通过miR-18a调控BTG3的表达
采用Western blot法对BTG3在肺癌细胞中的蛋白表达水平进行分析,结果显示,与16-HBE细胞相比,A549细胞和H1299细胞中BTG3的表达水平均显著降低(P<0.05),见图5A。双萤光素酶报告基因实验显示,miR-18a上调可抑制BTG3-WT萤光素酶活性,而外源回补CASC2逆转了miR-18a对BTG3-WT萤光素酶活性的抑制作用(P<0.05),见图5B。Western blot分析结果显示,CASC2上调促进了BTG3蛋白表达,而外源回补miR-18a逆转了CASC2对BTG3蛋白表达的促进作用(P<0.05),见图5C;敲减CASC2表达抑制了BTG3蛋白表达,而外源性抑制miR-18a逆转了敲减CASC2对BTG3蛋白表达的抑制作用(图5D)。由此说明,CASC2通过与BTG3竞争性结合miR-18a调控BTG3蛋白表达,进而影响NSCLC进程。
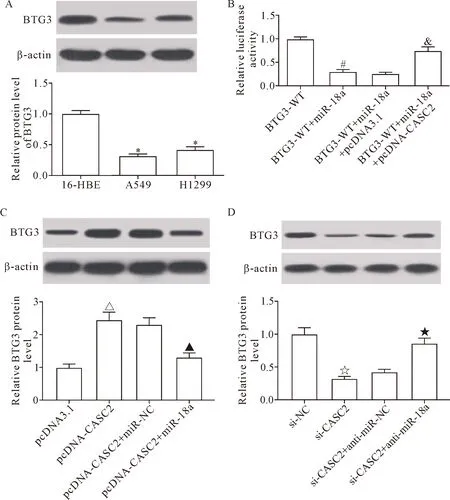
Figure 5. The interactions among CASC2, miR-18a and BTG3. A: the protein expression of BTG3 in the NSCLC cell lines; B: the effect of CASC2 restoration on miR-18a-inhibited BTG3-WT luciferase activity in 293T cells; C: the effect of miR-18a restoration on CASC2-induced BTG3 protein expression in A549 cells; D: the effect of miR-18a inhibitor (anti-miR-18a) on si-CASC2-repressed BTG3 protein expression in A549 cells. Mean±SD.n=3.*P<0.05vs16-HBE cells;#P<0.05vsBTG3-WT group;&P<0.05vsBTG3-WT+miR-18a+pcDNA 3.1 group;△P<0.05vspcDNA3.1 group;▲P<0.05vspcDNA-CASC2+miR-NC group;☆P<0.05vssi-NC group;★P<0.05vssi-CASC2+anti-miR-NC group.
图5 CASC2、miR-18a和BTG3之间的相互调控分析
讨 论
NSCLC是一种严重危害人类健康的恶性肿瘤,近年来,新型细胞毒药物和靶向生物制剂的开发在一定程度上改善了NSCLC患者的生存质量,但晚期肺癌患者的预后仍不理想,因此阐明NSCLC的形成和发展机制,以探索新的临床治疗靶向治疗方法,提高患者的生存率仍是目前研究的重点。随着人类基因组计划的不断开展,研究人员发现在人类基因组中绝大多数的转录产物虽然不具备编码蛋白的能力,但仍可参与调控包括个体发育、细胞分化、细胞增殖等在内的多种生命过程,lncRNA即为其中的一种非编码RNA[12]。
越来越多的证据表明,lncRNA对包括肿瘤在内的多种人类疾病具有潜在的诊断和治疗价值。例如,Zhang等[13]通过研究证实透明细胞肾细胞癌组织中上调的lncRNA MALAT1与患者的晚期临床症状和不良预后密切相关;Zheng等[14]证实在结肠直肠癌患者组织中,lncRNA MALAT1表达水平显著升高,升高的MALAT1可导致患者的不良预后和严重的临床病理特征,且与癌细胞的噬神经侵袭密切相关;lncRNA H19在非小细胞肺癌中的表达明显升高,且H19表达水平与肿瘤的TNM分期、淋巴结转移情况、肿瘤大小、血管生成和不良预后等均密切相关[15];lncRNA HMlincRNA717的水平与肿瘤组织学分级,淋巴结转移和患者总生存期具有一定的相关性[16];外源敲减PVT1表达可抑制NSCLC细胞的增殖、迁移和侵袭[17]。以上研究表明,有必要对NSCLC中的lncRNAs进行筛选鉴定,以发现更多的与肿瘤相关的lncRNAs,为NSCLC的诊断和治疗提供潜在的生物靶点。
CASC2是一种常见的抑癌因子,在多种肿瘤发生中的作用已被广泛证实。本研究中,我们通过实验证实CASC2在NSCLC细胞中出现异常的低表达,且深入的功能研究揭示,外源过表达CASC2可明显降低肿瘤细胞的迁移和侵袭能力。最新的研究表明,在NSCLC患者肿瘤组织中CASC2表达水平显著下调,异常表达的CASC2与患者的不良预后及晚期病理分期密切相关,且外源过表达CASC2可抑制NSCLC细胞的增殖活性[18]。该研究与我们的结果一致。近年来,越来越多的证据表明,lncRNA-miRNA-mRNA网络在包括NSCLC在内的多种肿瘤的发生发展过程中起重要作用,在这个网络中lncRNA主要发挥竞争性内源RNA(competing endogenous RNA,ceRNA)的功能与mRNA竞争性结合miRNAs,最终参与调控肿瘤的形成。NSCLC组织和细胞中上调的lncRNA NEAT1可通过抑制miR-181a-5p促进下游靶基因HMGB1表达的升高,最终诱导NSCLC细胞生长[19];SNHG1通过与SOX9竞争性结合miR-101-3p释放更多的SOX9,进而激活Wnt/β-catenin信号通路,在NSCLC中发挥促肿瘤形成作用[20];TP53TG1可通过调控miR-18a/PTEN通路增强NSCLC细胞对顺铂药物化疗的敏感性[21]。为进一步研究CASC2在调控NSCLC发生发展的作用机制,我们利用生物信息学分析、双萤光素酶报告基因实验和qRT-PCR证实CACS2可通过与miR-18a互补结合抑制miR-18a表达。miR-18a作为一种重要的肿瘤调控因子在NSCLC中发挥重要的促肿瘤形成作用[22]。功能回补实验进一步证实,CACS2可通过下调miR-18a表达抑制NSCLC细胞的迁移和侵袭能力。
BTG3基因定位于人染色体21q21.1上,其编码的蛋白可调控多种细胞的周期进程和分化,是一种抑制细胞增殖的蛋白,在多种恶性肿瘤中发挥抑癌重要的作用,如卵巢癌[23]、食管癌[24]和肺癌[25]等。本研究中,我们通过TargetScan生物预测软件初步证实BTG3是miR-18a的一个潜在靶基因,双萤光素酶报告基因实验结果显示miR-18a可抑制BTG3-WT萤光素酶活性,但外源回补CASC2可促进BTG3-WT萤光素酶活性。Western blot实验结果进一步证实CASC2促进了BTG3蛋白表达,但外源回补miR-18a可抑制BTG3蛋白表达。以上结果说明,CASC2可通过负调控miR-18a促进BTG3表达。
综上所述,在NSCLC中,lncRNA CASC2表达水平明显降低;CASC2可通过与BTG3竞争性结合miR-18a发挥对BTG3蛋白表达的促进作用,进而抑制NSCLC细胞的迁移和侵袭能力。本研究首次证实CASC2/miR-18a/BTG3网络在NSCLC发生发展中的作用,提示CASC2可能作为临床治疗NSCLC的潜在生物靶点。

