敲减HMGA2基因抑制TGF-β1诱导的人胚肺成纤维细胞生长及胶原合成*
李 鹏, 刘咏梅, 刘振华
(承德市中心医院儿科, 河北 承德 067000)
肺纤维化(pulmonary fibrosis,PF)属于间质性肺炎的严重阶段,发病机制复杂,近些年的发病率及死亡率均呈现上升趋势[1]。有研究发现,成纤维细胞在PF发生及发展过程中有重要作用,抑制肺成纤维细胞增殖及向肌纤维细胞转化,促进其凋亡是影响PF发生发展的关键[2-3]。高迁移率族蛋白A2(high mobility group A2,HMGA2)是一种非组蛋白染色体蛋白,其表达与多种人类肿瘤发生发展密切相关[4-5]。也有研究显示,在PF过程中HMGA2可随PF程度增加表达量增加,可能是通过调节与上皮-间充质细胞转化相关基因而在其中发挥作用[6];沉默HMGA2表达可抑制人胚肺成纤维细胞胶原合成[7]。以上研究提示PF过程中HMGA2可能发挥了重要的调节作用。转化生长因子 β1(transforming growth factor-β1,TGF-β1)是TGF-β家族中最重要的亚型,在PF等疾病状态下表达增加,是致纤维化关键性的细胞因子[8]。因此,本研究通过RNA干扰技术敲减HMGA2的表达,旨在探讨抑制HMGA2表达对TGF-β1诱导的人胚肺成纤维细胞活力、凋亡、胶原(collagen,COL)合成及氧化应激的影响,以期为PF的治疗提供理论依据。
材 料 和 方 法
1 试剂和仪器
胎牛血清(fetal bovine serum,FBS)购自杭州四季青;DMEM培养基购自HyClone;MTT和DCFH-DA均购自Sigma;TGF-β1购自Peprotech INC;细胞凋亡试剂盒购自江苏凯基;RNA提取试剂盒及逆转录试剂盒均购自TaKaRa;抗HMGA2、AKT和p-AKT抗体均购自Abcam。流式细胞仪购自Becton Dikinson;酶标仪购自BIO-RAD。
2 细胞及培养
人胚肺成纤维细胞(human embryonic lung fibroblast,HELF)购自中科院上海细胞库。细胞用含10% FBS的DMEM培养基在5%体积分数CO2、37 ℃恒温、饱和湿度条件下培养。细胞达80%左右生长融合时,胰酶消化后传代。实验为3~4代的细胞。
3 方法
3.1分组及转染 实验分为空白(blank)组、TGF-β1组、阴性对照(negative control,NC)组和HMGA2 siRNA(si-HMGA2)组。空白组细胞不经特殊处理。TGF-β1组用含5 μg/L TGF-β1的DMEM培养基刺激细胞24 h;NC组和si-HMGA2组分别转染阴性对照siRNA及HMGA2的特异性siRNA 48 h后使用含5 μg/L TGF-β1的DMEM培养基刺激细胞24 h。siRNA转染步骤参照LipofectamineTM2000说明书进行。
3.2转染效率的检测 预冷RIPA裂解液(加蛋白酶抑制剂PMSF)提取按照3.1分组处理后的细胞,BCA法测定蛋白浓度,每孔上样40 μg总蛋白,经10~12%的SDS-PAGE分离后电转移至PVDF膜,膜用5%脱脂奶粉封闭2 h,TBST缓冲液洗膜,将膜完全浸入稀释好的 I 抗溶液中(1 ∶500稀释的HMGA2及1 ∶1 000稀释的β-actin),4 ℃摇床中孵育过夜,TBST缓冲液洗膜,加稀释好的 II 抗(HRP标记的抗体,稀释比例1 ∶2 000),37 ℃孵育30 min,洗膜,加ECL发光液覆盖膜,待荧光较为稳定后扫描,扫描后使用Image J分析软件对图像进行灰度值分析。得出目的蛋白与内参照蛋白吸光度值比值,即为蛋白的相对表达量。实验重复3次。
3.3细胞活力的检测 收集生长至对数期的HELF,以每孔5×103个接种于96孔板,5%体积分数CO2、37 ℃孵育,使细胞单层覆盖孔底部,弃去旧培养液,按照3.1分组处理细胞,每组设置5个复孔,处理至规定时间后,每孔加10 μL的MTT溶液(5 g/L),继续孵育4 h,吸去孔内培养液,每孔中加入150 μL的DMSO,37 ℃孵育10 min,振荡10 min以使结晶能够充分溶解,酶标仪测定490 nm波长处各孔的吸光度(A)值。实验重复3次。
3.4细胞凋亡率检测 收集按照3.1分组处理至规定时间的细胞,预冷PBS洗涤后用适量胰酶-EDTA消化液消化,收集消化的细胞至EP管,4 ℃离心,PBS洗涤,500 μL的1×binding buffer重悬细胞,分别加入Annexin V-FITC及PI各5 μL和10 μL,室温避光孵育15 min,上机前再加入1×binding buffer 300 μL,1 h内通过流式细胞仪检测。实验重复3次。
3.5活性氧簇(reactive oxygen species,ROS)含量测定 采用荧光分子探针DCFH-DA法测定细胞内ROS水平。收集按照3.1分组处理至规定时间的细胞,PBS漂洗后,离心,弃上清,加入终浓度为5 μmol/L的DCFH-DA,37 ℃孵育40 min,将加DCFH-DA的细胞浑浊液涂在盖玻片上,PBS洗涤多余染料,盖玻片倒扣在载玻片上,荧光倒置显微镜及Image Lab软件测定荧光强度。实验重复3次。
3.6RT-qPCR检测COL-I和COL-III的mRNA表达 TRIzol法提取按照3.1分组处理至规定时间的细胞总RNA,逆转录试剂盒将总RNA反转录为cDNA,使用Primer 5.0软件设计PCR引物,按照PCR试剂盒说明设置反应体系及反应条件。使用Alpha凝胶成像系统分析图像,β-actin作为内参照,根据2-△△Ct公式计算目的基因相对于β-actin的mRNA表达量。COL-Ⅰ(449 bp)的上游引物序列为5’- GCTCGTGGAAATGATGGTGC-3’,下游引物序列为 5’-CCTCGCTTTCCTTCCTCTCC-3’;COL-Ⅲ(386 bp)的上游引物序列为 5’-ACGGAAACACTGGTGGACAG-3’,下游引物序列为5’-GTAGTCTCACAGCCTTGCGT-3’;β-actin(500 bp)的上游引物序列为5’- GTGGGGCGCCCCAGGCACC-3’,下游引物序列为5’-CTCCTTAATGTCACGCACGATTT-3’。每孔设置5个重复孔,实验重复3次。
3.7AKT和p-AKT蛋白表达的检测 分组同3.1。AKT和p-AKT蛋白表达的Western blot检测方法同3.2。
4 统计学方法
所有实验数据采用SPSS 21.0软件进行分析。计量资料用均数±标准差(mean±SD)表示,多组差异比较采用单因素方差分析,两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 转染si-HMGA2的HELF中HMGA2蛋白的表达
Western blot法检测转染si-HMGA2的HELF中HMGA2蛋白的表达,结果显示,TGF-β1组的HMGA2蛋白表达明显高于空白组和si-HMGA2组(P<0.05),TGF-β1组和NC组间HMGA2蛋白表达的差异无统计学显著性(P>0.05),提示TGF-β1能够诱导HELF中HMGA2的表达,且转染si-HMGA2能够有效敲减TGF-β1诱导的HELF中HMGA2的表达,见图1。
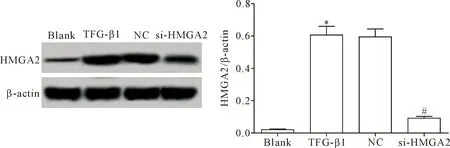
Figure 1.Western blot was used to detect the protein expression of HMGA2 in the HELF transfected with si-HMGA2.Mean±SD.n=3.*P<0.05vsblank group;#P<0.05vsTGF- β1 group.
图1 Western blot检测转染si-HMGA2的HELF中HMGA2蛋白的表达
2 敲减HMGA2基因的表达可减弱HELF活力
MTT结果显示,TGF-β1组的细胞活力明显高于空白组和si-HMGA2组(P<0.05),TGF-β1组和NC组间比较细胞活力的差异无统计学意义(P>0.05),见图2。表明敲减HMGA2基因的表达能够明显减弱TGF-β1诱导的HELF的活力。
3 敲减HMGA2基因的表达促进HELF凋亡
流式细胞术结果显示,空白组、TGF-β1组、NC组和si-HMGA2组的细胞凋亡率分别为(13.5±1.35)%、(2.7±0.26)%、(3.0±0.29)%和(10.9±1.07)%。TGF-β1组的细胞凋亡率明显低于空白组和si-HMGA2组(P<0.05),TGF-β1组和NC组间比较细胞凋亡率的差异无统计学显著性(P>0.05),见图3。提示敲减HMGA2基因的表达能够显著促进TGF-β1诱导的HELF凋亡。
4 敲减HMGA2基因的表达可降低HELF中胶原的mRNA表达
RT-qPCR结果显示,TGF-β1组COL-Ⅰ和COL-Ⅲ的mRNA表达均明显高于空白组和si-HMGA2组(P<0.05),TGF-β1组和NC组间比较COL-Ⅰ和COL-Ⅲ mRNA表达的差异均无统计学显著性(P>0.05),见图4。提示敲减HMGA2基因的表达能够有效降低TGF-β1诱导的HELF中胶原的合成。

Figure 2.The effect ofHMGA2gene knockdown on the viability of HELF. Mean±SD.n=3.*P<0.05vsblank group;#P<0.05vsTGF- β1 group.
图2 敲减HMGA2基因的表达对HELF活力的影响
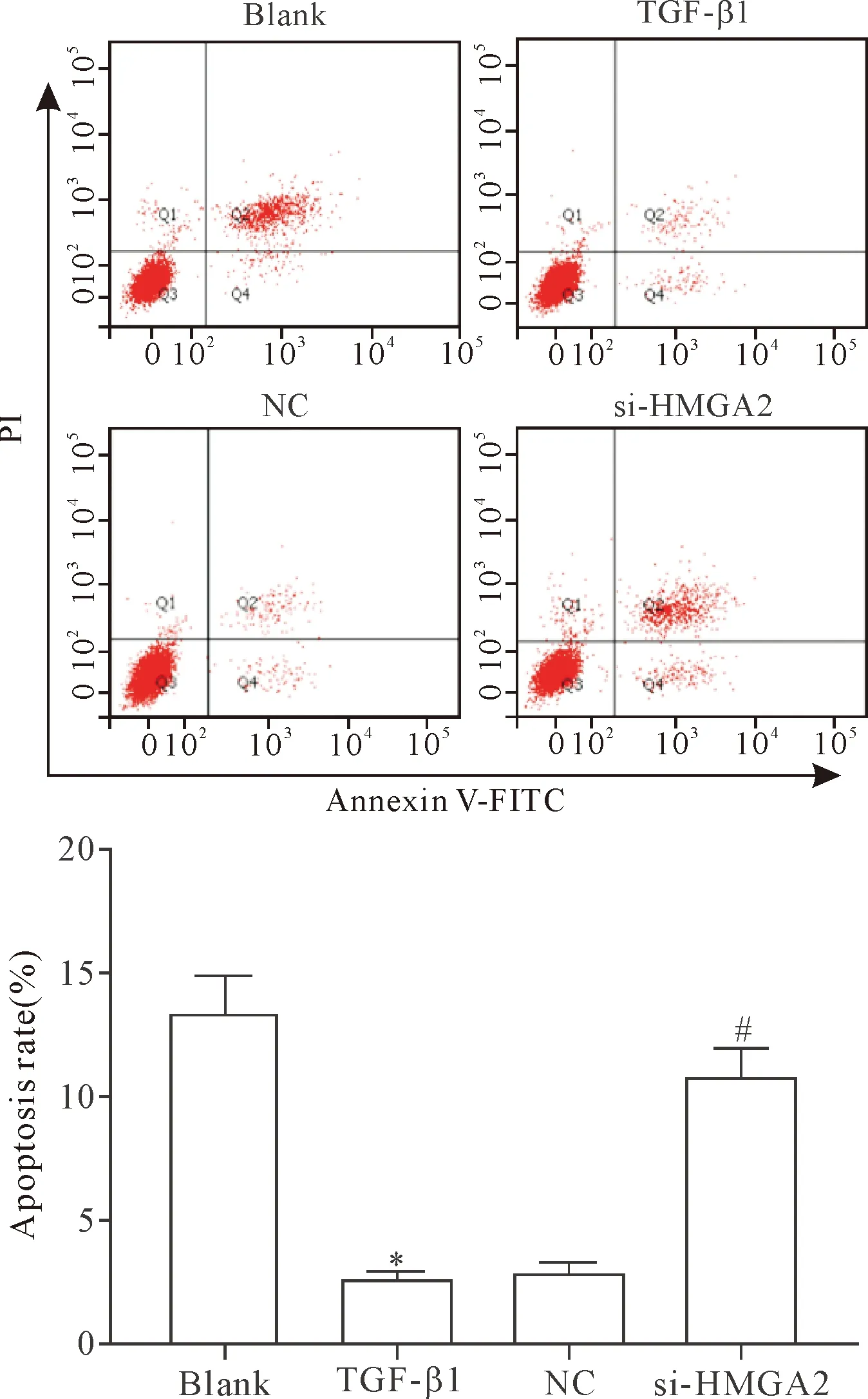
Figure 3.The effect ofHMGA2gene knockdown on the apoptosis of HELF. Mean±SD.n=3.*P<0.05vsblank group;#P<0.05vsTGF- β1 group.
图3 敲减HMGA2基因表达对HELF凋亡的影响
5 敲减HMGA2基因表达可降低HELF中ROS的含量
荧光分子探针DCFH-DA法结果显示,TGF-β1组细胞的ROS含量明显低于空白组和si-HMGA2组(P<0.05),TGF-β1组和NC组间比较细胞ROS含量的差异无统计学显著性(P>0.05),见图5。提示敲减HMGA2基因的表达能够明显提高TGF-β1诱导的HELF中ROS的含量。
6 敲减HMGA2基因的表达下调HELF中p-AkT的蛋白水平
Western blot检测各组细胞AKT和p-AKT的蛋白水平,结果显示,TGF-β1组细胞p-AKT的蛋白水平明显高于空白组和si-HMGA2组(P<0.05),TGF-β1组和NC组间比较p-AKT蛋白水平的差异无统计学显著性(P>0.05),见图6。提示敲减HMGA2基因的表达能够抑制TGF-β1诱导的PI3K/AKT信号通路的激活。
讨 论
TGF-β有TGF-β1、TGF-β2和TGF-β3 3种形式,其中以TGF-β1最为重要,是关键的致纤维化因子之一,在纤维化病变中表达高于正常组织,能促进细胞外基质(extracellular matrix,ECM)的积聚,并可促进成纤维细胞COL-I和COL-III表达,TGF-β1浓度越高对COL-I和COL-III表达促进作用越明显,从而影响PF进展[9-10]。此外,也有研究显示,TGF-β1可抑制肺成纤维细胞凋亡[11],以上研究提示抑制TGF-β1诱导的肺成纤维细胞增殖、胶原合成及促进细胞凋亡对PF治疗具有重要意义。
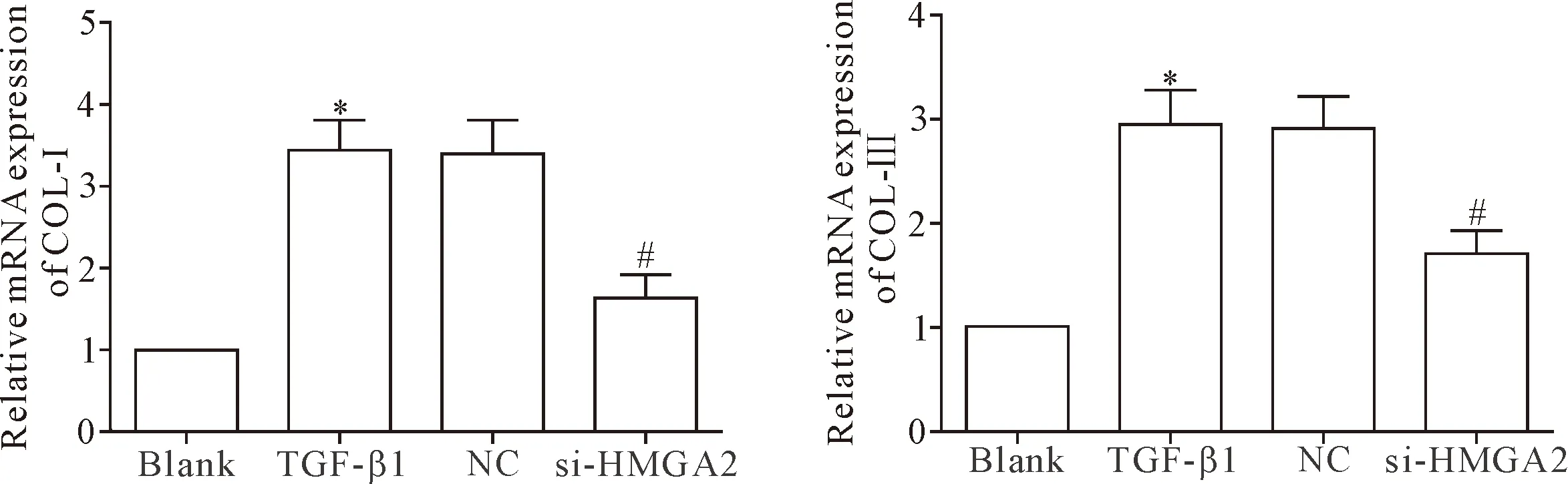
Figure 4.The effect ofHMGA2gene knockdown on the mRNA expression of COL-Ⅰ and COL-Ⅲ in the HELF. Mean±SD.n=3.*P<0.05vsblank group;#P<0.05vsTGF-β1 group.
图4 敲减HMGA2基因的表达对HELF中COL-Ⅰ和COL-Ⅲ mRNA表达的影响
HMGA2编码基因位于12q15染色体,是高迁移率蛋白家族成员之一,可通过蛋白-蛋白或蛋白-DNA作用方式改变染色体结构,使DNA发生剧烈变性,进而直接发挥抑制或促进下游基因表达的作用,也可通过结合于其它的转录因子而间接调节下游基因表达[12-13]。现有研究发现,HMGA2异常表达与多种人类肿瘤密切相关[14-15]。HMGA2在PF中的研究较少。有研究显示,miR-221可靶向HMGA2调控TGF-β1/Smad3诱导的上皮-间充质转化而抑制博来霉素诱导的PF[16]。RNA干扰是一种可特异性敲减靶基因表达的新技术,目前已成为常用的生物学研究手段,在基因功能研究、疾病治疗等方面有广泛的应用[17-18]。有研究显示,使用RNAi技术沉默HMGA2表达可抑制人胚肺成纤维细胞胶原合成[7]。本研究结果显示,用RNAi技术敲减HMGA2的表达可减弱TGF-β1诱导的人胚肺成纤维细胞活力和COL-I和COL-III的mRNA表达,并可促进细胞凋亡,其部分研究结果与前人研究一致。
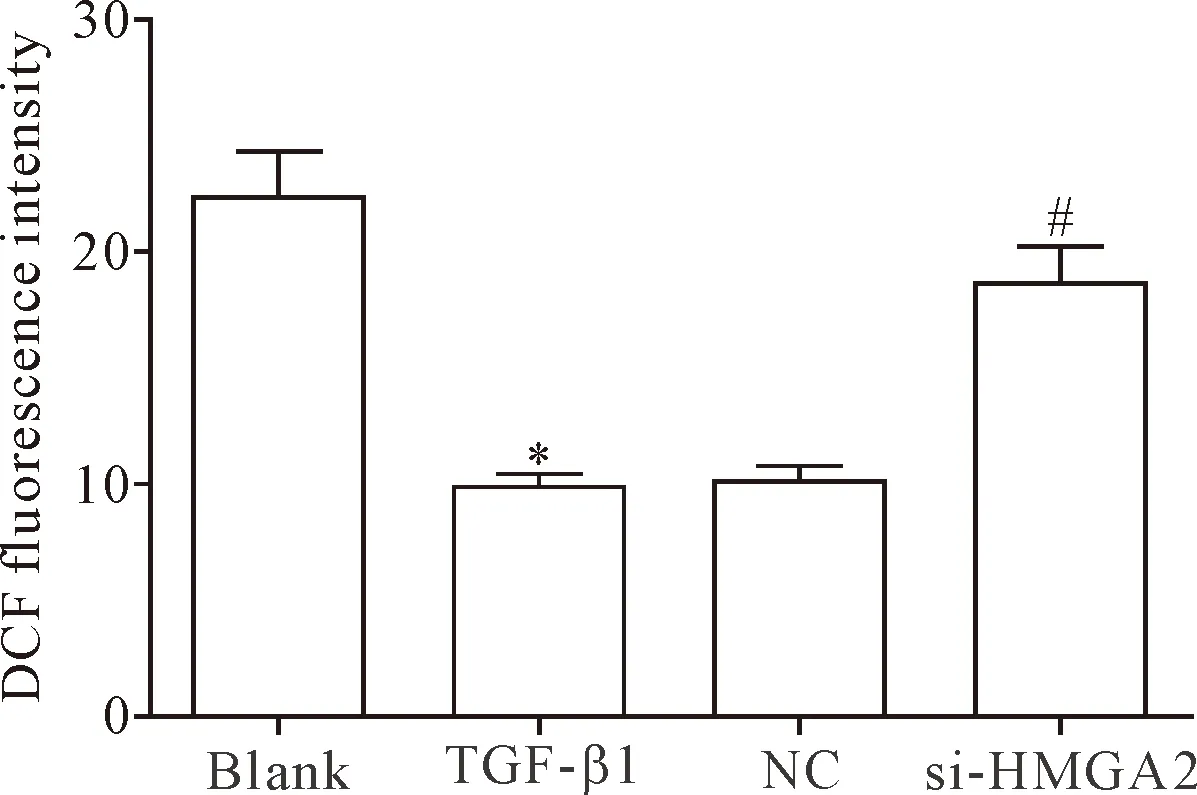
Figure 5.The effect ofHMGA2gene knockdown on ROS content in the HELF. Mean±SD.n=3.*P<0.05vsblank group;#P<0.05vsTGF-β1 group.
图5 抑制HMGA2基因表达对HELF中ROS含量的影响
ROS是机体有氧代谢过程中的副产品之一,其过量产生可导致氧化应激,是引起肿瘤、PF和糖尿病等多种疾病的根源[19-20]。有研究显示,EW-7197可通过阻断TGF-β/SMAD和ROS信号转导抑制肝、肾和肺纤维化[21];抑制PDE5A可通过降低ROS产生及RhoA/Rho激酶激活减弱博莱霉素诱导的肺纤维化和肺动脉高压[22];低剂量镉可通过ROS上调HMGA2 mRNA和蛋白表达,进而上调周期相关蛋白 cyclin D1 表达,引起细胞周期改变而诱导人胚肺成纤维细胞MRC-5 增殖[23]。本研究结果显示,敲减HMGA2的表达可增加TGF-β1诱导的人胚肺成纤维细胞的ROS水平。这提示提高ROS水平可能是HMGA2诱导人胚肺成纤维细胞凋亡的一种途径。
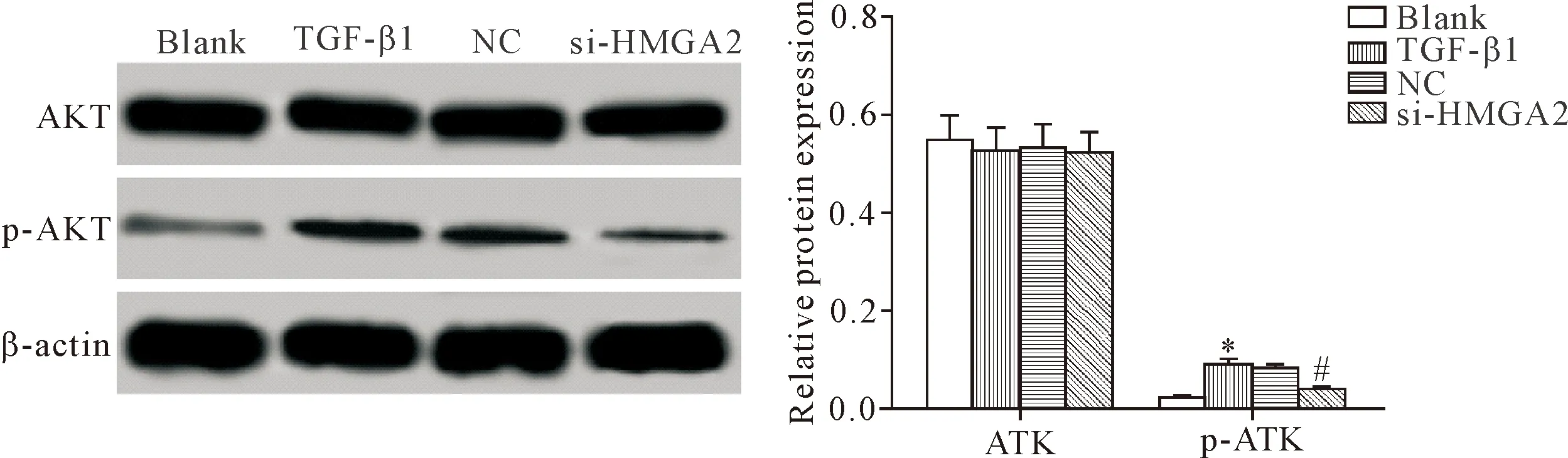
Figure 6.The effect ofHMGA2gene knockdown on the protein levels of p-AKT in the HELF. Mean±SD.n=3.*P<0.05vsblank group;#P<0.05vsTGF β1 group.
图6 敲减HMGA2基因的表达对HELF中p-AKT蛋白水平的影响
PI3K/AKT信号是细胞内一条重要的信号途径,主要由PI3K和AKT分子及下游分子组成,AKT是PI3K信号下游的信号分子,AKT参与促细胞增殖、抑细胞凋亡的调控[24]。有研究表明,TGF-β1可激活PI3K/AKT信号,激活的PI3K/AKT信号可参与细胞增殖、生长等生理过程[25]。抑制PI3K/AKT信号可明显阻断TGF-β1诱导的人胚肺成纤维细胞增殖[26]。本研究结果显示,敲减HMGA2的表达可降低TGF-β1诱导的人胚肺成纤维细胞p-AKT的蛋白水平,提示敲减HMGA2的表达可通过抑制PI3K/AKT信号抑制人胚肺成纤维细胞生长。
综上所述,通过RNAi沉默HMGA2表达可抑制人胚肺成纤维细胞活力和胶原合成,诱导细胞凋亡及ROS产生,从而对PF起抑制作用,机制可能与抑制PI3K/AKT信号有关。提示在PF过程中HMGA2可能是一个有效的治疗靶点。

