Erk1/2 MAP激酶对FGF21调节肝脏脂质代谢的影响*
吴朝明, 郑巨佳, 李芩耀, 潘薛波, 吴 帆, 林灼锋△
(温州医科大学 1附属第二医院, 2药学院,浙江 温州 325035)
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是一种常见的代谢性疾病,其发病机制与机体与肝脏脂质代谢异常密切相关。成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)是一种新型的糖脂代谢调控内分泌因子。我们前期的研究发现,FGF21可通过调控机体肝脏脂质代谢,从而调节小鼠体内脂质稳态[1-2]。然而,FGF21通过何种信号途径发挥其降脂作用尚不明确。细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,Erk1/2)通路参与机体广泛的生理过程中。FGF21能够通过增加Erk1/2磷酸化,增加THP-1巨噬细胞源性泡沫细胞胆固醇外流[3];降低HepG2细胞载脂蛋白的表达[4];刺激下丘脑神经元表达促肾上腺皮质激素释放激素,进而促进长期禁食期间的肝糖异生,维护血糖稳态[5];抑制棕榈酸或高血糖诱导的心肌凋亡[6]。由此可知,Erk1/2 通路在FGF21的生理作用的发挥中起着重要的作用。我们的前期研究表明,FGF21通过过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)信号通路,上调脂肪组织中脂联素的表达和分泌,从而发挥其增加胰岛素敏感性的作用。然而,FGF21是否通过调节Erk1/2而参与肝脏脂质代谢的调控,还有待进一步探索。我们的研究通过腺相关病毒(adeno-associated virus,AAV)介导FGF21过表达及药物抑制Erk1/2等相关实验来证明Erk1/2 在FGF21调节肝脏脂质代谢过程中所扮演的角色。
材 料 和 方 法
1 实验动物
8周龄SPF级雄性C57BL/6J野生型(wild-type,WT)小鼠购自上海南方模式动物中心,体重(19±1.3) g,许可证号为SCXK(沪)2017-0005。饲养环境为室温20~24 ℃, 相对湿度40%~60%,基础饲料由温州医科大学实验动物中心提供,自由摄食饮水,12 h/12 h交替照明。
2 主要试剂
人重组FGF21蛋白、U0126(MEK抑制剂,使Erk1/2失活)和油红染色相关试剂购自Sigma-Aldrich;DMEM液体培养基和胎牛血清购自Gibco;固醇调节元件结合蛋白2(sterol regulatory element binding protein 2,Srebp-2)兔抗鼠多克隆抗体购自Cell Signaling Technology;Trizol、逆转录试剂盒和OneStep RT-PCR试剂盒购自Thermo Fisher Scientific;FGF21 ELISA试剂盒购自香港大学AIS公司;甘油三酯(triglyceride,TG)和总胆固醇(total cholesterol,TC)检测试剂盒购自北京百奥莱博科技有限公司。所用引物由Thermo Fisher Scientific设计合成,见表1。

表1 RT-qPCR实验引物序列
3 主要方法
3.1小鼠的分组及处理 慢性实验取8周龄的WT雄性小鼠24只随机分成4组,给予正常高脂饲料(high-fat diet,HFD)喂养4周,其中正常对照(control)组给予腹腔注射对照病毒AAV-GFP(1×1012pfu/mice)和DMSO;AAV-FGF21组给予腹腔注射AAV-FGF21(1×1012pfu/mice)处理和DMSO;U0126组给予腹腔注射同等剂量对照病毒和U0126(10 mg·kg-1·d-1);AAV-FGF21+U0126组给予AAV-FGF21(1×1012pfu/mice)处理和U0126(10 mg·kg-1·d-1),处理4周以后,处死小鼠,采集血液离心保存血清标本,收集肝脏组织,称重后,一部分固定于OCT组织包埋液中,制作冰冻切片;另一部分置于-80 ℃冰箱中保存。
3.2AAV-FGF21重组构建包装 由于重组人FGF21蛋白在体外的半衰期非常短,因此,我们采用构建AAV-FGF21腺相关病毒表达的模式,进行动物实验研究[7]。AAV-FGF21病毒的构建、纯化和病毒滴度鉴定等实验由武汉维诺赛生物技术有限公司完成。
3.3肝脏组织切片HE染色 肝组织切片干燥后入,采用二甲苯I和II脱蜡,并通过酒精梯度水化、苏木素染色、1%盐酸-乙醇溶液分化、弱氨水返蓝后,再进行伊红染色。然后再进行酒精梯度脱水、二甲苯透明、中性树脂封片,最后进行镜下观察拍照记录。
3.4ELISA检测 按照厂家提供的说明书操作。
3.5RT-qPCR实验 采用Trizol试剂提取组织总RNA,NanoDrop超微量分光光度计测定总RNA含量。取1.0 μg RNA进行一步法RT-PCR,总反应体积20.0 μL。逆转录完成后取1 μL cDNA进行qPCR。扩增条件为:50 °C逆转录30 min;95 ℃初始化15 min;94 °C变性1 min、55 ℃ 1 min、72 ℃ 1 min,40个循环;72 ℃ 10 min。
3.6Western blot实验 提取小鼠肝脏组织总蛋白,BCA 法测定总蛋白浓度。10% SDS-PAGE分离,PVDF 膜印迹,10%脱脂奶粉室温下封闭1 h,加入抗GAPDH 抗体(1 ∶1 000)和抗Srebp-2抗体(1 ∶1 000),4 ℃孵育过夜。用封闭液稀释相应的经辣根过氧化物酶标记的II 抗(1 ∶5 000)37 ℃摇床孵育1 h。洗去多余 II 抗,经ECL 发光液发光、X 光胶片压片后显影、定影。分析胶片灰度值,确定样品中目的蛋白相对含量。
3.7小鼠肝脏细胞原代培养 小鼠肝脏细胞原代培养采用经门静脉酶灌注法进行,即通过小鼠门静脉按照6 mL/min的速度灌注0.05% 胶原酶消化液,当整个肝脏的颜色变白后,停止消化。小心取下整个肝脏,采用细胞scraper和镊子机械分离肝脏,过100 μm筛网,50×g离心5 min,弃上清,台盼蓝染色,查看细胞存活率。用DMEM-A培养液[DMEM,pH 7.4,添加 25 mmol/L 葡萄糖、2 mmol/L 谷氨酰胺、200 nmol/L (R)-N6-(1-methyl-2-phenylethyl) adenosine、100 mg/L庆大霉素和 25 mmol/L HEPES]于37 ℃和5% CO2的条件下培养。
4 统计学处理
用SPSS 16.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 Erk1/2失活对AAV-FGF21抑制HFD喂养小鼠体重增加的影响
体重监测结果显示,HFD喂养4周后给予AAV-FGF21处理能显著抑制HFD引发的小鼠体重异常增加(P<0.05),见图1A。为了探索Erk1/2对FGF21生物学效应的影响,小鼠在给予AAV-FGF21处理的同时,以腹腔注射的方式给予U0126(10 mg·kg-1·d-1)处理。体重监测结果表明,给予U0126处理后,AAV-FGF21抑制体重增加的效应在一定程度上被削弱(P<0.05),见图1B。此外,AAV-FGF21显著降低小鼠肝脏与体重的比值,而同时给予U0126处理后,小鼠肝脏与体重的比值无明显变化,见图1C。这些结果说明,Erk1/2失活在一定程度上影响FGF21降低体重的生物学效应。
2 Erk1/2失活对AAV-FGF21调节小鼠血脂代谢的影响
AAV-FGF21处理不仅显著上调肝脏FGF21的mRNA 表达水平,而且增加血清FGF21的水平(P<0.05),但与U0126处理与否无关,见图2A、B。
在血脂方面,与对照组相比,AAV-FGF21处理后,小鼠血清TG和TC水平明显降低(P<0.05);在U0126处理后,小鼠血清TG和TC水平并无明显的变化,此外,同时给予U0126和AAV-FGF21处理后,血清TG和TC水平出现下降的趋势,但幅度明显减小,见图2C、D。这些结果表明,Erk1/2 部分介导了FGF21调节血脂代谢过程。
3 Erk1/2失活对AAV-FGF21调节小鼠肝脏脂质代谢的影响
组织形态学HE染色结果显示,与对照组相比,AAV-FGF21处理4周后,肝脏组织的空泡数量明显减少;在单纯U0126处理组以及同时U0126和AAV-FGF21处理组中,小鼠肝脏组织的空泡数量则无明显变化,见图3A。
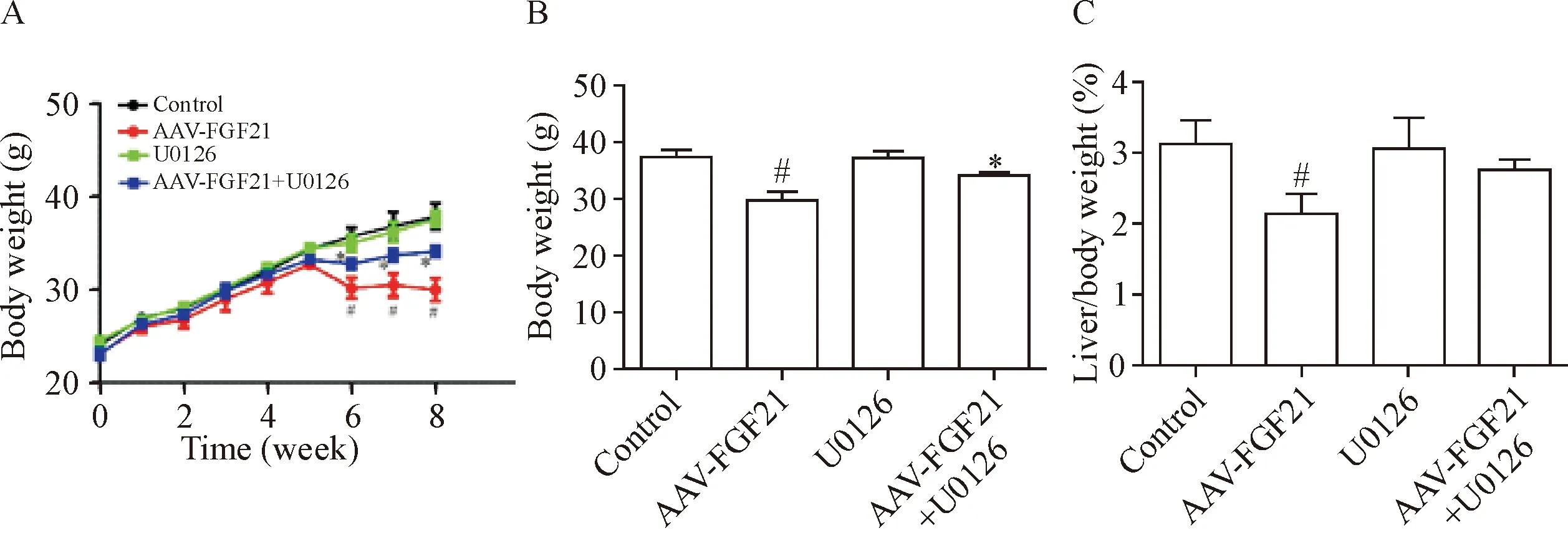
Figure 1.Body weight and liver weight of mice treated with AAV-FGF21 and/or U0126. A: the growth curve of body weight in mice; B: body weight at the end-point; C: the ratio of body weight to liver weight. Mean±SD.n=6.#P<0.05vscontrol group;*P<0.05vsAAV-FGF21 group.
图1 AAV-FGF21和U0126处理后HFD喂养小鼠体重和肝重的变化情况

Figure 2.Serum triglyceride (TG) and total cholesterol (TC) levels in the mice treated with AAV-FGF21 and/or U0126. A and B: the circulating FGF21 levels and the mRNA levels of hepatic FGF21 in the mice treated with AAV-FGF21 and/or U0126; C: serum TG levels; D: serum TC levels. Mean±SD.n=6.#P<0.05vscontrol group;*P<0.05vsAAV-FGF21 group.
图2 AAV-FGF21处理小鼠后血脂水平的变化
与组织形态学分析结果一致,肝脏组织脂质含量分析结果也表明,与对照组相比,AAV-FGF21处理后,肝脏组织TG(liver TG,L-TG)、TC(liver TC,L-TC)和游离脂肪酸(liver free fatty acid,L-FFA)的含量明显下调(P<0.05);而单纯U0126处理组以及U0126+AAV-FGF21处理组中L-TG、L-TC和L-FFA含量与对照组相比差异无统计学显著性,见图3B~D。

Figure 3.Blockage of Erk1/2 attenuated the effect of AAV-FGF21 on hepatic lipid deposition in the mice. A: representative images of the morphological changes of hepatic tissues evaluated by HE staining (×100); B: liver triglyceride (L-TG) levels; C: liver total cholesterol (L-TC) levels; D: liver free fatty acid (L-FFA) levels. Mean±SD.n=6.#P<0.05vscontrol group;*P<0.05vsAAV-FGF21 group.
图3 Erk1/2失活对AAV-FGF21降低小鼠肝脏脂质堆积的影响
上述结果表明,AAV-FGF21处理能显著降低高脂饮食引发的肝脏脂质堆积,而Erk1/2在此过程中扮演着重要的角色。
4 Erk1/2失活对AAV-FGF21调节小鼠肝脏胆固醇代谢及转化相关基因表达的影响
AAV-FGF21处理4周后,小鼠肝脏脂肪酸合成基因乙酰辅酶A羧化酶α(acetyl coenzyme A carbo-xylase alpha,Acaca)的mRNA表达无明显的变化,见图4A。而小鼠肝脏脂肪酸β氧化相关的乙酰辅酶A羧化酶β(acetyl coenzyme A carboxylase beta,Acacb)的表达水平则显著上调(P<0.05);给予U0126处理后,Acaca的表达无明显变化,而Acacb的上调幅度明显被抑制(P<0.05),见图4B。这些结果表明AAV-FGF21处理后可能有助于促进小鼠肝脏脂质氧化代谢,加速脂质利用。
在肝脏脂脂质转运调控方面,AAV-FGF21处理4周后,肝脏组织中胆固醇转运调控因子腺苷三磷酸结合盒转运体G亚家族成员5(ATP-binding cassette transporter subfamily G member 5, ABCG5)和ABCG8的mRNA表达水平明显上调(P<0.05);而给予U0126处理后,这种趋势在一定程度上被抑制(P<0.05),见图4C、D。此外,在胆固醇合成和分解代谢方面,给予AAV-FGF21处理后,胆固醇合成主要调控基因Srebp-2的mRNA表达水平均明显下调,而胆汁酸合成调节基因胆固醇7α-羟化酶(cholesterol 7 alpha-hydroxylase,Cyp7a1)的mRNA表达水平则显著上升(P<0.05);在给予U0126共同处理后,肝脏Srebp-2和Cyp7a1的表达水平在一定程度上被显著抑制(P<0.05),见图4E、F。
上述结果表明,AAV-FGF21处理能显著加速肝脏脂质氧化、分解和转运相关基因的表达,从而降低肝脏脂质堆积状况;而Erk1/2可能直接或间接参与了这一调控过程。
5 Erk1/2失活对AAV-FGF21调节HFD引发小鼠肝脏炎症的影响
AAV-FGF21处理4周后,肝脏组织中的炎症因子IL-1β、TNF-α和MCP-1的mRNA表达水平明显降低(P<0.05),而给予U0126处理后,这种下调的趋势在一定程度上被抑制,见图5。这些结果表明,AAV-FGF21处理能抑制肝脏组织炎症细胞因子的表达,而Erk1/2参与了这一调节过程。
6 Erk1/2 激酶失活对 FGF21 抗小鼠脂肪肝病变的分子作用机制
与动物结果一致,重组FGF21蛋白呈现剂量和时间依赖性的抑制原代培养肝细胞Srebp-2的mRNA和蛋白的表达,见图6A、B。相似的,给予单一剂量(50 μg/L)重组FGF21蛋白进行处理,原代培养小鼠肝细胞Srebp-2的mRNA和蛋白表达水平均明显被抑制(P<0.05);而同时给予U0126和重组FGF21蛋白处理后,原代培养的小鼠肝细胞中Srebp-2的mRNA水平的下调趋势明显被抑制,见图6C、D。这些结果提示,Erk1/2信号在一定程度上介导了FGF21调节肝细胞Srebp-2基因表达的生物学效应。

Figure 4.Inhibition of Erk1/2 attenuated the effect of FGF21 on the expression of hepatic lipid metabolic genes in the mice. A: Acaca; B: Acacb; C: ABCG5; D: ABCG8; E: Srebp-2; F: Cyp7a1. Mean±SD.n=6.#P<0.05vscontrol group;*P<0.05vsAAV-FGF21 group.
图4 Erk1/2失活对AAV-FGF21降低小鼠肝脏脂质代谢调控基因表达的影响

Figure 5.Inactivation of Erk1/2 blocked the anti-inflammatory effect of FGF21 in the liver tissues of the mice. The mRNA expression levels of TNF-α (A), MCP-1 (B) and IL-1β (C) were showed. Mean±SD.n=6.#P<0.05vscontrol group;*P<0.05vsAAV-FGF21 group.
图5 Erk1/2失活对FGF21抑制小鼠肝脏炎症因子表达的影响
讨 论
FGF21是一个约210个氨基酸序列组成的,主要由肝脏细胞表达的分泌蛋白[8-10]。不同于传统的其它FGF家族成员,其主要以内分泌荷尔蒙因子的角色参与机体的物质代谢调控作用[8]。目前研究认为,FGF21是一个重要的调节糖脂代谢的激素,并在治疗肥胖及糖尿病相关疾病中有着广泛的潜力[11]。在禁食状态、高脂饮食或低碳水化合物生酮饮食条件下,肝脏中,FGF21在调节小鼠肝脏的脂肪酸氧化中起重要作用,可减少脂毒性饮食小鼠肝脏的脂质沉积,使其肝功能正常化,减少肝脏纤维化和炎症[11-13]。目前,已有临床试验显示聚乙二醇-FGF21可持续改善非酒精性脂肪性肝炎的肝脏脂肪变、肝脏损伤和纤维化。
丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)家族是细胞内的一类丝氨酸/苏氨酸蛋白激酶,主要包括生长因子引发的Erk1/2以及压力应激引发的p38 MAPK和c-Jun氨基末端激酶(c-Jun NH2-terminal kinase,JNK)JNK等家族成员,调控细胞的生长增殖、存活和炎症[14]。在诸如肥胖症,2型糖尿病和非酒精性脂肪肝病的病理生理条件下,MAPKs参与调控肝脏的脂质和葡萄糖代谢[15]。有研究显示,HepG2细胞暴露于Erk1/2途径抑制剂诱导单不饱和脂肪酸和脂肪酸去饱和指数的增加和多不饱和脂肪酸含量的降低,HepG2细胞的细胞脂肪酸组成似乎受到Erk1/2通路的差异调节[16]。Erk1/2的激活可通过刺激自噬和自噬相关蛋白7(auto-phagy-related protein 7,ATG7)依赖性自噬改善瘦素受体缺陷(db/db)小鼠的肝脂肪变性[17]。抑制Erk1/2的活化可上调二脂酰基甘油脂酰基转移酶2(diglyceride acyltransferase 2,DGAT2),从而参与酒精性脂肪肝的发生发展[18]。由此可见,Erk1/2参与调控肝脏脂质代谢。前面已述,FGF21可通过Erk1/2通路发挥其生理作用。我们的前期研究发现,重组人FGF21蛋白处理后显著上调Erk1/2活性[19]。那么,FGF21是否可通过调控Erk1/2,进而激活下游相关靶基因的活性,最终发挥其调节肝脏脂质代谢的作用,这有待于进一步探索。

Figure 6.Inhibition of Erk1/2 blocked the FGF21-induced decrease in Srebp-2 expression in the primarily cultured hepatocytes. A and C: the protein expression of Srebp-2 was determined by Western blot; B and D: the mRNA expression levels were tested by real-time quantitative PCR. Mean±SD.n=5.#P<0.05vscontrol group;*P<0.05vsFGF21 group.
图6 Erk1/2介导FGF21抑制肝细胞Srebp-2的表达
本实验结果显示,AAV-FGF21处理能显著降低小鼠肝脏脂质堆积,抑制胆固醇合成调控基因表达,增加脂肪酸氧化、胆固醇转运、分解代谢、胆汁酸合成等相关基因的表达;然而,在Erk1/2失活后,这些效应均在一定程度上被抑制或降低。这些结果表明,Erk1/2在FGF21调节肝脏脂质代谢过程中扮演着重要的角色。此外,我们的体外研究也进一步证实,重组FGF21能剂量和时间依赖地抑制胆固醇生成的主要调控基因Srebp-2的表达;然而,给予U0126抑制Erk1/2活性后,这些效应被显著抑制。这些结果表明,Erk1/2介导了FGF21调节Srebp-2的表达生物效应。
综上所述, FGF21具有改善机体肝脏脂质代谢的生物功能,Erk1/2部分介导了FGF21调节肝脏脂质代谢的生物学效应。

