氧化苦参碱干预砷致肝星状细胞活化中细胞自噬的研究*
马子华, 张景允, 杨 柳, 田 甜, 汤 雷, 郑 璐, 蔡 爽, 韩 冰, 谢汝佳, 杨 婷, 杨 勤
(贵州医科大学病理生理学教研室, 贵州省常见慢性疾病发病机制及药物研究重点实验室, 贵州 贵阳 550000)
慢性砷(arsenic,As)暴露可引发肝脏、皮肤、心血管、胃肠道以及神经系统等相关疾病[1-2],肝是砷毒性作用的主要靶器官[3]。印度加尔各达饮水型砷中毒76.6%患者发生肝脏肿大[4];贵州省燃煤型砷中毒患者中约28.6%死于肝硬化[5];流行病学研究结果也表明肝硬化和肝癌是砷中毒患者主要的死亡原因[6];张露露等[7]观察砷可以诱导大鼠发生肝纤维化。肝纤维化是肝硬化的早期阶段,并且有研究表明,肝硬化在肝纤维化阶段有逆转的可能[8]。但目前仍缺乏干预砷致肝损伤的临床治疗药物,因此深入研究砷致肝纤维化发病机制及药物干预治疗对砷中毒肝硬化防治有重要意义。
氧化苦参碱(oxymatrine, OM)是一种豆科植物提取物,具有抗病毒和抗肿瘤等功效。已有研究表明OM对心肌纤维化有一定的干预治疗效果[9]。最近临床研究表明观察到氧化苦参碱对慢性病毒性肝炎有一定的疗效[10];还有学者用OM作用于肝癌细胞后,检测到其可以通过影响细胞的能量代谢而抑制细胞增殖[11];我们前期研究也检测到OM对砷致肝细胞损伤有一定的保护作用,但其中机制尚不清楚。
肝星状细胞(hepatic stellate cells, HSC)的活化是肝纤维化发生及发展过程中的关键环节[12]。各种损伤因素可通过直接或者间接作用引起HSC激活和增殖,合成并分泌细胞外基质增多,导致大量细胞外基质(extracellular matrix, ECM)在肝内沉积而发生肝纤维化[13]。细胞自噬是真核细胞重要的降解/回收系统,通过降解异常多余的蛋白质以及受损细胞器,实现细胞器的更新以及营养物质的回收利用,在维持细胞稳态中发挥着重要的作用。已有研究表明,细胞自噬参与了多种疾病的病理过程。有学者观察到在多种肝脏疾病的病理过程中有细胞自噬的参与,例如病毒性肝炎、酒精性肝炎和急性肝损伤等[14-15]。但有关砷致肝损伤和肝纤维化发生中细胞自噬的变化国内外尚不清楚,OM干预砷致肝纤维化过程中对HSC自噬的研究也未见相关报道。为此,本实验拟用人肝星状细胞株LX-2为研究对象,观察染砷损伤肝细胞培养上清对人肝星状细胞株LX-2细胞活性及自噬相关蛋白表达的影响,探讨细胞自噬在砷致HSC活化中的作用,并观察OM改善肝纤维化的可能机制。
材 料 和 方 法
1 材料
人肝星状细胞株LX-2(中国科学院上海生科院细胞资源中心);人胎肝细胞株LO2(中国科学院昆明细胞库)。亚砷酸钠(分析纯,Sigma);氧化苦参碱(分析纯,南京广润生物制品有限公司);抗α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、自噬相关基因12(autophagy-related gene 12,Atg12)、自噬相关基因5(autophagy-related gene 5,Atg5)、微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)和β-肌动蛋白(β-actin)Ⅰ抗(Abcam);MTT和DMSO(北京索莱宝科技有限公司);转化生长因子β1(transforming growth factor-β1,TGF-β1) ELISA Kit(武汉华美生物工程有限公司)。全自动生化分析仪(Olympus);全波长酶标仪(Thermo);垂直电泳仪(北京六一生物科技有限公司); 凝胶成像系统(BIO-RAD)。
亚砷酸钠染毒溶液的配制:精密称取适量亚砷酸钠溶于无菌磷酸盐缓冲液(phosphate-buffered saline,PBS)中,过0.22 μm微孔滤膜制成亚砷酸钠母液;染毒时稀释使用。
氧化苦参碱溶液的配制:精密称取适量氧化苦参碱溶于无菌PBS中,过0.22 μm微孔滤膜制成氧化苦参碱母液;使用时进行稀释。
2 方法
2.1细胞培养 人胎肝细胞株LO2用含10%胎牛血清的DMEM培养液置于37 ℃、CO2体积分数为5%的培养箱培养。
人肝星状细胞株LX-2用含10%胎牛血清的DMEM培养液置于37 ℃、CO2体积分数为5%的培养箱培养。
2.2亚砷酸钠上调LX-2细胞活性
2.2.1全自动生化分析仪检测染砷LO2细胞培养上清天冬氨酸氨基转移酶(aspartate aminotransferase,AST)和丙氨酸氨基转移酶(alanine ami-notransferase,ALT)水平 100 μmol/L亚砷酸钠染毒LO2细胞24 h,细胞融合率达80%收取染砷LO2培养上清,低温离心取上清,一部分使用全自动生化分析仪检测AST和ALT水平,另一部分置于-80 ℃保存备用。
2.2.2MTT法检测LX-2细胞活力 取对数期的LX-2细胞制成单细胞悬液,以每孔5 000个细胞均匀接种于96孔板中。将LX-2细胞分为对照组、LO2培养上清组及5%、10%、20%和30%染砷组,同时设置空白组,每组设置5个复孔。待细胞融合率达65%左右时,进行处理。将LO2正常培养上清与正常培养液按照3∶7比例混合后培养正常上清组LX-2细胞24 h,5%、10%、20%和30%染砷上清组分别按照相应比例与正常培养液混合后培养各组LX-2细胞24 h。弃培养液,加入MTT(5 g/L)每孔20μL后培养4 h。弃培养液,每孔加入150 μL DMSO于37 ℃显色10 min。酶标仪492 nm波长检测吸光度(A)值。细胞相对活力(%)=(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%。
2.2.3ELISA检测染砷LO2细胞培养上清TGF-β1 细胞培养及提取上清同上。加样37 ℃孵育2 h,弃液体,生物素标记抗体工作液37 ℃孵育1 h。弃液体并洗板甩干。辣根过氧化物酶标记亲和工作液37 ℃孵育1 h。弃液体并洗板甩干。底物溶液37 ℃避光显色20 min后加入终止液,5 min内450 nm波长测量吸光度(A)值。
2.2.4Western blot检测LX-2细胞活化情况 将细胞随机分为对照组、LO2培养上清组、5%、10%和20%染砷组,培养方法同上。提取蛋白,10% SDS-PEGA蛋白分离,转膜,封闭,加入Ⅰ抗[β-actin(1 ∶500)和α-SMA(1 ∶5 000)],4 ℃孵育过夜。次日用TBST洗膜后加入Ⅱ抗(1 ∶4 000)室温孵育1.5 h,TBST洗膜,ECL显示特异性的条带。
2.2.5分析间接染砷对LX-2细胞活性的影响 综合2.2.2和2.2.4实验结果,筛选出各间接染砷组中促进LX-2细胞活化最为显著的浓度,将此浓度作为后续实验间接染砷组的药物浓度。
2.3氧化苦参碱干预上调LX-2细胞活性
2.3.1MTT检测不同浓度OM处理后LX-2细胞活力的变化 取对数期的LX-2细胞制成单细胞悬液,以每孔5 000个均匀接种于96孔板中。将细胞分为对照组、间接染砷组及0.1、0.25、0.5、1和1.5 g/L OM干预组,同时设置空白组,每组设置5个复孔。待细胞融合率达65%左右时,进行处理。采用20%染砷上清组培养方法培养间接染砷组及0.1、0.25、0.5、1和1.5 g/L OM干预组24 h。弃培养液,对照组和间接染砷组正常培养,各浓度OM干预组加入相应浓度OM培养24 h。弃培养液,加入MTT(5 g/L)后培养4 h。弃培养液,每孔加入150μL DMSO于37 ℃显色10 min。酶标仪492 nm波长检测吸光度(A)值。细胞相对活力(%)=(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%。
2.3.2Western blot检测活化标志蛋白及自噬相关蛋白 将细胞随机分为对照组、间接染砷组、低剂量(0.25 g/L)OM干预组和高剂量(1 g/L)OM干预组。细胞融合率达65%时处理细胞,处理方法同2.3.1。收集细胞,提取蛋白。10%、15%SDS-PEGA蛋白分离,转膜,封闭,加入Ⅰ抗[β-actin(1∶500)、α-SMA(1∶5 000)、Atg12(1∶3 000)、Atg5(1∶5 000)和LC3(1∶3 000)],置4 ℃孵育过夜。次日用TBST洗膜后加入Ⅱ抗(1∶4 000)室温孵育1.5 h,TBST洗膜,ECL显示特异性条带。
2.3.3光学显微镜观察油红O染色 细胞分组及培养同2.3.2。弃培养液,4%多聚甲醛固定45 min后PBS漂洗,油红O染色1 h,60%异丙醇漂洗10 s,PBS漂洗。
4 统计学处理
实验数据以均数±标准差(mean±SD)表示。用SPSS 17.0统计软件进行单因素方差分析。以P<0.05为差异具有统计学意义。
结 果
1 亚砷酸钠染毒LO2细胞培养上清中AST和ALT水平
100 μmol/L亚砷酸钠作用于LO2细胞24 h,细胞融合率达80%时检测培养上清中AST和ALT水平,结果显示染砷组LO2培养上清中ALT和AST水平显著高于对照组(P<0.05),见表1。
表1 亚砷酸钠作用于LO2细胞24 h后培养上清中AST和ALT活性的变化
Table 1.The levels of AST and ALT in medium of LO2 cultured with arsenic for 24 h (Mean±SD.n=3)

NaAsO2 (μmol/L)AST (U/L)ALT (U/L)010.41±0.665.24±0.3410060.50±0.77*25.74±0.88*
*P<0.05vs0 μmol/L group.
2 亚砷酸钠间接增强LX-2细胞活力及活化标志蛋白α-SMA的表达
将未染砷LO2细胞培养上清按照3 ∶7比例与正常培养液混合后培养LX-2细胞,染砷LO2细胞培养上清按5%、10%、20%和30%浓度加入LX-2细胞培养体系中,我们观察到,与对照组相比较,LO2细胞培养上清组及5%和10%染砷组细胞活力和活化标志蛋白α-SMA表达水平均无显著差异;20%染砷组与对照组相比较,细胞活力显著增强(P<0.05),活化标志蛋白α-SMA表达水平显著上调(P<0.05);30%染砷组与对照组相比较,细胞活力显著下降(P<0.05),见表2、图1。
表2 不同浓度染砷LO2培养上清刺激后LX-2细胞活力的变化
Table 2.The effect of arsenic on the viability of LX-2 cells (%.Mean±SD.n=3)
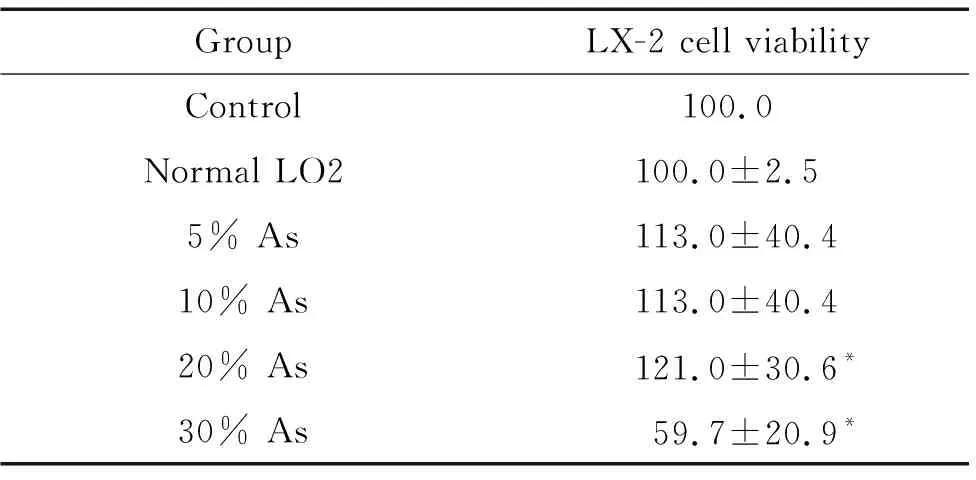
GroupLX-2 cell viabilityControl100.0Normal LO2100.0±2.55% As113.0±40.410% As113.0±40.420% As121.0±30.6*30% As59.7±20.9*
*P<0.05vscontrol group.
根据实验结果分析,20%染砷组药物刺激LX-2细胞活化的作用显著,因此将此浓度作为后续实验间接染砷的浓度。
3 染砷LO2细胞培养上清中TGF-β1水平
100 μmol/L亚砷酸钠染毒LO2细胞24 h,细胞融合率达80%培养上清中TGF-β1水平较对照组无显著差异且呈阴性,见表3。
4 氧化苦参碱干预对间接染砷LX-2细胞活力的影响
不同浓度OM干预间接染砷LX-2细胞24 h,在浓度为0.1~1.5 g/L 范围内,LX-2细胞活力呈浓度依赖性下降(P<0.05),见表4。
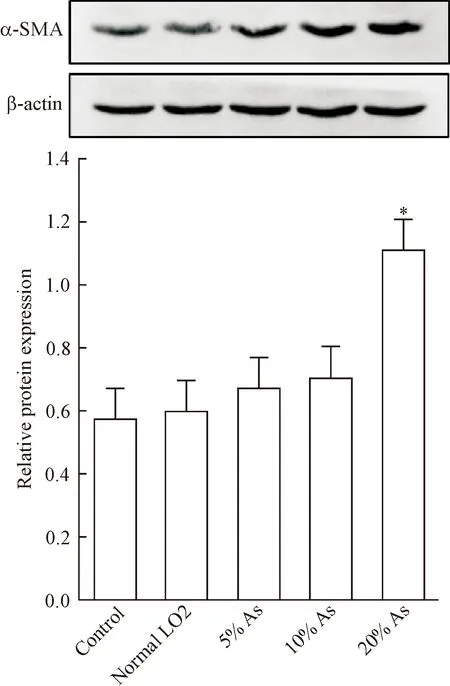
Figure 1.The protein expression of α-SMA in LX-2 cells cultred with different concentrations of arsenic. Mean±SD.n=3.*P<0.05vscontrol group.
图1 不同浓度染砷LO2培养上清刺激LX-2细胞对α-SMA表达影响
表3 染砷LO2培养上清中TGF-β1水平
Table 3.The level of TGF-β1 in medium of LO2 cells cultured with arsenic (Mean±SD.n=3)

GroupA valueTGF-β1Normal LO20.116±0.202-As LO20.121±0.235-
-: negative.
表4 不同浓度OM对LX-2细胞活力的影响
Table 4.The effect of OM on the viability of LX-2 cells (%. Mean±SD.n=3)
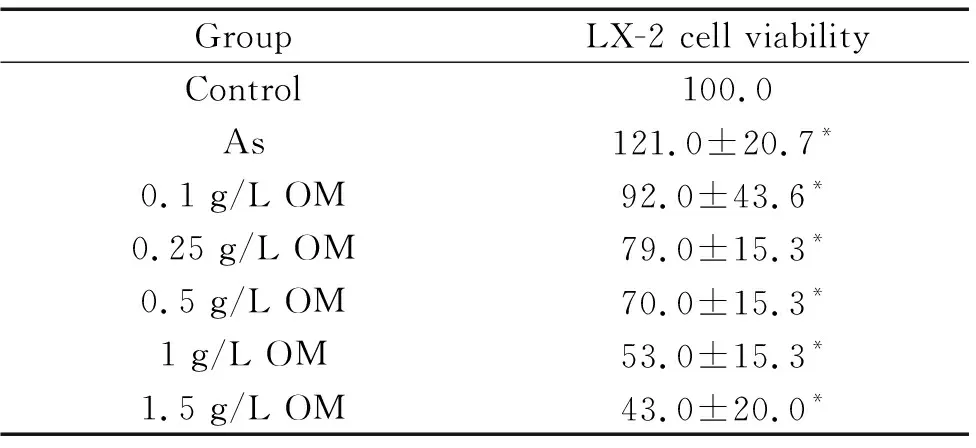
GroupLX-2 cell viabilityControl100.0As121.0±20.7*0.1 g/L OM92.0±43.6*0.25 g/L OM79.0±15.3*0.5 g/L OM70.0±15.3*1 g/L OM53.0±15.3*1.5 g/L OM43.0±20.0*
*P<0.05vscontrol group.
其中0.25和1 g/L OM干预组细胞相对活力分别约为80%和50%,后续实验将0.25和1 g/L设为低、高剂量OM干预组药物浓度。
5 氧化苦参碱干预对砷损伤肝细胞后间接刺激LX-2细胞活化过程中活化标志蛋白和细胞自噬相关蛋白表达水平的影响
与对照组相比较,间接染砷组α-SMA、Atg12、Atg5和LC3-Ⅱ表达水平显著上调(P<0.05);低、高剂量OM干预后LX-2细胞α-SMA、Atg12、Atg5和LC3-Ⅱ较间接染砷组显著下调(P<0.05),且高剂量OM干预组LC3-Ⅱ蛋白表达水平较低剂量OM干预组显著下调(P<0.05),见图2。

Figure 2.The protein expression of α-SMA, Atg12, Atg5 and LC3-Ⅱ in activated LX-2 cells cultred with different concentrations of OM. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsAs group;△P<0.05vslow-dose OM group.
图2 OM干预对间接染砷LX-2细胞的α-SMA、自噬相关蛋白表达的影响
6 氧化苦参碱干预对砷损伤肝细胞后间接刺激LX-2细胞过程中脂滴变化的影响
与对照组相比,间接染砷组脂滴显著减少,而低、高剂量OM干预组脂滴数量较间接染砷组显著增加,见图3。

Figure 3.Lipid droplets in LX-2 cells were observed by oil red O staining. Scale bar=100 μm. A: control group; B: As group; C: low-dose OM group; D: high-dose OM group.
图3 各组油红O染色脂滴
讨 论
砷致肝纤维化的发病机制目前尚不清楚,特别是砷致HSC活化的机制是砷的直接还是间接作用国内外尚无定论。本项工作采用100 μmol/L亚砷酸钠染毒LO2细胞24 h,观察砷致肝细胞损伤后对LX-2细胞活化及自噬相关蛋白表达的影响。在本实验中,染砷24 h LO2细胞培养上清中AST和ALT含量较正常培养LO2细胞显著增高,AST和ALT是肝细胞损伤的敏感指标,提示100 μmol/L亚砷酸钠染毒24 h后存在LO2细胞损伤。使用染砷LO2细胞培养上清按照1 ∶4比例与正常培养液混合后共孵育LX-2细胞24 h后,检测到其细胞增殖率及活化标志蛋白α-SMA表达水平均显著上调,提示砷可通过损伤肝细胞间接促进HSC活化。因此,减轻砷致肝细胞损伤应该是改善砷致肝纤维化的有效途径之一。
细胞自噬是细胞通过溶酶体降解自身错误、异常蛋白或细胞器以维持细胞稳态的代谢过程。自噬体膜的延伸以及闭合主要依赖2个泛素系统,即Atg12和LC3,其中Atg12与Atg5结合后形成Atg12-Atg5复合物,此复合物是自噬泡的双层骨架结构。目前,细胞自噬相关的研究主要集中在LC3这一系统中,但对于Atg12这一泛素化系统研究甚少。研究表明,细胞自噬发生时,LC3-Ⅱ表达水平显著上调[16],故现阶段多将LC3-Ⅱ表达水平的变化作为判断细胞自噬发生的标准。Virginia等[17]检测到在HSC活化过程中LC3-Ⅱ的表达显著升高,提示细胞自噬参与了HSC活化,但在此活化过程中Atg12系统的变化并未观察。本研究在染砷间接活化LX-2细胞后,不仅观察了LC3-Ⅱ的表达变化,还检测了Atg12和Atg5表达水平的变化。我们检测到间接染砷组LX-2细胞除了α-SMA表达水平显著增加外,自噬相关蛋白Atg12、Atg5和LC3-Ⅱ表达水平均显著上调,提示细胞自噬Atg12和LC3 2个泛素化系统均参与了砷间接致HSC活化的过程。使用低、高剂量OM干预间接染砷活化的LX-2细胞24 h后,检测到低、高剂量OM干预组细胞活力、活化标志蛋白α-SMA以及自噬相关蛋白Atg12、Atg5和LC3-Ⅱ表达水平较间接染砷组均显著下调,且高剂量OM干预组LX-2细胞的自噬标志蛋白LC3-Ⅱ表达水平下降较低剂量OM干预组更为显著,提示低、高剂量OM干预均可抑制间接染砷致HSC活化,且可能与干预细胞自噬的过程有关。
Wallace等[18]提出在HSC活化的过程中,肝细胞发生氧化应激损伤分泌的细胞因子、肝细胞的凋亡小体、内皮细胞分泌的TGF-β等可促进HSC激活。为明确间接染砷活化HSC的原因,我们进一步用ELISA对染砷LO2培养上清中TGF-β1的含量进行检测,但并未观察到染砷LO2培养上清中TGF-β1的水平较对照组有显著变化,提示在染砷损伤肝细胞间接致HSC活化及影响细胞自噬的机制中可能与TGF-β1并无直接关系。
近年来,有研究认为细胞自噬可降解储存在HSC细胞内的脂滴,从而为HSC活化提供能量[17,19]。本研究以油红O染色观察染砷间接致HSC活化及OM干预后细胞内脂滴的变化。我们观察到染砷间接活化LX-2细胞内的脂滴数量较对照组细胞显著减少,而经低、高剂量OM干预24 h后LX-2细胞内脂滴数量较间接染砷组显著增多,提示染砷间接活化HSC细胞中的细胞自噬水平显著增加,有可能通过降解储存在HSC细胞中的脂滴为活化提供能量,促进HSC活化,而OM干预可能通过抑制这一过程达到减少HSC活化、减轻肝纤维化的效果。

