喉咽癌组织中肿瘤相关巨噬细胞浸润与肿瘤预后的关系*
周旭峰 李江华 张爱华 魏晓丽 范宗宪 王桂梅 孙海燕
肿瘤相关巨噬细胞(tumor-associated macrophages,TAM)是血液循环中的单核细胞受肿瘤微环境中细胞因子和趋化因子作用,进人肿瘤微环境后分化而成的成熟巨噬细胞,是浸润在肿瘤组织周围最多的免疫细胞,它可以分泌多种细胞因子,促进肿瘤的侵袭和转移[1,2]。本研究采用免疫组化方法检测TAM及微淋巴管在喉咽癌组织的表达情况,从而探讨TAM浸润在喉咽癌侵袭和发展中的作用及其与肿瘤预后的关系。
资料与方法
1 一般资料
随机抽取2004年1月~2013年12月间,在佳木斯大学附属第一医院耳鼻咽喉科接受手术的喉咽癌52例。其中男47例,女5例,年龄43~79岁,平均57岁。所有病例术前未行放化疗,标本经病理确诊,其中T1期4例、T2期15例、T3期10例、T4期23 例;高、中、低分化病例分别为 9、30、13 例;其中淋巴结转移者 21 例(N1、N2、N3分别为 7、13、1 例),无淋巴结转移31例;有远处转移9例。
2 主要免疫试剂及方法
DAB显色试剂盒、PV-6000免疫组化试剂盒、CD68兔抗人单克隆抗体等主要试剂购自福建迈新生物科技公司。标本石蜡包埋,做4um连续切片,免疫组化操作程序严格按照说明书执行,以PBS液代替一抗做阴性对照。
3 计数方法
CD68阳性表达位于巨噬细胞胞浆,呈黄褐色颗粒。每张免疫组化切片分别选取癌内及癌周不同组织CD68+TAM最为密集的5个视野,在400倍显微镜下进行CD68+TAM计数,根据CD68+TAM的中位数将标本分为高表达组和低表达组[3]。
4 统计学处理
采用SPSS 21.0软件进行数据分析,行方差齐性检验、t检验、χ2检验和Spearman相关分析,应用Kaplan-Meier进行生存分析和Log-rank法检验组间差异,以P<0.05为差异有统计学意义。
结果
1 喉咽癌组织CD68+TAM表达
喉咽癌组织CD68+TAM主要分布于癌内及癌周间质,呈片状分布,胞体较大,形状不规则。52例喉咽癌标本中37例(71.51%)癌内存在CD68+TAM浸润,41例癌周存在CD68+TAM浸润,差异无统计学意义,癌内CD68+TAMs数目为0至331之间(中位数为11.5个),癌周间质CD68+TAM数目从0至347个(中位数为20.5个)。
癌旁正常组织CD68+TAM呈散在分布,数目从0至7个(中位数为2.5个)。
2 癌内及癌周间质与癌旁正常组织CD68+TAM比较
癌内与癌旁正常组织CD68+TAM计数有明显差异(t=19.63,P<0.01),癌周间质与癌旁正常组织CD68+TAM 计数有明显差异(t=20.17,P<0.01),癌内及癌周间质CD68+TAM计数无明显差异(t=2.19,P>0.05)。
3 癌内及癌周CD68+TAM计数与患者生存时间的关系
随着喉咽癌组织癌内CD68+TAM计数上升,患者生存时间变短,二者之间呈负相关,(r=-0.257,P<0.05);同样随着癌周间质CD68+TAM计数上升,患者生存时间变短,二者亦呈负相关(r=-0.269,P<0.05)。
4 癌内及癌周间质CD68+TAM浸润与喉咽癌临床指标的关系
癌内及癌周间质CD68+TAM浸润与临床指标的关系见表1。喉咽癌癌内TAM计数随肿瘤T分期上升而增加,并与肿瘤不良预后密切相关(P<0.05),而癌周间质TAM计数与淋巴结转移密切相关(P<0.05)。
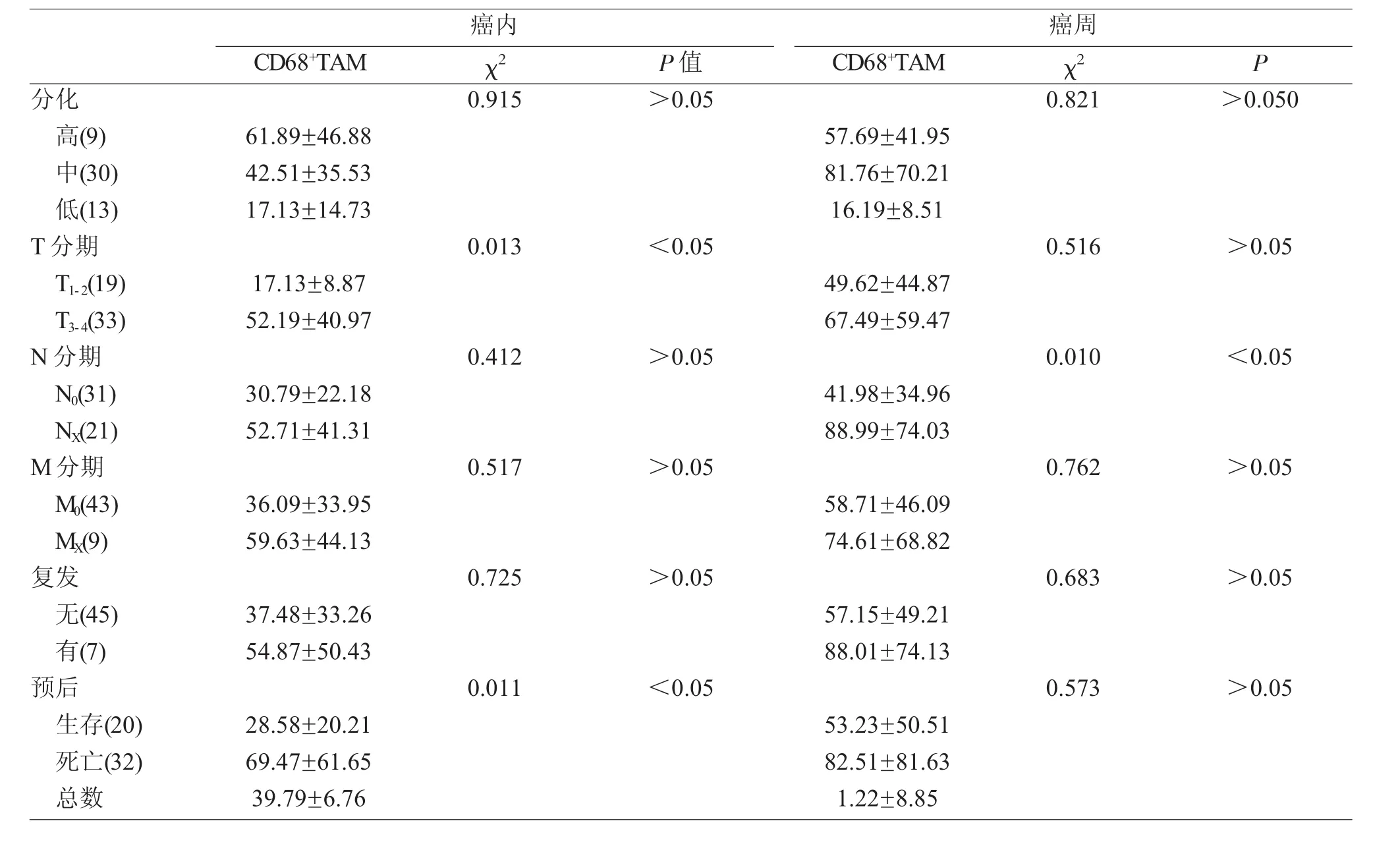
表1 癌内及癌周CD68+TAM与喉咽癌临床指标的关系
5 CD68+TAM计数与喉咽癌预后的关系
本组52例病例5年内死亡32例,均为肿瘤原因死亡,总体5年生存率为38.4%。根据CD68+TAM的中位数将病例分为癌内高CD68+TAM组和低CD68+TAM组,癌周高CD68+TAM组和低CD68+TAM组,并绘制生存率曲线图。经Log-rank检验组
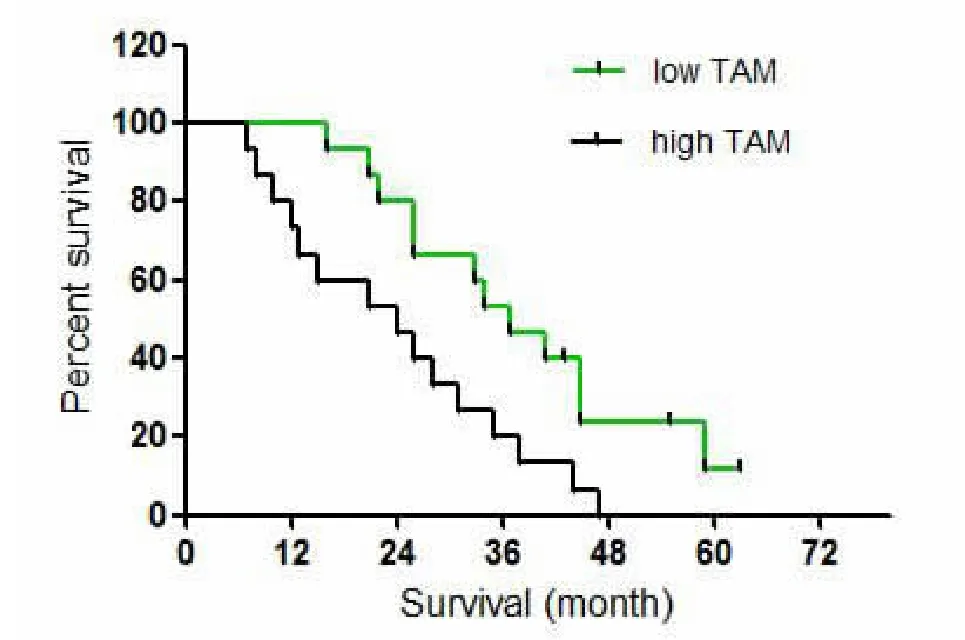
图1 癌内高TAM组与低TAM组的生存曲线
讨论
肿瘤相关巨噬细胞(TAM)来源于血液循环中的单核细胞,主要分为两种亚型,即M1型(经典激活的TAM)和M2型(选择性激活的TAM)。血液中的单核细胞受肿瘤和肿瘤间质中细胞因子和趋化因子(CCL4,CCL5,CCL7,CCL8,CXCLI2,M-CSF,VEGF,PDGF等)的作用,被募集到肿瘤周围,在各种细胞因子(如MCP-1,M-CSF,VEGF等)的刺激下,分化成为不同亚型的TAM[2]。辅助性1型T细胞因子IFN-γ,脂多糖(LPS),集落刺激因子(GM-CSF)等促使TAM向M1型极化;辅助性1型T细胞分泌和肿瘤来源的细胞因子:TGF-β、PGE2、IL-4、IL-13 等促使TAM向M2型极化[4]。在肿瘤微环境中M1型和M2型TAM可相互极化,Herwig[5]等研究发现,PPAR-γ可诱导M1型TAM向M2型极化,M2型TAM比例的增高提示肿瘤细胞增殖及预后不良。现有研究表明,TAM与肺癌、乳腺癌和胰腺癌等多种肿瘤患者不良预后密切相关[6,7]。本研究中,喉咽癌癌内TAM浸润密度随着肿瘤T分期上升而增加,并且TAM浸润密度越高,患者预后越差,表明TAM浸润可促进喉咽癌发展,与其预后呈负相关。
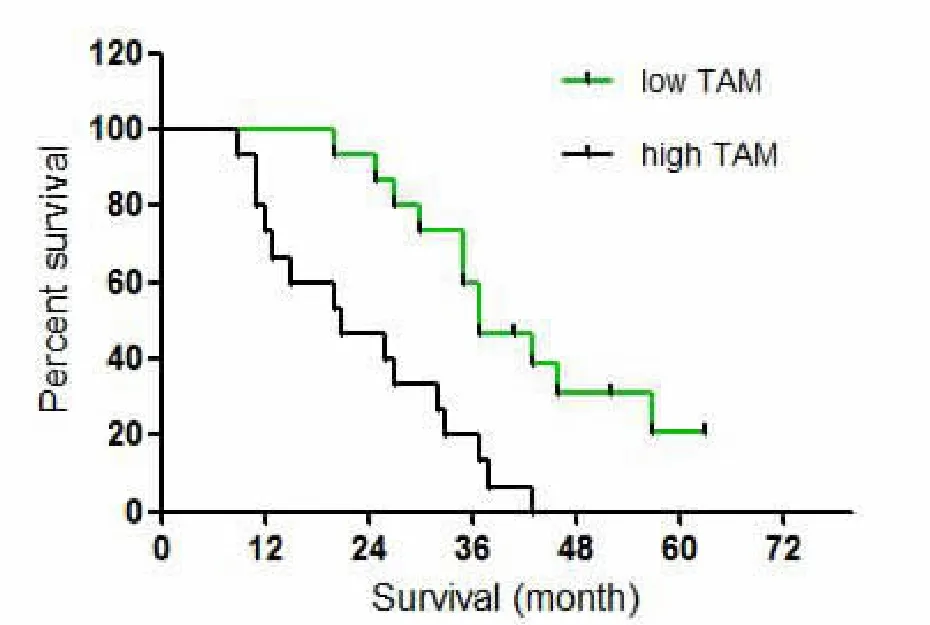
图2 癌周高TAM组与低TAM组的生存曲线
TAM参与并促进肿瘤组织血管和淋巴管的生成。TAM能分泌基质金属蛋白酶(MMPs)、尿激酶型纤溶酶原激活因子(uPA),MMPs和uPA可直接激活肿瘤血管内皮细胞的增生,促进它们在肿瘤细胞间差异,癌内高CD68+TAM组5年生存率为18.7%,癌内低CD68+TAM组5年生存率为49.3%,二者差异具有统计学意义(P<0.05)(见图1);癌周间质高CD68+TAM组5年生存率为19.3%,癌周间质低CD68+TAM组5年生存率为51.7%,差异具有统计学意义(P<0.05)(见图 2)。外基质中迁移,形成新的肿瘤血管[8]。Depalma等[9]研究表明,TAM通过ANG2/TIE2信号通路调节血管内皮细胞生物学性能,破坏原有血管以促进血管生成。Riahov等[10]临床研究发现,在肺癌、胃癌、乳腺癌、B细胞非Hodgkin淋巴瘤、胶质瘤等多种恶性肿瘤中,TAM数量与肿瘤血管的密度等级呈正相关。Jeon等[11]通过对卵巢癌小鼠模型研究发现,TAM通过上调肿瘤组织中VEGF-C和VEGF-D表达来激活淋巴管特异性受体-血管内皮生长因子受体3(VEGFR-3),促进淋巴管生成。Kurahara等[12]研究发现,TAM能诱导肿瘤细胞分泌VEGF-C促进肿瘤的淋巴结转移和浸润,同时促进肿瘤淋巴管的形成。在宫颈癌、胰腺癌、前列腺癌和乳腺癌组织中,TAM上调VECF-C表达,促进肿瘤淋巴管的形成,促进肿瘤细胞淋巴管转移[13,14]。本研究中,喉咽癌癌周间质TAM浸润与淋巴结转移密切相关,因此推测TAM可能通过促进喉咽癌组织微淋巴管的生成而促使肿瘤通过淋巴管转移,这与前述研究结果相符。
本研究表明,喉咽癌癌内及癌周高TAM浸润组患者5年生存率明显低于癌内及癌周低TAM组,可以推测TAM浸润是影响喉咽癌患者预后的主要因素之一,我们可以通过检测喉咽癌组织TAM浸润情况,判断喉咽癌患者的预后,为其临床治疗提供参考。

