高效液相色谱/串联质谱法研究溴氰菊酯在中华绒螯蟹体内的富集消除规律
杨宗英 房文红 周俊芳 胡鲲 杨先乐




摘要:本研究建立了中华绒螯蟹(ErtocheLr stnensLs)体内溴氰菊酯残留的液相色谱/串联质谱检测方法,并选择溴氰菊酯对中华绒螯蟹的安全质量浓度0. 66 μg/L,在(20±1)℃下,对中华绒螯蟹进行浸浴,研究溴氰菊酯在中华绒螯蟹体内的富集消除规律。样品经乙腈提取,采用电喷雾正离子源(ESI+)和多重反应监测( MRM)模式测定,基质匹配标准曲线定量。结果表明,溴氰菊酯标准曲线在0. 1- 50.Oμg/L质量浓度线性关系良好,决定系数为0. 999 8,检测限为0.035 μg/L。0.10μg/kg(μg/L)、10. 00μg/kg(μg/L)、20. 00μg/kg(μg/L)和50. 00 μg/kg(μg/L)添加水平下,溴氰菊酯回收率为82. 63% - 101.00%。各组织对溴氰菊酯的富集能力不同,其中血淋巴和鳃富集能力较强。血淋巴、肝胰腺和鳃等组织中药物质量浓度同时达到峰值,达到峰值时间( Tmax)为0.5 h,峰值质量浓度或质量分数(Cmax)分别为2. 780μ/L,0.567μg/kg和1.165 μg/kg。为了最大限度地避免溴氰菊酯残留对人体造成的危害,除了选择中华绒螯蟹重要的可食组织肝胰腺作为检测对象外,还应选择血淋巴等组织进行进一步的药残检测。
关键词: 中华绒螯蟹;溴氰菊酯;富集消除规律;液相色谱/串联质谱法
中图分类号: S966.16
文献标识码:A
文章编号: 1000-4440( 2019) 03-0709-07
溴氰菊酯( Deltamethrin,DM),商品名为敌杀死,它是一种含有α一氰基的Ⅱ型拟除虫菊酯类杀虫剂,因其具有广谱,高效,对鸟类和哺乳类动物低毒,在环境中半衰期短等特点,被廣泛应用到农业生产中[1]。近年来,溴氰菊酯也被渔业生产上用来杀灭寄生虫[2-3],自Elliott[4]于1974年开发以来,在全世界应用广泛,也成为近年来中国用量增长最快的农药之一[5]。
虽然溴氰菊酯对鸟类和哺乳类动物低毒,但是对鱼类却是高毒,研究结果表明溴氰菊酯对鸟类和哺乳类动物的半致死浓度是鱼类的10到1 000倍[6]。甲壳动物对菊酯类药物比鱼类更敏感[7-8]。中华绒螯蟹(Eriocheir sinensis)是中国重要的养殖经济蟹类,随着20世纪80年代初期中华绒螯蟹人工繁育技术取得成功以来,其繁育技术和养殖技术日趋成熟,中华绒螯蟹的人工养殖发展迅速[9],已成为中国水产养殖的支柱产业。随着溴氰菊酯在水产养殖中的广泛应用,中华绒螯蟹养殖户往往会选择溴氰菊酯清塘IO],这一举措很容易造成中华绒螯蟹中毒和溴氰菊酯在中华绒螯蟹体内残留,溴氰菊酯残留很可能通过食物链威胁人类健康,研究结果表明拟除虫菊酯类农药对哺乳动物的心血管、生殖和免疫等方面具有明显的毒副作用[11-12],中华人民共和国农业行业标准(NY/T 841-2012绿色食品蟹)明确指出在中华绒螯蟹体内,溴氰菊酯检出含量不得超过2.50μg/kg[13]。因此,研究并建立快速、准确、可靠的中华绒螯蟹体内溴氰菊酯残留的检测方法非常紧迫。
目前关于拟除虫菊酯类药物在水产动物体内代谢消除规律的研究主要集中于水产养殖鱼类[14-15],而关于溴氰菊酯在中华绒螯蟹等甲壳动物体内的富集消除规律还未见报道。本研究利用液相色谱/串联质谱法开展了中华绒螯蟹体内溴氰菊酯残留检测的研究,优化选择母离子及监测离子对,建立了溴氰菊酯快速准确的检测方法,且在安全浓度下研究了溴氰菊酯在中华绒螯蟹不同组织中的富集消除规律,旨在为水产品的质量安全提供理论依据,并对其在中华绒螯蟹养殖中的残留监控进行指导。
1 材料与方法
1.1 试验用蟹
中华绒螯蟹取自江苏省兴化市安丰镇某养殖场,个体体质量为( 114.04+9. 14)g,在室内暂养7d,水温为(20+1) ℃,全天不间断充氧,养殖期间每天饲喂全价配合饲料,待中华绒螯蟹死亡率稳定且低于5%时,挑选健康、附肢健全、规格相对一致的中华绒螯蟹进行试验。
1.2 试验药物和器材
溴氰菊酯标准品(>95%)购买于Sigma公司,乙腈(色谱纯)、甲醇(色谱纯)、甲酸(色谱纯)均购于上海国药集团。Shimadzu 20ADXR高效液相色谱仪(日本岛津公司产品),AB Sciex QTRAP6500三重四级杆质谱仪(美国AB公司产品),PhenomenexKinetex C18色谱柱(安捷伦科技有限公司产品),AgllegraX-15R冷冻离心机(Beckman coulter公司产品),T18组织匀浆机(IKA公司产品),Hei-VAP旋转蒸发仪(德国Heidolph公司产品),HQ-60震荡混合器(北方同正产品)。
1.3 试验设计
1.3.1 溴氰菊酯对中华绒螯蟹的急性毒性试验在预试验的基础上,确定致蟹第24 h全部死亡的最低质量浓度和第96 h全部存活的最高质量浓度,在该质量浓度区间设置6个等比质量浓度组,同时设置溶剂对照组和空白对照组,每组3个平行,每个平行试验组放中华绒螯蟹10只,根据TSK法计算得出溴氰菊酯对中华绒螯蟹的96 h /C50为1.32μg/L,安全质量浓度为0.66μg/L[16]。
1.3.2 溴氰菊酯在中华绒螯蟹体内的富集消除规律采用单次泼洒的方法,将溴氰菊酯溶液用丙酮稀释后,加入水族箱中,使水体中的溴氰菊酯质量浓度达到安全质量浓度0. 66 μg/L,每箱放入10只成蟹,共7箱,试验期间停止喂食,分别在试验开始后的第0. 25 h、第0.50 h、第1.00 h、第2.00 h、第4.00h、第6. 00 h、第12. 00 h、第24. 00 h、第36. 00 h、第48. 00 h、第72. 00 h、第96. 00 h取5只中华绒螯蟹,分别采集肝胰腺、鳃、血淋巴等组织,血淋巴经12 000 r/min离心20 min后,取上清液,测定各样本中的溴氰菊酯残留量。
1.4 试验方法
1.4.1 标准曲线 分别称取一定量固体溴氰菊酯标准品,使用甲醇:水= 20:80(体积比),充分溶解,配制母液质量浓度为1 mg/ml,逐级稀释一系列质量浓度(0.1μg/L、0.2μg/L、0.5μLg/L、1.0μg/L、2.0μg/L、5.0μg/L、10.0μLg/L、20.0μg/L、50.0μg/L),配制标准工作液,以测定的峰面积为纵坐标,以对应的标准溶液质量浓度为横坐标,绘制标准曲线,并计算决定系数。
1.4.2 色谱条件 液相色谱条件:PhenomenexKinetex C18柱(3 mmX50 mm,2.6 μm),柱温:40℃。流动相为0. 1%甲酸水溶液一甲醇(A),含0.1%甲酸(B),采用梯度洗脱,甲醇(含0.1%甲酸)在0-0.5 min为20%,0.5 -2.5 min為95%,维持3.5mm.6.0 -9.5 min为20%;流速为0.5 ml/min;进样量为5μl;信号采集时长为10.0 min。
质谱条件:电喷雾正离子源(ESI+),扫描模式为多反应监测( MRM),气帘气为30.0 psi,雾化电压为5 500.0 V,离子源温度为300.O℃,雾化气为60.0 psi,辅助气为60.O psi。
1.4.3 样品前处理取5 9组织样本放入50 ml离心管中,加入20 ml乙腈,用匀浆机以12 000 r/min匀浆5 min,加2 9氯化钠,震荡混匀2 min,5 000r/min离心10 min,取上清液10 ml,60℃下旋蒸至干,用600μl甲醇:水=20:80(体积比)复溶后进样分析,血淋巴样本前处理与组织样本相似,按照比例加入乙腈和氯化钠。
1.4.4 检测限、定量限、回收率及精密度在中华绒螯蟹的空白肝胰腺和鳃中添加溴氰菊酯标准溶液,使最后的溴氰菊酯质量分数分别为0. 10 μg/kg、10. 00μg/kg、20. 00μg/kg和50. 00 μg/kg,血淋巴的加标质量浓度为0. 10 μg/L、10. 00 μg/L、20. 00μg/L和50. 00μg/L,按照相应样品前处理的方法,测定溴氰菊酯的回收率;每个质量浓度的样本,分别日内重复3次,日间重复3次,计算日内及日间变异系数,判定方法的可靠性;同时,在空白中华绒螯蟹样本中加入一系列质量浓度的溴氰菊酯,以引起3倍基线噪音的溴氰菊酯质量浓度( 3S/N)作为最低检测限,以10倍信噪比作为定量限。
1.5 数据分析
采用Microsoft Excel 2013对中华绒螯蟹肝胰腺、鳃和血淋巴中溴氰菊酯的质量浓度一时间曲线和标准曲线进行绘制,采用DAS2.1软件对各组数据进行药代动力学主要参数的计算,采用SPSS19.0进行统计计算并进行单因素方差分析(One-way ANO-VA)。
2 结果
2.1 质谱条件优化
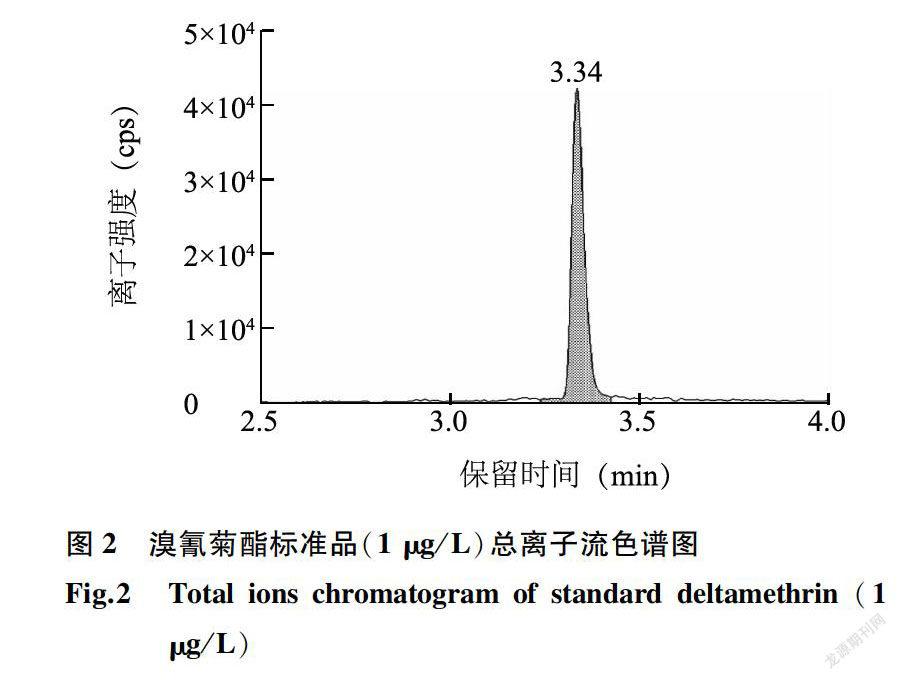
试验开始以1 mg/ml的溴氰菊酯标准品溶液,在ESI+电离模式下对溴氰菊酯进行全扫描,找到溴氰菊酯信号较强且稳定的加氢峰离子[(M+H)]+,以此为母离子,然后对该加氢峰离子进行二级质谱扫描,选择二级质谱中响应值较高的碎片离子作为子离子,如图1所示,母离子峰为523 m/z,定性的子离子峰为281 m/z。在进行MRM检测时,反复优化锥孔电压(cv)和碰撞池电压(CE)等参数,直至仪器检测到最佳响应值,锥孔电压为24 V,碰撞能量为21 eV。图2为溴氰菊酯质量浓度为lμg/L时,在该条件下所检测到的总离子流色谱图,溴氰菊酯的保留时间为3. 34 min。
2.2 标准曲线和相关系数
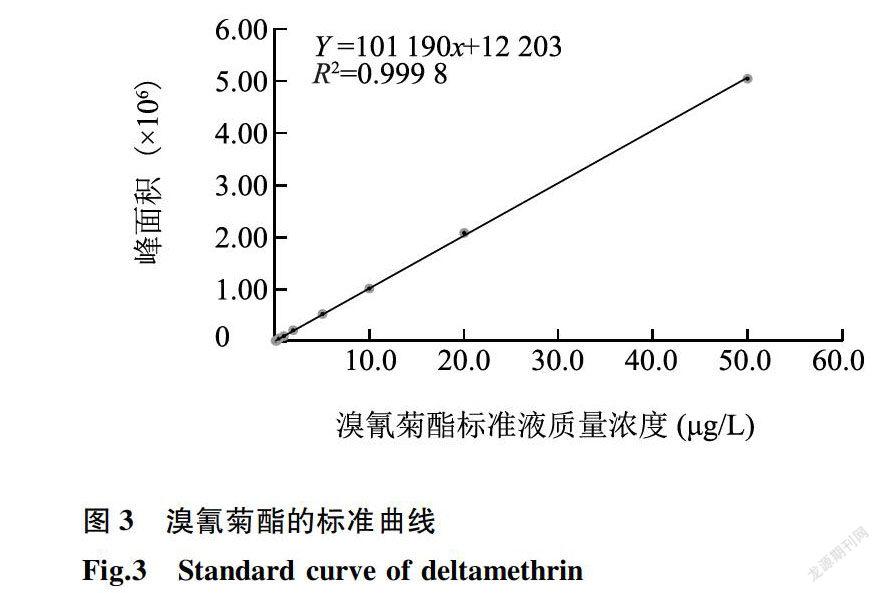
溴氰菊酯在0.1μg/L - 50.0μg/L质量浓度内线性关系良好(图3),线性方程为Y= 101 190x+12 203,决定系数R2为0.999 8,大于0.998 0。
2.3 检测限、定量限、回收率及精密度
在该检测方法下,中华绒螯蟹肝胰腺和鳃组织中溴氰菊酯的检测限为0. 035 μg/kg,定量限为0.10μg/kg;血淋巴中溴氰菊酯的检测限为0.035μg/L,定量限为0.10 μg/L;血淋巴及各组织中溴氰菊酯的平均加标回收率为82.63% - 101.00%;该检测方法的日内精密度低于5%,日间精密度低于8%。
2.4 溴氰菊酯在中华绒螯蟹体内的富集消除规律
不同时间点,溴氰菊酯在中华绒螯蟹血淋巴、肝胰腺和鳃中的残留量如表1所示,残留消除曲线如图4所示。溴氰菊酯在各组织中残留量达到高峰的时间相同,均为0.5 h,但峰值质量浓度不相同,其中血淋巴中的溴氰菊酯峰值质量浓度最高,为2.780μg/L,其次是鳃和肝胰腺,峰值质量分数分别为1.165 μg/kg和0.567μg/kg。由此可以看出,中华绒螯蟹各组织对溴氰菊酯的富集能力不尽相同,血淋巴>鳃>肝胰腺;血淋巴、鳃和肝胰腺对溴氰菊酯的消除半衰期也不相同,血淋巴、鳃和肝胰腺中的消除半衰期分别为20.277 h,26.727 h和2.675 h,鳃>血淋巴>肝胰腺,血淋巴中溴氰菊酯在第96 h仍能检测到,肝胰腺中溴氰菊酯在第24 h就下降到检测限以下,鳃中溴氰菊酯在第96 h下降到检测限以下。
2.5 溴氰菊酯在中华绒螯蟹血淋巴内的药代动力学特征
目前药代动力学研究主要基于房室模型,此方法计算准确,能够得出完整的药代动力学参数,但是该方法也同时受限于数学模型,药物在不同水产动物体内的代谢过程受很多生理因素及不同解剖学结构的影响,如出现双峰现象等,往往会导致数据不能完全拟合数学模型[17]。非房室模型的统计矩方法可以完全不依赖于数学模型,以血药质量浓度一时间曲线为计算依据,同样可以计算出药物在水产动物体内的药代动力学参数,且非房室模型的计算方法已成为各国药品评审部门推荐的计算方法18]。本研究中由于血淋巴中溴氰菊酯质量浓度出现2次峰值,不能完全拟合房室模型,故采用DAS2.1软件,基于药质量浓度一时间曲线,对各组数据进行了主要药物代谢动力学参数的计算,其主要参数见表2。溴氰菊酯通过浸浴的方式进入中华绒螯蟹血液循环,血淋巴中药物质量浓度达峰时间( Tmax)为0.5h,峰值质量浓度(Cmax)为2. 780μLg/L,吸收半衰期[T1/2(ka)]为0.536 h,消除半衰期(T1/2β)为20. 277h,消除半衰期长于吸收半衰期。
3 讨论
3.1 检测方法的可靠性
目前检测菊酯类农药残留的方法主要有高效液相色谱法[19]、GC(气相色谱法)[20]、GC-MS(气质联用法)检测[21]和酶联免疫分析等方法[22]。液相色谱一般来说检测限较高,气相色谱法的检测灵敏度相对较高,但是对样品的净化程度要求较高,前处理一般要利用层析柱净化,操作繁杂;酶联免疫分析是一种基于抗原、抗体的特异性反应的分析方法,具有灵敏度高、安全高效等优点,但某些与待测农药结构相似的农药与待测农药抗体发生交叉反应,会造成检测准确度的下降[23]。之前的检测方法大多是针对水体、畜禽以及鱼类中的药物残留,关于中华绒螯蟹体内溴氰菊酯残留的检测仅见耿雪冰[24]建立了中华绒螯蟹体内溴氰菊酯检测的气相色谱法,且检测限为2μLg/kg。三重四级杆液质联用是近年来发展较快的分析技术[25],該方法具有操作简单、抗干扰能力强、灵敏度高的特点,该研究建立的检测方法,在4个添加质量浓度下,中华绒螯蟹血淋巴、鳃和肝胰腺中溴氰菊酯的回收率为82.63% -101.00%,日内精密度低于5%,日间精密度低于8%,检测限为0.035μg/kg或0.035μg/L,其回收率和精密度均符合《农业部兽药残留试验技术规范(试行)》[26]的要求,该检测方法灵敏度高,检测结果可靠。
3.2 溴氰菊酯在中华绒螯蟹血淋巴中的药代动力学特征
Tl/2(ka)是指药物吸收半衰期,AUC指血药质量浓度一时间曲线下面积。Tmax是达到高峰时间,即动物组织中药物质量浓度达到最大值时所需的时间,达峰时间的长短由吸收速率和消除速率决定。Cmax是指峰值质量浓度,对水生生物来说,峰值质量浓度的高低与水温、给药次数、给药途径、给药剂量以及动物的种类有关。上述4个指标是常被用来衡量药物吸收程度和速度的重要参数,T1/2β为消除半衰期,CL是清除率,这2个指标可以反映药物消除的快慢程度[15]。本研究中,(20±1)℃下,单次泼洒药后溴氰菊酯被中华绒螯蟹吸收后峰值质量浓度( Cma)为2. 780μg/L,Tl/2(ka)为0.536 h,Tmax为0.500 h,AUC为44. 891μg/(L.h),T1/2β职(消除半衰期)为20. 277h,与徐春娟等[15]研究的溴氰菊酯在团头鲂(Mega-lobrama ambtycephala)中的药代动力学参数[Tmax为0. 163 h,Tl/2( ka)为3.660 h,Cmax为56. 855 μg/L,AUC为l 213.088μg/(L.h),T1/2β为6. 730 h]及林丽聪[14]研究的溴氰菊酯在欧洲鳗鲡(Anguillaanguilla)中的药代动力学参数[Tmax为14.700 h,T1/2(ka)为2.695 h,Cmax为18. 446μg/L,AUC为2 221. 034 μg/(L.h),T1/2β为2.895 h]不同,说明同种药物在不同生物体内的药物代谢动力学特征不同,这可能与不同动物体的解剖学结构有关[27]。溴氰菊酯在中华绒螯蟹体内的吸收半衰期为0. 536 h,消除半衰期为20. 277 h,说明中华绒螯蟹对溴氰菊酯的吸收很快,而消除很慢,溴氰菊酯在中华绒螯蟹体内吸收迅速且更长时间的发挥药效。另外,与团头鲂和欧洲鳗鲡相比,溴氰菊酯在中华绒螯蟹体内的清除率(0. 023 00)高于团头鲂(0.000 10),低于欧洲鳗鲡(0. 044 00),但是消除半衰期均比前两者更长,这一原因可能和肝肠循环导致的“自给给药”以及中华绒螯蟹的开管循环系统导致的组织中药物可以向血淋巴转移等有关。
3.3 溴氰菊酯在中华绒螯蟹体内的富集和消除
中华绒螯蟹不同组织对溴氰菊酯的富集能力不同,中华绒螯蟹鳃中Cmax为1.165μlg/kg,肝胰腺中Cmax为0. 567μg/kg,血淋巴中Cmax为2.780μg/L,由此可以看出血淋巴对溴氰菊酯的富集能力最强,其次是鳃和肝胰腺。血淋巴、鳃和肝胰腺等组织中药物质量浓度同时达到峰值,但鳃对溴氰菊酯的吸收半衰期(0. 025 h)均明显短于血淋巴(0. 536 h)和肝胰腺(0. 051 h)对溴氰菊酯的吸收半衰期,说明鳃对溴氰菊酯的吸收速度比血淋巴和肝胰腺等组织快。中华绒螯蟹的鳃具有调节渗透压、呼吸以及排泄等功能,是和水环境直接接触的,很容易受到外界环境影响,另一方面,中华绒螯蟹的鳃组织表面具有一层脂膜,而溴氰菊酯又具有较强的脂溶性[28],基于以上特征,溴氰菊酯可以较快的富集于鳃组织中。在药物消除过程中,根据消除半衰期来看,分别为肝胰腺(2. 575h)<血淋巴(20. 277 h)<鳃(26. 727 h),可见溴氰菊酯在肝胰腺中消除较快,在鳃中消除最慢,这可能是因为肝胰腺是主要的解毒器官,对药物代谢较快[29],而鳃在整个试验过程中直接与药物接触,从而消除半衰期相对较长。除此之外,血淋巴中溴氰菊酯的药物质量浓度一时间曲线出现了明显的双峰现象,血药质量浓度分别在0.5 h和2.0 h达到了2.78μg/L和2.50μg/L,双峰现象延长了药物在体内的作用时间,增大了药物质量浓度一时间曲线下面积(AUC),同时也延长了消除半衰期。
3.4 溴氰菊酯在中华绒螯蟹血淋巴中的双峰现象
研究发现溴氰菊酯在中华绒螯蟹血淋巴中的药物质量浓度出现双峰现象,与溴氰菊酯在欧洲鳗鲡体内的富集消除规律相似[14]。已报道的药物在水生动物体内出现双峰或多峰的现象并不少见,如溴氰菊酯在团头鲂的肌肉、肝脏和鳃中存在明显的双峰现象[15],阿维菌素在鲈鱼(Lateolabrax japonicus)肝脏中存在双峰现象[30],亚甲基蓝及其代谢物在异育银鲫(Carassius auratus gibelio)体内的分布消除过程存在多峰现象[31],罗非鱼(Oreochromismossambicus)药饵饲喂磺胺甲氧嘧啶后,肝脏和肾脏组织中有明显的双峰[32]。药物在水生动物体内代谢出现双峰或多峰现象的原因有很多,常见的有肝肠循环、胃肠道的非齐性吸收和排空[33]、药物外排蛋白P一糖蛋白的组织分布差异性等[34-35]。本研究血淋巴中药物质量浓度出现双峰很可能是由肝肠循环导致的,一方面肝胰腺是中华绒螯蟹重要的消化、免疫和解毒器官,药物等异物代谢主要在肝胰腺中进行[29],另一方面中华绒螯蟹血淋巴中的药物质量浓度一时间曲线下面积较大,消除半衰期较长,和肝肠循环导致的药物代谢动力学特征相吻合[36]。
中華绒螯蟹是开管循环,血淋巴主要分布于各组织内,肝胰腺是重要的可食组织,残存于血淋巴中的溴氰菊酯可进一步富集到肝胰腺等其他组织。因此,针对中华绒螯蟹体内溴氰菊酯残留的监控,除了检测肝胰腺的药物残留量以外,还应进一步检测血淋巴等其他组织。
参考文献:
[1]SHEN P,HSIEH T H,YUE Y,et al.Deltamethrin increases thefat accumulation in 3T3-L1 adipocytes and Caenorhabditis elegans[J]. Food and Chemical Toxicology, 2017, 101: 149-156.
[2]SINGH S,TIWARI R K,PANDEY R S.Evaluation of acute tox-icity of triazophos and deltamethrin and their inhibitory effect onAChE activity in Channa punctatus[J].Toxicology Reports,2018,5:85-89.
[3]张新铖,朱新平,刘毅辉,等,甲苯咪唑、溴氰菊酯和硫酸铜对美洲鲥的急性毒性研究[J].南方水产科学,2015,ll(2): 66-71.
[4]ELLI0rI7M,FARNHAM A W,JANES N F,et a王.Synthetic in-secticide with a new order of activity[ J]. Nature, 1974. 248( 450):710-711.
[5]胡笑形,我国农药T业的现状与发展方向[J].农药,1998,37(6):7-10.
[6]LIU X,ZHANG Q,LI S,et al.Developmental toxicitv and neuro-toxicity of synthetic organic insecticides in zebrafish ( Dani。rerio):a comparative study of deltamethrin, acephate, and thia-methoxam[J].Chemosphere, 2018, 199: 16-25.
[7] TOUMI H,BOUMAIZA M,MILLET M,et al-Effects of delta-methrin( pyrethroid insecticide) on growth, reproduction, embry-onic development and sex differentiation in two strains of Daphniamagna( Crustacea. Cladocera)[J].Science of the Total Environ-ment, 2013, 458-460: 47-53.
[8] JACQUELINE C M, CRISTIAN G E. Deltamethrin(AlphaMaxTM) reveals modulation of genes related to oxidativestress in the ectoparasite Caligus rogercresseyi: Implications on de-lousing drug effectiveness[J].Aquaculture, 2014, 433( 37):421-429.
[9]DINC Z,MENC Q, LIU H, et al-First case of hepatopancreaticnecrosis disease in pond-reared Chinese mitten crab, Eriocheirsinensis, associated with microsporidian[J].Joumal of Fish Dis-
ease, 2016, 39(9):1043-1051.
[10] SHEN H S,ZANG Y N, SONG K, et al.A meta-transcriptomicssurvey reveals changes in the microbiota of the Chinese mitten crabEriocheir sinensis infected with hepatopancreatic necrosis disease[J]. Frontiers in Microbiology, 2017,8:732.
[11] SHARMA P, ASLAM K I,SINGH R.Curcumin and quercetin a-meliorated cypermethrin and deltamethrin-induced reproductivesystem impairment in male wistar rats by upregulating the activityof pituitary-gonadal hormones and steroidogenic enzymes[J].In-temational Journal of Fertility&Sterility, 2018, 12(1):72-80.
[12] SAOUDI M, BADRAOUI R. BOUHAJJA H, et al.Deltamethrininduced oxidative stress in kidnev and brain of rats: protectiveeffect of Artemisia campestris essential oil[J].Biomedicine& Pharmacotherapy, 2017, 94: 955-963.
[13]中华人民共和国农业部,绿色食品蟹:NY/T 841-2012[S].北京:中国农业出版社,2012.
[14]林丽聪.溴氰菊酯在欧洲鳗鲡体内药代动力学研究[J].福建水产,2008(2):33-36.
[15]徐春娟,刘永涛,艾晓辉,等.溴氰菊酯在团头鲂体内的富集消除规律研究[J].西北农林科技大学学报,2017,45( 12):1-7.
[16]杨宗英,张一柳,胡鲲,等.溴氰菊酯对中华绒螯蟹肝胰腺氧化胁迫效应和组织结构的影响[J].浙江农业学报,2017. 29(8):1261-1270.
[17]汪建国,王玉堂,陈昌福,渔药药效学[M].北京:中国农业出版社,2011: 84-85.
[18]郭涛.临床药代动力学理论与实践——创伤治疗药物[M].北京:人民军医出版社,2014:36-39.
[19]王为中,崔世海,闫婷婷,等,磁固相萃取与高效液相色谱联用测定水体中防治白蚁农药残留[J].南京师大学报(自然科学版), 2016, 39(4):132-138.
[20]杨韶松,陈静,唐旭斌.香料烟中2种菊酯农药的残留降解动态[J],华中农业大学学报,2013, 32(1):68-72.
[21]吴南村,张群,刘春华,等,凝胶渗透色谱/固相萃取净化.气相色谱-串联质谱检测白胡椒中的毒死蜱和溴氰菊酯残留[J].农药,2016, 55(12):903-905.
[22]王恒玲,李 敏,李培武,等.油菜薹中醚菊酯酶联免疫( ELISA)快速检测方法建立[J].中国油料作物学报,2015,37(3):354-359.
[23] KAUFMAN B M, JR C M.Immunoassay of pesticides[ J].Journal-Association of Official Analytical Chemists, 1991, 74(2):239.
[24]耿雪冰.溴氰菊酯残留的检测方法及对河蟹的毒性研究[D].南京:南京农业大学,2010: 21-27.
[25] ZHENG Z L,ZHANG S Y, MA W D, et al.Determination ofdexmedetomidine bv UHPLC-MS/MS and its application toevaluate the effect of dexmedetomidine concentration on the target-controlled infusion concentration of propofol[J].Journal of Phar-maceutical and Biomedical Analysis, 2018, 154: 438-443.
[26]中华人民共和国农业部.农业部[2003]l号文件,关于颁布《农业部兽药残留试验技术规范(试行)》的通知[Z]. 2003.
[27] HALLY B A, NESSEL R J,LU A Y H.Ivermectin and abamectin[M]. New York: Springer, 1989: 162-200.
[28] ARSLAN H. ALTUN S,OZDEMIR S. Acute toxication of delta-methrin results in activation of iNOS. 8-OHdC and up-regulationof caspase 3,iNOS gene expression in common carp( Cyprinuscarpio L)[J].Aquatic Toxicology, 2017, 187: 90.
[29] YANG Z,ZHANC Y, JIANC Y, et al.Transcriptional responsesin the hepatopancreas of Eriocheir sinensis exposed to deltamethrin[J]. PLoS ONE, 2017, 12(9):e0184581.
[30]邢丽红,孙伟红,冷凯良,等.阿维菌素在鲈组织中的富集及消除规律研究[J].中国渔业质量与标准,2013, 3(4):63-69.
[31]梁楠,胡鲲,刘腾飞,等,亚甲基蓝及其代谢物在异育银鲫体内分布及消除规律的研究[J].南方水产科学,2017,13(1):19-25.
[32]鞠晶,王伟利,姜兰,等.磺胺间甲氧嘧啶在罗非鱼体内的药物代谢动力学及休药期[J].华中农业大学学报,2015, 34(1):103-107.
[33] DAVIES N M, TAKEMOTO J K, BROCKS D R, et al-Multiplepeaking phenomena in pharmacokinetic disposition[J].ClinicalPharmacokinetics, 2010, 49(6): 351-377.
[34] STAPPAERTS J, ANNAERT P,AUGUSTUNS P.Site dependentintestinal absorption of darunavir and its interaction with ketocon-azole[J].European Journal of Pharmaceutical Sciences, 2013,49(1):51.
[35] WADA S,KANO T,MITA S,et al-The role of inter-segmentaldifferences in p-glycoprotein expression and activity along the ratsmall intestine in causing the double-peak phenomenon of substrateplasma concentration[J].Drug Metabolism& Pharmacokinetics,2013, 28(2):98-103.
[36] ROBERTS M S,MACNUSSON B M, BURCZYNSKI F J,et al-Enterohepatic circulation: physiological, pharmacokinetic andclinical implications[J].Clinical Pharmacokinetics, 2002, 41(10):751.
(責任编辑:陈海霞)

