基于液相色谱—质谱联用技术的多囊卵巢综合征患者血清脂质组学分析
杨兆鹏等


摘 要 多囊卵巢综合征是育龄期妇女最为常见的内分泌以及代谢紊乱疾病,是女性不孕的主要原因之一。多囊卵巢综合征患者临床存在很大的异质性,其致病机理尚未完全阐明。本研究基于反相液相色谱与串联四级杆飞行时间质谱联用技术(RPLC/Q-TOF-MS),对74例多囊卵巢综合征患者和54例正常女性的血清进行了脂质组学分析,定性鉴别出15类314种脂质化合物。数据采用非参数检验寻找潜在的差异化合物, p<0.05为显著性差异。结果表明:多囊卵巢综合征患者与正常人相比,不饱和脂肪酸、部分鞘磷脂、甘油二酯、甘油三酯呈上调趋势; 部分磷脂酰胆碱、溶血性磷脂酰胆碱、溶血性磷脂酰乙醇胺呈下调趋势。而肥胖多囊卵巢综合征患者与非肥胖多囊卵巢综合征患者相比,不饱和脂肪酸、鞘磷脂、甘油二酯、甘油三酯上调更为明显; 溶血性磷脂酰胆碱、部分磷脂酰胆碱下调更为明显。本研究结果表明,脂质组学是研究疾病分型的有效手段。
关键词 多囊卵巢综合征; 液相色谱-质谱联用; 脂质组学; 脂质代谢异常
1 引 言
多囊卵巢综合征(Polycystic ovarian syndrome,PCOS)是女性不孕的主要原因之一,在育龄妇女人群中的发病率为6%~10%[1]。PCOS主要临床表现为月经稀发、慢性无排卵、卵巢多囊性改变,以及多毛症和黑棘皮症等,严重影响患者的身心健康。PCOS具有非常大的异质性,给诊断带来困难。Zhao等[2]用代谢组学方法探讨了代谢标志物进行PCOS辅助诊断的可能性。
脂质组学是研究生物体内脂质代谢变化以及脂质调控在生命活动中作用的有效手段[3]。液相色谱-质谱联用技术是目前主要的研究方法,反相液相色谱法由于柱效高、分离效果好,被广泛应用于脂质分析中。Hu等[4]将反相液相色谱法应用于p53突变的小鼠血浆研究中,各类脂质均得到了良好分离,线性特性和检测限也令人满意。
血脂代谢异常是PCOS患者的临床表现之一,主要表现为甘油三酯、总胆固醇、极低密度脂蛋白升高和高密度脂蛋白降低[5]。但是目前尚没有针对PCOS患者血清的脂质组学研究。本研究采用反相色谱与质谱联用(LC-MS)的脂质组学方法,对PCOS患者血清进行了脂质组学研究,希望发现PCOS患者的差异脂质化合物,为了解患者脂质代谢特征提供帮助。
2 实验部分
2.1 仪器与试剂
采用AcquityTM UPLC 液相色谱仪(美国Waters公司)与5600质谱仪(美国AB SCIEX 公司)联用进行脂质组学分析。分别使用正负离子扫描模式对样本进行检测,色谱柱为ACQUITY UPLC C8柱(10 mm×2.1 mm,1.7 μm,美国Waters公司)。
甲醇、乙腈(HPLC级,Merck公司); 乙酸铵(HPLC级)、 内标脂肪酸FFA 16-d3和FFA 18-d3(Sigma公司); 磷脂酰胆碱PC 38∶0、磷脂酰乙醇胺PE 34∶0、溶血性磷脂酰胆碱LPC 19∶0、鞘脂SM 12∶0、甘油三酯TAG 45∶0和神经酰胺Cer 17∶0(美国Avanti Polar Lipids公司)。实验用水为超纯水(Milli-Q,美国Millipore公司)。
2.2 血液样本采集
采用黑龙江中医药大学附属第一医院妇科门诊和哈尔滨医科大学第一医院体检中心提供的74例PCOS患者血样和54例正常女性血样。研究经过黑龙江中医药大学附属第一医院机构伦理委员会批准,所有患者都签署了知情同意书。按照2003年鹿特丹会议提出的排除性标准[6],在排除了先天性肾上腺皮质增生、库欣综合征等疾病之后, 满足下列3条标准中的两条即可诊断为PCOS: (1) 稀发排卵或者不排卵; (2) 高雄激素血症或高雄激素临床表现; (3) 卵巢多囊性改变。
正常人在生理月经周期第3~5天采血,PCOS患者在生理月经周期或者孕激素降低第3~5天或者两侧卵巢均无优势卵泡时采血。所有采样对象在前一天避免剧烈运动,于次日早晨采血。血样采集后静置30 min,离心后取血清置于-80℃保存。
根据身高体重指数(BMI),将74例PCOS患者和54例正常女性又分为肥胖组(BMI>23)和非肥胖组(BMI≤23),即4组:非肥胖正常组(36例)、肥胖正常组(18例)、非肥胖PCOS组(39例)、肥胖PCOS组(35例)。
2.3 样本预处理
配制含内标的甲醇溶液,内标质量浓度分别为:PC 38∶0为0.67 μg/mL,PE 34∶0为0.33 μg/mL,LPC 19∶0为0.33 μg/mL,SM 12∶0为0.17 μg/mL,TAG 45∶0为0.53 μg/mL,Cer 17∶0为0.53 μg/mL,FFA 16-d3为0.67 μg/mL,FFA 18-d3为0.67 μg/mL。
血液样本的预处理:血样于4℃下解冻后取40 μL于2 mL离心管中,加入300 μL含有内标的甲醇溶液(冰上操作),涡旋30 s,加入1 mL甲基叔丁基醚,室温下振荡1 h。加入250 μL水,涡旋30 s,于4℃以12000 r/min离心10 min。取上清液400 μL于1.5 mL离心管中冻干。复溶时先加入40 μL二氯甲烷-甲醇(2∶1, V/V),再加入120 μL含5 mmol/L乙酸铵的乙腈-异丙醇-水(65∶30∶5, V/V),涡旋30 s,离心后, 取60 μL上清液于装有内衬管中的玻璃瓶中用于进样。
质量控制样本(QC)平行地穿插在整个分析过程中,用于评价整个分析过程的重复性。QC样本来自全部74例PCOS患者和54例正常女性血样的混合。用QC样本平衡仪器,待仪器响应稳定后再进行样本的分析,每10个样本插入1个QC样本。
2.4 基于LC-MS的脂质组学分析条件
UPLC条件:流动相A相为含10 mmol/L 乙酸铵的乙腈-水(6∶4, V/V),B相为含10 mmol/L乙酸铵的异丙醇-乙腈(9∶1, V/V)。梯度洗脱程序:0~15.5 min,32% B; 15.5~15.6 min,85%~97% B; 15.6~18.1 min,97% B; 18.1~20.1 min,32% B。流速为0.26 mL/min。柱温为55℃,样本室温度为10℃。进样量为5 μL。
Mass条件:在全扫获得一级谱图的同时进行数据相关采集模式(IDA)获得二级谱图。正离子模式扫描范围为100~1500 Da,质量偏差为50 mDa。离子源雾化气Gas1和辅助气Gas2 都为344.75 Pa, 气帘气Curtain Gas为241.33 Pa,温度为500℃,喷雾电压(Ion spray voltage floating, ISVF)为5500 V。去簇电压(Declustering potential, DP)为80 V,碰撞能(Collision energy, CE)为35 V。负离子模式扫描范围为90~1500 Da,质量偏差为50 mDa。离子源雾化气Gas1 和辅助气Gas2都为379.23 Pa,气帘气为241.33 Pa,温度为600℃,喷雾电压ISVF为 -4500 V。去簇电压DP为 -100 V,碰撞能CE为45 eV。
2.5 数据处理
原始数据采用美国ABSCIEX公司LIPIDVIEWVersion1.2软件进行定性鉴定,根据保留时间、精确质量数、二级质谱图进行色谱峰识别。定性的脂质化合物用MultiQuant 2.1软件进行峰提取,并用相应的内标进行校正。
脂质组学数据和临床数据利用美国SPSS公司SPSS 16.0软件进行非参数检验,p<0.05表示有显著性差异。
3 结果与讨论
3.1 基于LC-MS的脂质组学分析
本研究采用非靶向的脂质组学方法对74例PCOS患者和54例正常女性的血清进行了脂质组学分析。由于实验采用的是反相色谱,极性较强的溶血磷脂如溶血性磷脂酰胆碱等先流出,非极性的甘油三酯后流出。同一类别的脂质分子主要是根据脂肪链的长短和不饱和度的大小实现分离。正负离子模式下的基峰离子流图如图1所示,不同类别的脂质均得到良好分离。
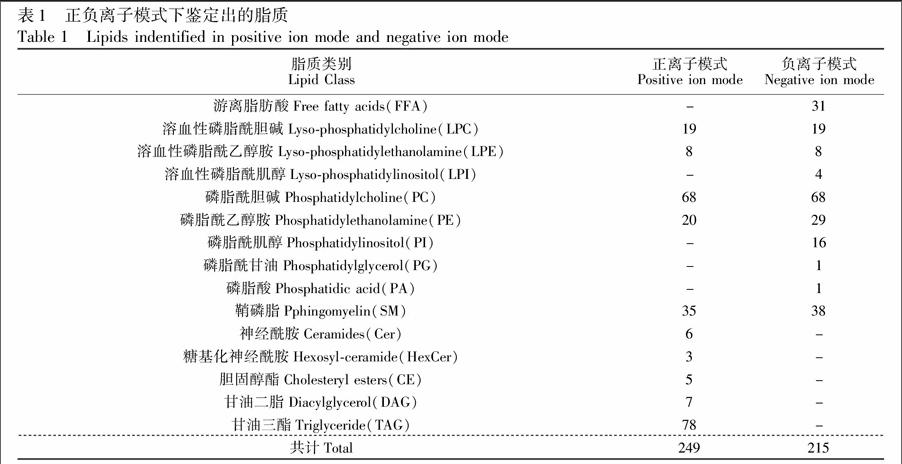
本研究采用IDA扫描模式,在全扫描获得一级谱图的同时获得二级谱图信息,因此可以快速获得更为详细的脂质结构信息。再根据保留时间、精确质量数、二级断裂规律,实现定性分析。共检测到15类脂质代谢物,包括游离脂肪酸(FFA)、溶血性磷脂酰胆碱(LPC)、溶血性磷脂酰乙醇胺(LPE)、溶血性磷脂酰肌醇(LPI)、磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、磷脂酰肌醇(PI)、磷脂酰甘油(PG)、磷脂酸(PA)和鞘磷脂(SM)、神经酰胺(Cer)、糖基化的神经酰胺(HexCer)、胆固醇酯(CE)、二酰甘油(DAG)、三酰甘油(TAG)。鉴定的结果如表1所示。正离子模式下鉴定出249种化合物,负离子模式下鉴定出215种化合物。其中LPC、LPE、PC、PE、SM等150种脂质化合物在正负离子模式下均能检测,因此最终本研究共定性鉴定出314种脂质化合物。
QC样本用于评价分析方法的重复性,如图2所示:正离子模式下RSD<15%的化合物百分比达79.5%,RSD<30%的化合物百分比达93.7%; 负离子模式下, RSD<15%的化合物百分比达63.2%,RSD<30%的化合物百分比达94.4%。说明本法的分析重复性良好,适用于脂质组学研究。
3.2 临床数据比较
本研究选择与PCOS患者年龄、BMI指数相匹配的正常人做对照。临床数据表明,PCOS患者的腰臀比、腰围显著高于正常人,此外在多毛评分、黑棘皮发病率、溢脂发病率方面也显著高于正常人; PCOS患者血清泌乳素、睾酮、游离雄激素指数升高,性激素结合球蛋白下降,表明PCOS患者激素代谢紊乱; PCOS患者的空腹葡萄糖、总胆固醇、甘油三酯、低密度脂蛋白升高,高密度脂蛋白下降,表明PCOS患者的糖脂代谢状况紊乱。
已有的研究表明,肥胖PCOS患者和非肥胖PCOS患者在发病机理、临床表现等方面有差异[7]。基于此,本研究将疾病组和正常组又分为肥胖组和非肥胖组。肥胖PCOS患者与非肥胖PCOS患者相比,腰臀比、收缩压、舒张压升高; 黑棘皮发病率,溢脂发病率、粉刺发病率升高; 空腹胰岛素水平、稳态胰岛素评价指数升高; 低密度脂蛋白、甘油三酯升高,高密度脂蛋白下降; 性激素结合球蛋白下降。
3.3 PCOS差异代谢物的变化趋势以及可能的生理学意义
在PCOS患者和正常人这两组中, 对定性鉴定出的314种脂质化合物进行了非参数检验(p<0.05认为有显著性差异),其中66种变化倍率较大(即PCOS组和正常组比值小于0.9和大于1.2)的差异化合物可视化变化结果显示在热图中(图3)。从图3可见,相对于正常人,在PCOS患者中,LPC、LPE、部分PC、PI下调; 不饱和脂肪酸UFA、部分SM、DAG以及TAG上调。
此外,应用非参数检验研究了肥胖PCOS患者与非肥胖PCOS患者在脂质代谢方面的差异,其差异化合物在图3中以红色标示。综合上述两组对比的结果发现:LPC、部分PC在PCOS组下调,且在肥胖PCOS组下调更为明显; UFA、部分SM、DAG、TAG在PCOS组上调,且在肥胖PCOS组中上调更为明显。
图3 差异脂类代谢物的热图(标记为红颜色表示在肥胖PCOS患者与非肥胖PCOS患者中有差异)Fig.3 Heat map of differential lipids(Lipids in red show significant difference in obese polycystic ovarian syndrome (PCOS) and lean PCOS)
游离脂肪酸是人体内的储能物质,临床上很多疾病的发生发展与血清中游离脂肪酸的浓度异常密切相关,脂肪酸还是一些重要生理活动如胰岛素分泌过程的的信号分子[8]。本研究发现,在PCOS患者中,多不饱和脂肪酸(如FFA20∶4, FFA22∶4, FFA22∶5)升高,且在肥胖的PCOS患者中升高更为显著,结果如图4A, 4B, 4C所示。许多研究表明,上调的游离脂肪酸含量与胰岛素抵抗密切相关[9]。游离脂肪酸可激活C-Jun氨基末端激酶(JNK)信号通路,使胰岛素受体底物-1(IRS-1)上的丝氨酸磷酸化水平升高,进而减弱了胰岛素靶器官中胰岛素信号通路的作用[10]。本研究临床数据表明,肥胖PCOS患者的空腹胰岛素水平较非肥胖PCOS患者显著升高,这也可能与肥胖PCOS患者游离脂肪酸增高相关。
LPC是脂肪酸诱导产生胰岛素抵抗过程中重要的中介物[11]。如图3所示,PCOS患者与正常人相比,LPC呈下调趋势,这种变化在肥胖PCOS和肥胖正常人两组对比中尤为明显,图4D,4E,4F清楚地显示了这一变化。文献\[12\]表明,LPC在葡萄糖转运、吸收利用等方面发挥了重要作用,可能成为一种独立的胰岛素信号来调节体内葡糖糖的含量。有研究表明,在肥胖和2型糖尿病患者体内LPC也成下调趋势, Barber等[13]发现,LPC的含量和肥胖呈负相关; Li等[14]发现,LPC可作为高脂肪膳食引起肥胖的标志物,与野生型的小鼠相比,CYP1B1基因敲除的小鼠的血清中LPC明显下降。另外CYP1B1对于维持人体内雌激素代谢的稳定具有重要作用[15]。PCOS患者的雌激素分泌异常也是其临床特征之一。由此推测,PCOS患者血清中LPC含量下降,雄激素和雌激素的比例失衡,可能与CYP1B1基因被抑制有关。
图4G和4H表明,PCOS患者与正常人相比,甘油二酯和甘油三酯增加,与临床数据中TG含量增高吻合,高浓度的甘油三酯水平可增加PCOS患者患动脉粥样硬化和冠心病的风险[16]。脂质组学分析发现,包含多不饱和脂肪酸链的TG增高更为显著。此外,鞘磷脂SM(d18∶0/18∶0)在PCOS患者中显著上调,在肥胖PCOS患者中上调更为显著,如图4I所示。Samad等[17]发现,鞘磷脂的集聚在动脉粥硬化的发展过程中有着重要作用。鞘磷脂在低密度脂蛋白LDL中的含量高于在高密度脂蛋白HDL; 从PCOS患者临床指标可知,低密度脂蛋白LDL上升,高密度脂蛋白HDL下降,这也可能与鞘磷脂的增高相关。
4 结 论
本研究将基于LC-MS的脂质组学分析技术用于PCOS患者的血清研究,发现PCOS患者与正常人相比,不饱和脂肪酸、部分鞘磷脂、甘油二酯、甘油三酯呈上调趋势,部分磷脂酰胆碱、溶血性磷脂酰胆碱、溶血性磷脂酰乙醇胺呈下调趋势。不饱和脂肪酸、部分鞘磷脂、甘油二酯、甘油三酯在肥胖PCOS组上调更为明显; 部分磷脂酰胆碱、溶血性磷脂酰胆碱在肥胖PCOS组下调更为明显。这些现象表明,PCOS患者脂质代谢异常,且肥胖PCOS患者相较非肥胖PCOS患者的脂质代谢紊乱更为严重。本研究的结果提示,PCOS患者,特别是肥胖PCOS患者, 胰岛素抵抗和动脉粥样硬化、冠心病的风险增加。
References
1 Goodarzi M O, Dumesic D A, Chazenbalk G, Azziz R. Nat. Rev. Endocrinol., 2011, 7(4): 219-231
2 Zhao X J, Xu F, Qi B, Hao S L, Li Y J, Li Y, Zou L H, Lu C X, Xu G W, Hou L H. J. Proteome Res., 2014, 13(2): 1101-1111
3 LI Guo-Shen, WANG Yan-Hong, WU Ren-An, WANG Shi-Cheng. Chem. J. Chinese Universities, 2010, 31(2): 269-273
李国琛,王颜红,吴仁安,王世成. 高等学校化学学报, 2010, 31(2): 269-273
4 Hu C X, van Dommelen J, van der Heijden R, Spijksma G, Reijmers T H, Wang M, Slee E, Lu X, Xu G W, van der Greef J, Hankemeier T. J. Proteome Res., 2008, 7(11): 4982-4991
5 Jin J K, Young M C. Obstet. Gynecol. Sci., 2013, 56(03): 137-142
6 Fauser B, Chang J, Azziz R, Legro R, Dewailly D, Franks S, Tarlatzis B C, Fauser B, Balen A, Bouchard P, Dahlgren E, Devoto L, Diamanti E, Dunaif A, Filicori M, Homburg R, Ibanez L, Laven J, Magoffin D, Nestler J, Norman R J, Pasquali R, Pugeat M, Strauss J, Tan S, Taylor A, Wild R, Wild S, Ehrmann D, Lobo R, Rotterdam EAs. Hum. Reprod., 2004, 19(1): 41-47
7 Morales A J, Laughlin G A, Butzow T, Maheshwari H, Baumann G, Yen S S C. J. Clin. Endocrinol. Metab., 1996, 81(8): 2854-2864
8 Roden M, Price T B, Perseghin G, Petersen K F, Rothman D L, Cline G W, Shulman G I. J.Clin. Invest., 1996, 97(12): 2859-2865
9 Storlien L H, Jenkins A B, Chisholm D J, Pascoe W S, Khouri S, Kraegen E W. Diabetes, 1991, 40(2): 280-289
10 Whitmarsh A J, Cavanagh L, Tournier C, Yasuda L, Davis R J. Science, 1998, 281(5383): 1671-1674
11 Han M S, Lim Y M, Quan W, Kim J R, Chung K W, Kang M, Kim S, Park S Y, Han J S, Park S Y, Cheon H G, Rhee S D, Park T S, Lee M S. J. Lipid Res., 2011, 52(6): 1234-1246
12 Yea K, Kim J, Yoon J H, Kwon T, Kim J H, Lee B D, Lee H J, Lee S J, Kim J I, Lee T G, Baek M C, Park H S, Park K S, Ohba M, Suh P G, Ryu S H. J. Biol. Chem., 2009, 284(49): 33833-33840
13 Barber M N, Risis S, Yang C, Meikle P J, Staples M, Febbraio M A, Bruce C R. PLoS ONE, 2012, 7(7): e41456
14 Li F, Jiang C T, Larsen M C, Bushkofsky J, Krausz K W, Wang T, Jefcoate C R, Gonzalez F J. J. Proteome Res., 2014, 13(5): 2679-2687
15 ZHU Zhuang-Yan, MI Ruo-Ran, LIU Jing. Progress in Obstetrics and Gynecology, 2006, 15(03): 184-187
朱壮彦, 糜若然, 刘 静. 现代妇产科进展, 2006, 15(03): 184-187
16 Cakir E, Dogan M, Topaloglu O, Ozbek M, Cakal E, Vural M G, Yeter E, Delibasi T. Atherosclerosis, 2013, 226(1): 291-295
17 Samad F. Future Lipidol., 2007, 2(6): 625-639

