液相色谱—串联质谱法测定人工模拟猪消化液中3种霉菌毒素
王瑞国+苏晓鸥

摘 要 建立了液相色谱-串联质谱法(LC-MS/MS)同时测定人工模拟猪胃和小肠消化液中黄曲霉毒素B1(AFB1)、脱氧雪腐镰刀菌烯醇(DON)和玉米赤霉烯酮(ZEA)的快速、灵敏方法,并将此方法应用于霉菌毒素吸附剂吸附率体外法评价。通过模拟猪的消化道对饲料基质进行体外消化获得猪胃和小肠消化液,分别向其中按一定比例添加霉菌毒素吸附剂和3种霉菌毒素,孵育、离心后,经进样液10倍稀释后测定。采用反相C18色谱柱分离,以0.2 mmol/L乙酸铵溶液和0.1%甲酸-甲醇溶液作为流动相,梯度洗脱,多反应监测离子模式(MRM)检测,同位素内标法定量。在优化条件下,对AFB1, DON和ZEA在人工猪胃和小肠消化液中的定量限分别是1, 50, 40 μg/L和0.3, 50, 20 μg/L,相对偏差(RSD)<5.0%。并且,在39 ℃±0.5 ℃,10 h内测定结果稳定,能够满足霉菌毒素吸附剂吸附率的测定。采用本方法对市售8种蒙脱石类吸附剂和5种酵母细胞壁类吸附剂进行吸附率评价。
关键词 液相色谱-串联质谱; 模拟猪消化液; 霉菌毒素; 霉菌毒素吸附剂
1 引 言
霉菌毒素(Mycotoxins)是由霉菌产生的次级代谢产物,一旦被动物采食会产生一系列毒性效应<sup>[1]</sup>。饲料特别易于被各种霉菌毒素污染<sup>[2,3]</sup>,而霉菌毒素吸附剂是消除饲料中、低剂量霉菌毒素对动物影响的有效手段<sup>[4]</sup>。对特定毒素的吸附率是霉菌毒素吸附剂评价的最重要指标,但是吸附率的评价尚没有一致的方法。目前,霉菌毒素吸附剂吸附率的评价存在以下问题: (1)评价方法 吸附率的测定通常分为体外和体内两种。体外方法一般以缓冲液为介质,测定吸附剂对某种霉菌毒素的吸附能力,这种方法在吸附剂初步评价和吸附潜力筛选方面得到广泛应用。但是,由于经常与体内方法的评价结果不一致,从而降低了可信度<sup>[5]</sup>。体内法采用动物生产性能或生物标记物等间接指标来评价吸附剂效果,因为很多因素和实验条件都可影响最终结果,导致了评价结果不稳定<sup>[6]</sup>。(2)毒素检测方法 绝大部分霉菌毒素吸附剂吸附率评价采用的是高效液相色谱(HPLC)法<sup>[7,8]</sup>,灵敏度相对液质联用而言较低,测定步骤多,过程繁琐,同步测定多种毒素的能力较差。也有采用酶联免疫试剂盒(ELISA)法进行评价[9~11],结果可靠性差。(3)吸附对象 大部分霉菌毒素吸附剂吸附率测定对象采用AFB1<sup>[12]</sup>,其原因主要是AFB1较其他毒素更易于被吸附<sup>[13]</sup>。事实上,75%的饲料同时被多种毒素污染,且以DON、ZEA等为主[14, 15]。但是,多数种类的霉菌毒素吸附剂对DON和ZEA等吸附效果一般,甚至无效<sup>[16]</sup>。体内实验也表明,对AFB1吸附效果良好的一种吸附剂在同时受到多种霉菌毒素污染的饲料中使用效果不佳<sup>[17]</sup>。而且,吸附剂对霉菌毒素是非特异性吸附,饲料中的其他成分很可能会干扰吸附效果<sup>[18]</sup>。
霉菌毒素吸附剂吸附率评价的关键在于评价体系和霉菌毒素检测。目前,液相色谱串联质谱法(LC-MS/MS)在食品和饲料中多种霉菌毒素同步检测上得到了广泛应用<sup>[19]</sup>,但尚未见LC-MS/MS法用于霉菌毒素吸附剂体外吸附率测定的文献报道。本研究针对上述3个问题,通过模拟猪消化道环境和饲料基质特点制备了人工猪胃和小肠消化液,将饲料中霉菌毒素以外的其它成分引入吸附率评价体系中,并应用LC-MS/MS同时对3种主要毒素进行测定,能够更加全面、准确地测定霉菌毒素吸附剂的吸附率。
2 实验部分
2.1 仪器与试剂
TQD超高效液相色谱-串联质谱仪(美国Waters公司); RVC 2-18台式离心浓缩仪(德国Christ公司); 3K15高速冷冻离心机(美国Sigma公司); ZWY-200D恒温培养振荡器(上海智诚分析仪器制造有限公司); D37520高速离心机(美国Kendro公司)。
AFB1, DON和ZEA标准品(纯度≥99%,以色列Fermentek公司); 同位素内标13C17-AFB1、13C15-DON、13C18-ZEA(ROMER公司); MilliQ超纯水; 乙腈、甲醇、乙酸铵和甲酸(色谱纯,美国Fisher公司); 胃蛋白酶、胰蛋白酶、猪胆盐、氯化钠等常规试剂(分析纯,国药集团化学试剂有限公司)。霉菌毒素吸附剂从市场购买,其中主成分为蒙脱石类的8种产品,分别标识为浙江三鼎科技有限公司、攀枝花兴加环保技术有限公司、赤峰和正美化工有限公司、赤峰市物华天宝矿物材料有限公司、浙江丰虹新材料股份有限公司、寿光中联精细蒙脱石有限公司、内蒙古天源蒙脱石开发有限公司和内蒙古润隆化工有限责任公司;主成分为酵母细胞壁类的5种产品,分别标识为广东江门生物技术开发中心有限公司、北京优利保生物科技与技术有限责任公司、巴西ICC公司、上海沪鼎生物科技有限公司、安琪酵母股份有限公司。生长猪配合饲料样品由国家饲料质量监督检验中心(北京)惠赠。
2.2 溶液配制
2.2.1 霉菌毒素混合标准溶液的配制 分别准确移取浓度为1000 mg/L的AFB1,DON,ZEA 50,500和200 μL,用乙腈定容至10 mL,配制成为浓度分别为5,50和20 mg/L的霉菌毒素混合标准储备液,
2.2.2 混合同位素内标进样液的配制 分别准确移取400, 400和200 μL的13C17-AFB1(500 μg/L)、13C15-DON(25 mg/L)、13C18-ZEA(25 mg/L)置于2 mL离心管中,40 ℃条件下用离心浓缩仪1500 r/min旋干,进样液(0.2 mmol/L乙酸铵溶液-乙腈-甲酸,95∶4.9∶0.1, V/V)复溶,超声溶解2 min,移取并用进样液定容至100 mL,4 ℃保存。
2.2.3 人工猪胃消化液的制备
称取NaCl 2 g,胃蛋白酶3.2 g,量取36.5%浓HCl 7 mL,加水至1000 mL, 混匀,制得人工胃液。称取适量生长猪配合饲料于三角瓶中,按照质量体积比1∶3向其中加入人工胃液,用HCl调至pH=2.0±0.5,置于39 ℃±0.5 ℃恒温振荡器中220 r/min孵育1 h,静置1 min,转移上清液,并10000 r/min离心10 min,收集上清液于1000 mL试剂瓶,4 ℃保存待用。
2.2.4 人工猪小肠消化液的制备
称取KH2PO4 6.8 g,加水500 mL使溶解,用0.1 mol/L NaOH溶液调至pH 6.8,称取胰酶10 g,加水使溶解,将两溶液混合后,另加3 g猪胆盐,加水稀释至1000 mL,制得人工小肠液。将3倍体积的人工小肠液加入到人工胃液消化液制备时剩余的饲料沉淀中,置于39 ℃±0.5 ℃恒温振荡器中220 r/min孵育1 h,静置1 min,转移上清液, 并10000 r/min离心10 min,收集上清液于1000 mL试剂瓶,4 ℃保存待用。
2.3 样品处理
移取霉菌毒素混合标准储备液40 μL于50 mL 旋盖塑料离心管中,40 ℃氮气吹干,加入5 mL人工猪胃消化液复溶,再向其中准确加入霉菌毒素吸附剂4 mg±0.1 mg,涡旋混匀1 min,迅速水浴加热至39 ℃±0.5 ℃,然后置于恒温振荡器中39 ℃±0.5 ℃,220 r/min振荡孵育1 h,立即取出冷却静置。取1 mL上清液,13000 r/min离心5 min,取50 μL上清液与450 μL混合同位素内标进样液涡旋混匀,上机测定平衡后体系中游离毒素的浓度。每种吸附剂吸附率的测定设3个平行,并设不添加霉菌毒素吸附剂的基质校正组,人工小肠液消化液中游离毒素浓度测定步骤同上。吸附率(%)的计算公式为Y=(1- Ceq/C0) ×100%,式中Y为吸附率,C0为毒素初始(即基质校正组)浓度, Ceq为平衡后体系中游离毒素的浓度。
2.4 色谱和质谱条件
Acquity UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm,美国Waters公司); 柱温40 ℃,流速0.40 mL/min, 进样量5 μL。流动相A为0.2 mmol/L乙酸铵溶液,流动相B为0.1%甲酸-甲醇。梯度洗脱:0~0.5 min,90% A; 0.5~1.5 min,70% A; 1.5~2.5 min,40% A; 2.5~3.5 min,30% A; 3.5~4.0 min, 20% A; 4.0~4.2 min,90% A; 4.2~5.0 min,90% A。
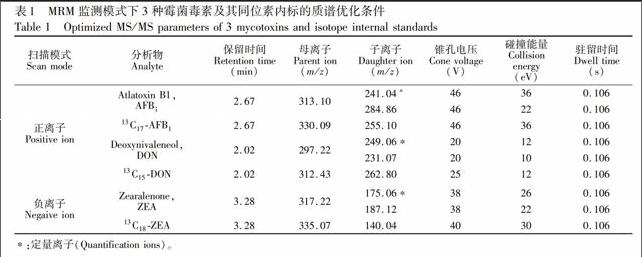
电喷雾离子源(ESI),离子源温度为150℃,脱溶剂温度为450 ℃,脱溶剂气和锥孔气均为N2,脱溶剂气流速为900 L/h,锥孔气流速为20 L/h。AFB1和DON采用正离子监测,ZEA采用负离子监测方式,毛细管电压为0.75 kV。采用多反应监测方式(MRM)检测,监测离子、碰撞能量、锥孔电压等参数见表1。
3 结果与讨论
3.1 质谱条件的优化
以甲醇-水(50∶50, V/V)为流动相,采用结合进样方式,对3种霉菌毒素及其同位素内标的质谱条件进行优化,在正负离子模式下进行全扫描,选择合适的准分子离子峰和电离方式。其中,AFB1和DON的准分子离子为正电离模式下获得的[M+H]+,ZEA因含有酚羟基结构,其准分子离子为负电离模式下获得的[M-H]
2.2.2 混合同位素内标进样液的配制 分别准确移取400, 400和200 μL的13C17-AFB1(500 μg/L)、13C15-DON(25 mg/L)、13C18-ZEA(25 mg/L)置于2 mL离心管中,40 ℃条件下用离心浓缩仪1500 r/min旋干,进样液(0.2 mmol/L乙酸铵溶液-乙腈-甲酸,95∶4.9∶0.1, V/V)复溶,超声溶解2 min,移取并用进样液定容至100 mL,4 ℃保存。
2.2.3 人工猪胃消化液的制备
称取NaCl 2 g,胃蛋白酶3.2 g,量取36.5%浓HCl 7 mL,加水至1000 mL, 混匀,制得人工胃液。称取适量生长猪配合饲料于三角瓶中,按照质量体积比1∶3向其中加入人工胃液,用HCl调至pH=2.0±0.5,置于39 ℃±0.5 ℃恒温振荡器中220 r/min孵育1 h,静置1 min,转移上清液,并10000 r/min离心10 min,收集上清液于1000 mL试剂瓶,4 ℃保存待用。
2.2.4 人工猪小肠消化液的制备
称取KH2PO4 6.8 g,加水500 mL使溶解,用0.1 mol/L NaOH溶液调至pH 6.8,称取胰酶10 g,加水使溶解,将两溶液混合后,另加3 g猪胆盐,加水稀释至1000 mL,制得人工小肠液。将3倍体积的人工小肠液加入到人工胃液消化液制备时剩余的饲料沉淀中,置于39 ℃±0.5 ℃恒温振荡器中220 r/min孵育1 h,静置1 min,转移上清液, 并10000 r/min离心10 min,收集上清液于1000 mL试剂瓶,4 ℃保存待用。
2.3 样品处理
移取霉菌毒素混合标准储备液40 μL于50 mL 旋盖塑料离心管中,40 ℃氮气吹干,加入5 mL人工猪胃消化液复溶,再向其中准确加入霉菌毒素吸附剂4 mg±0.1 mg,涡旋混匀1 min,迅速水浴加热至39 ℃±0.5 ℃,然后置于恒温振荡器中39 ℃±0.5 ℃,220 r/min振荡孵育1 h,立即取出冷却静置。取1 mL上清液,13000 r/min离心5 min,取50 μL上清液与450 μL混合同位素内标进样液涡旋混匀,上机测定平衡后体系中游离毒素的浓度。每种吸附剂吸附率的测定设3个平行,并设不添加霉菌毒素吸附剂的基质校正组,人工小肠液消化液中游离毒素浓度测定步骤同上。吸附率(%)的计算公式为Y=(1- Ceq/C0) ×100%,式中Y为吸附率,C0为毒素初始(即基质校正组)浓度, Ceq为平衡后体系中游离毒素的浓度。
2.4 色谱和质谱条件
Acquity UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm,美国Waters公司); 柱温40 ℃,流速0.40 mL/min, 进样量5 μL。流动相A为0.2 mmol/L乙酸铵溶液,流动相B为0.1%甲酸-甲醇。梯度洗脱:0~0.5 min,90% A; 0.5~1.5 min,70% A; 1.5~2.5 min,40% A; 2.5~3.5 min,30% A; 3.5~4.0 min, 20% A; 4.0~4.2 min,90% A; 4.2~5.0 min,90% A。
电喷雾离子源(ESI),离子源温度为150℃,脱溶剂温度为450 ℃,脱溶剂气和锥孔气均为N2,脱溶剂气流速为900 L/h,锥孔气流速为20 L/h。AFB1和DON采用正离子监测,ZEA采用负离子监测方式,毛细管电压为0.75 kV。采用多反应监测方式(MRM)检测,监测离子、碰撞能量、锥孔电压等参数见表1。
3 结果与讨论
3.1 质谱条件的优化
以甲醇-水(50∶50, V/V)为流动相,采用结合进样方式,对3种霉菌毒素及其同位素内标的质谱条件进行优化,在正负离子模式下进行全扫描,选择合适的准分子离子峰和电离方式。其中,AFB1和DON的准分子离子为正电离模式下获得的[M+H]+,ZEA因含有酚羟基结构,其准分子离子为负电离模式下获得的[M-H] Symbolm@@ 。有文献报道, DON采用加乙酸根离子<sup>[20]</sup>或减氢<sup>[21]</sup>的电离模式,但研究显示DON加氢模式同样能获得很好的响应。结合基质空白和基质标准液的离子扫描图,进一步优化确定了各种毒素的特征离子对等参数(表1)。
3.2 色谱条件优化
流动相的组成和配比不但影响目标化合物的色谱行为,还影响着目标化合物离子化效率和灵敏度。实验考察了0.2 mmol/L乙酸铵溶液/0.1%甲酸-甲醇(A)、0.2 mmol/L乙酸铵溶液/乙腈(B)、0.1%甲酸/0.1%甲酸-甲醇(C)、0.1%甲酸/乙腈(D)4种流动相体系对3种霉菌毒素的分离效果和峰信号强度。结果表明,3种毒素在A流动相体系下色谱峰分离效果好,信号峰响应值最高(表2)。进一步优化流动相条件,采用梯度洗脱,优化色谱条件下5 min内完成样品检测。3种霉菌毒素及其同位素内标的分离效果(以人工胃液为例)见图1。
3.3 基质效应
由于对样品采取稀释10倍的方法上机测定,没有进行净化处理,所以LC-MS/MS检测时有较强的基质效应。分别配制高中低3个浓度毒素添加的人工猪胃和小肠消化液,与进样浓度相同的标准溶液峰面积比较,计算外标法和内标法的基质效应(表3)。结果表明,采用外标法定量3种毒素的基质效应较强,精密度较差; 而采用内标法定量可较好地消除基质效应,提高精密度。虽然在吸附率评价中可采用基质加标校正曲线对目标物进行定量计算,但是考虑到基质效应会降低方法的线性、准确度和精密度<sup>[22]</sup>,以及不同吸附剂可能带来的基质效应差异,所以本研究采用内标法定量以消除基质效应的干扰。
3.4 线性方程、相关系数、定量限和精密度
准确移取100,40,20,10,5和2.5 μL霉菌毒素标准储备液,室温下氮气吹干,分别用5 mL人工胃液和小肠液消化液溶解制成系列
3.5 稳定性
霉菌毒素在体系中的稳定性是吸附率评价的重要影响因素。考察了3种霉菌毒素在人工猪胃和小肠消化液中39 ℃±0.5 ℃孵育10 h内的稳定性。按照2.3节处理样品,不添加霉菌毒素吸附剂,振荡孵育时间分别设为1, 2, 5和10 h,以孵育1 h时毒素峰面积和内标峰面积的比值为100%,其它时间点的测定结果介于95.9%~111.3%。结果表明,在试验温度条件下10 h内3种毒素在评价体系中不产生降解,能够稳定存在。
3.6 实际样品测定
以猪胃肠液与饲料比为3计,按照2.3节处理样品,相当于在AFB1, DON和ZEA污染浓度120, 1200和480 μg/kg的配合饲料中添加了0.24%的霉菌毒素吸附剂,这与生产实际状况比较接近。采用本方法对市售8种蒙脱石类吸附剂和5种酵母细胞壁类吸附剂进行评价,两类吸附剂产品在人工模拟猪胃消化液中对3种霉菌毒素的吸附率分别为85.1%~96.5%(AFB1), 8.1%~14.7%(DON), 13.7%~30.0%(ZEA)和7.4%~16.6%(AFB1), 6.9%~16.2%(DON), 18.6%~39.0%(ZEA),在人工模拟猪小肠消化液中对3种霉菌毒素的吸附率分别为76.2%~93.0%(AFB1), 12.3%~31.3%(DON), 0%~23.2%(ZEA)和8.6%~13.4%(AFB1), 3.8%~23.5%(DON), 24.9%~34.8%(ZEA)。测定结果符合两类吸附剂对不同毒素的吸附性质,与文献[4~6]报道的结论基本一致,表明本方法能够用于霉菌毒素吸附剂吸附率的测定。
References
1 Cao X Q, Wu S G, Yue Y, Wang S, Wang Y T, Li T, Tian H, Xie J M, Ding H. J. Chromatogr. B, 2013, (10): 942-943
2 Binder E M, Tan L M, Chin L J, Handl J, Richard J. Animal Feed Science and Technology, 2007, 137(3): 265-282
3 WANG Jin-Yong, LIU Ying-Li, GUAN Shu. Chinese Animal Husbandry, 2013, 49(4): 29-34
王金勇, 刘颖莉, 关 舒. 中国畜牧杂志, 2013, 49(4): 29-34
4 Galvano F, Piva A, Ritieni A, Galvano G. J. Food Protect., 2001, 64(1): 120-131
5 Jard G, Liboz T, Mathieu F, Guyonvarch A, Lebrihi A. Food Addit. Contam.: Part A, 2011, 28(11): 1590-1609
6 Whitlow L W. Proceedings of the 4th Mid-Atlantic Nutrition Conference, 2006: 132-143
7 Kolosova A, Stroka J. Food Addi. Contam.: Part A, 2012, 29(12): 1959-1971
8 LI Juan-Juan, SUO De-Cheng, SU Xiao-Ou. Agricultural Sciences in China, 2009, 42(11): 4027-4034
李娟娟, 索德成, 苏晓鸥. 中国农业科学, 2009, 42(11): 4027-4034
9 ZENG Lu, YAN Chun-Jie, CHEN Gang, YU Chan-Chan. Chinese Journal of Animal Science, 2011, 47(8): 64-66
曾 路, 严春杰, 谌 刚, 俞婵婵. 中国畜牧杂志, 2011, 47(8): 64-66
10 QI Juan, ZHU Feng-Hua, CHEN Pu, SU Qiang, ZHANG Jiao-Jiao, ZHU Lian-Qin. Jiangsu Agricultural Sciences, 2013, 40(11): 217-218
齐 娟, 朱风华, 陈 甫, 苏 强, 张娇娇, 朱连勤. 江苏农业科学, 2013, 40(11): 217-218
11 YE Sheng-Qun, CHEN Gang. Feed Industry, 2012, (11): 28-30
叶盛群, 谌 刚. 饲料工业, 2012, (11): 28-30
12 Huwig A, Freimund S, Kappeli O, Dutler H. Toxicology Letters, 2001, 122(2): 179-188
13 Doll S, Danicke S, Valenta H, Flachowsky G. Archives of Animal Nutrition, 2004, 58(4): 311-324
14 Monbaliu S,van Poucke C, Detavernier C, Dumoulin F, van de Velde M, Schoeters E, van Duck S, Averkieva O, van Peteghem C, de Saeger S. J. Agr. Food Chem., 2009, 58(1): 66-71
15 Binder E M, Tan L M, Chin L J, Handl J, Richard J. Animal Feed Science and Technology, 2007, 137(3): 265-282
16 Kabak B, Dobson A D, Var I. Crit. Rev. Food Sci. Nutr., 2006, 46(8): 593-619
17 Watts C M, Chen Y C, Ledoux D R, Broomhead J N, Bermudez A J, Rottinghaus G E. Inter. J. Poultry Sci., 2003, 2(6): 372-378
18 Mayura K, Abdel-Wahhab M A, McKenzie K S, Sarr A B, Edward J F, Naguib K, Phillips T D. Toxicological Sciences, 1998, 41(2): 175-182
19 Shephard G S, Berthiller F, Burdaspal P A, Crews C, Jonker M A, Krska R, Lattanzio V M T, Macdonald S, Malone R J, Maragos C, Sabino M, Solfrizzo M, Egmond H P, Whitaker T B. World Mycotoxin Journal, 2012, 5(1): 3-30
20 Han Z, Ren Y, Zhu J, Cai Z H, Chen Y, Luan L J, Wu Y J. Journal of Agricultural and Food Chemistry, 2012, 60(33): 8233-8247
21 Biselli S, Hummert C. Food Additives and Contaminants, 2005, 22(8): 752-760
22 XIANG Ping, SHEN Min, ZHUO Xian-Yi. Journal of Instrumental Analysis, 2009, 28(6): 753-756
向 平, 沈 敏, 卓先义. 分析测试学报, 2009, 28(6): 753-756
Rapid and Sensitive LC-MS/MS Determination of Aflatoxin B1,
Deoxynivalenol, Zearalenone in Artificial Porcine
Gastrointestinal Digested Juices
WANG Rui-Guo, SU Xiao-Ou, FAN Xia, WANG Pei-Long, GAO Zhong-Wu, ZHANG Yu
(Institute of quality standards and testing technology for agricultural products, Chinese Academy of Agricultural Science,
Key laboratory of agrifood safety and quality, Ministry of AgricuLture, P.R.China, Beijing 10081, China)
Abstract A rapid liquid chromatography-tandem mass spectrometric (LC-MS/MS) method was developed for the determination of aflatoxin B1(AFB1), Deoxynivalenol (DON), Zearalenone (ZEA) in artificial porcine gastrointestinal digested juices, as pigs reacted most sensitively to these mycotoxins. The formula feed was digested by artificial gastric and intestinal juices respectively, then the mycotoxins and adsorbent were added in ratio. After incubation and centrifugation, the supernatant was diluted 10-folds by injection solution and analyzed by LC-MS/MS. The 3 analytes were separated on a reversed phase C18 column using a gradient elution program of aqueous solution containing 0.2 mmol/L ammonium acetate and 0.1% formic acid methanol. Qualitative analysis was performed using multiple-reaction monitoring (MRM), and quantitative analysis was by internal standard method. Under optimum conditions, the limit of quantitation (LOQ) of AFB1, DON, ZEA was 1, 50, 40 and 0.3, 50, 20 μg/L in artificial gastric and intestinal digested juices respectively, and the relative standard deviations (RSDs) were below 5.0%. Then, the thermal stability was studied by incubating the analytes at 39 ℃±0.5 ℃ for 1, 2, 5 and 10 h, and the results showed 3 analytes were stable under the conditions. Furthermore, the method was applied to evaluate the binding efficacy of 8 mineral benders and 5 organic adsorbents. The adsorbents demonstrated binding efficacy of 85.1%-96.5%, 8.1%-14.7%, 13.7%-30.0% and 7.4%-16.6%, 6.7%-16.2%, 18.6%-39.0% in gastric digested juice, and 76.2%-93.0%, 12.3%-31.3%, 0%-23.2% and 8.6%-13.4%, 3.8%-23.5%, 24.9%-34.8% in intestinal digested juice for these 3 mycotoxins, respectively, with 2 kinds of adsorbents.
Keywords Liquid chromatography-tandem mass spectrometry; Artificial porcine gastrointestinal digested juice; Mycotoxin; Adsorbent
(Received 7 August 2014; accepted 4 October 2014)

