血液中15N标记氨基酸同位素丰度
雷雯等


摘 要 以硅烷化试剂N-甲基-N-(三甲基硅烷)三氟乙酰胺(MSTFA)对氨基酸加以衍生,建立了衍生化15N标记丙氨酸、甘氨酸、天冬氨酸、谷氨酸和尿素同位素丰度的气相色谱-质谱联用检测方法。在优化的色谱和质谱条件下,5种衍生化物均得到基线分离。通过对5种衍生化物的EI质谱图进行解析,选择合适的特征碎片离子作为同位素丰度的计算依据,并采用同位素峰簇算法计算同位素丰度,实现了多种化合物同位素丰度同时测定。以高丰度15N标记氨基酸和尿素对照品对方法进行验证,方法的精密度优于0.15%,同位素丰度相对偏差小于1.4%。本方法已成功用于测定动物血液中15N标记的4种氨基酸和尿素的同位素丰度。
关键词 同位素丰度; 氨基酸; 气相色谱-质谱联用; 氮同位素标记
1 引 言
在生物医学领域,稳定同位素标记氨基酸常作为示踪剂对生物体的新陈代谢[1]进行表达或用于蛋白质合成率[2]的测定,同时也被用于蛋白质定量组学[3]。通过将标记的氨基酸如甘氨酸-15N、丙氨酸-15N、谷氨酸-15N等经静脉注射入生物体内,通过测定血液、尿液或组织样品中同位素丰度则可计算出蛋白质的更新率、合成率和分解率等,而尿素是代谢过程中的最终产物,因而监测尿素-15N2的同位素丰度也可提供相应的代谢信息。《Cell》杂志近期报道了以同位素标记的谷氨酰胺和葡萄糖作为示踪剂,得到在MYC癌基因表达及缺氧的条件下细胞中谷氨酰胺的代谢情况,从而指导癌症疾病的靶向治疗的研究[4]。血液或组织液中标记氨基酸同位素丰度的准确测定直接影响到了代谢过程的精准表达。气体同位素质谱法可用于化学纯度较高的单一氨基酸同位素丰度的测定[5]。而实际血液或组织液样品中基质较为复杂,氨基酸含量较低[6~8],其同位素丰度的检测则是难点所在。Nakamura等[9]使用LC-MS/MS分析了老鼠血浆氮代谢循环中多种氨基酸15N与14N的同位素丰度比((M+1)/M),从而反应出15N在老鼠不同部位的富集情况。江骥等[10]采用衍生化-气相色谱-质谱(GC-MS)联用法测定了血浆中15N标记甘氨酸的同位素丰度。在13C代谢流分析中,有报道使用GC-MS测定了大肠杆菌、酵母等微生物中或菌体蛋白中13C标记氨基酸同位素丰度[11,12]。目前还未有GC-MS同时测定血浆或组织液中15N标记多种氨基酸同位素丰度的报道。本研究采用GC-MS法研究血液中15N标记丙氨酸、甘氨酸、天冬氨酸、谷氨酸和尿素的同位素丰度同时测定的方法,首先在优化的GC-MS条件下对上述5种化合物进行分离,分析每种氨基酸衍生物在EI谱图的碎裂规律,找出适用于15N同位素丰度计算的碎片离子,建立同位素丰度计算方法; 进而对高丰度氨基酸和尿素对照品进行测定, 以验证方法的准确性; 最后对实际血液样品进行分析。
2 实验部分
2.1 仪器与试剂
气相色谱-质谱联用仪(GC-MS/MS,7890B-7000C,美国Agilent公司); HP-5MS毛细管柱(30 m×0.25 mm×0.25 μm, 美国Agilent公司); 超纯水系统(美国Merck Millipore Simplicity公司); 低温高速离心机(韩国Heraeus); 电子天平(美国Ohaus,精度0.01 mg),氮吹仪(上海安谱科技有限公司)。
硅烷化试剂N-甲基-N-(三甲基硅烷)三氟乙酰胺(MSTFA, 美国RegisTechnologies公司); 天然丰度氨基酸对照品丙氨酸(纯度98.5%)、甘氨酸(纯度99%)、谷氨酸(纯度98.5%)、天冬氨酸(纯度98.5%)均购于上海惠兴生化试剂有限公司; 尿素(纯度98.5%,美国USP公司); 稳定同位素15N标记丙氨酸(纯度98%,丰度98.52%),甘氨酸(纯度98%,丰度98.10%),谷氨酸(纯度98%,丰度98.11%),天冬氨酸(纯度98%,丰度98.07%),尿素-15N2(纯度99%,丰度98.14%)均为上海化工研究院同位素所研制产品,同位素丰度由气体同位素质谱仪测定,作为高丰度对照品使用; 动物血液样品(羊血液,西南大学提供),甲酸(HPLC级,CNW公司); 乙腈(LC-MS级,Scharlab公司); 吡啶和甲氧胺(分析纯,上海凌峰化学试剂有限公司)。
2.2 实验方法
2.2.1 样品制备 天然丰度对照品:分别称取1.0 mg甘氨酸、1.2 mg丙氨酸、1.8 mg天冬氨酸、2.0 mg谷氨酸、1 mg尿素于1.5 mL气相进样瓶。40℃下真空干燥2 h,加入2%甲氧胺吡啶溶液600 μL,充分溶解混合后,放入烘箱37℃下预混合1 h。加入600 μL MSTFA,60℃下反应2 h,待GC-MS分析。高丰度对照品的处理方法同天然丰度对照品。
血液实际样品:取待测血样1 mL,加入9 mL丙酮于25 mL离心管中充分混合,在4000 r/min下离心10 min,然后取上清液,氮吹至干燥,加入2%甲氧胺吡啶溶液300 μL,充分溶解混合后,放入烘箱37℃下预混合1 h。加入300 μL MSTFA,60℃下反应2 h,经0.22 μm滤头过滤后待GC-MS分析。
2.2.2 实验条件 色谱条件:色谱柱:Agilent HP-5 MS毛细管柱(30 m×0.25 mm×0.25 μm); 载气He(99.999%),流速1.0 mL/min; 进样口温度290℃; 升温程序:初始100℃, 以40℃/min升温至160℃,再以10℃/min升温至250℃,最后以20℃/min升温至300℃; 进样量1.0 μL,分流比50∶1。
GC-MS质谱分析条件:电子轰击离子源(EI),电离能量70 eV; 全扫描(Scan)模式,扫描范围m/z 50~400; 离子源温度230℃,四级杆温度150℃,接口温度300℃。
3 结果与讨论
3.1 GC-MS图谱分析
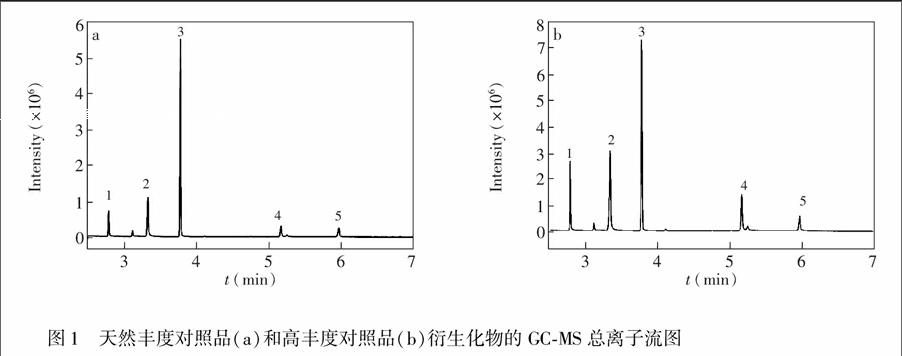
对气相色谱升温程序进行了优化,在优化的色谱条件下,按照出峰顺序,天然丰度丙氨酸、尿素、甘氨酸、天冬氨酸和谷氨酸均基线分离,且峰型良好,总离子流图(TIC)如图1a所示。高丰度对照品与天然丰度对照品保留时间一致,如图1b所示。
3.2 衍生化氨基酸特征离子解析
通过对GC-MS的TIC图进一步解析,可以得到每种氨基酸的EI质谱图。氨基酸在与MSTFA衍生化试剂反应后,其结构和分子量均发生了变化。以丙氨酸为例,氨基端的和羧基端的氢原子分别与硅烷化试剂反应,相对分子量由89变为233,如图2所示。其余氨基酸的反应机理与甘氨酸相似,尿素则为两个氨基酸的氢与硅烷化试剂反应,反应后各物质的相对分子量列于表1。
在上述物质衍生物的EI谱图中,分子离子峰几乎完全碎裂为碎片离子,对于15N同位素丰度的计算,需要选择带有N原子的碎片离子进行计算,并且为了减小误差,该碎片离子最好为基峰或者具有较高的峰强度。以丙氨酸为例,天然丰度标准品的EI质谱图如图3a所示。丙氨酸衍生物的分子离子峰完全碎裂为碎片离子,其中m/z 116的碎片离子结构如图4中方框中所示,其中N原子为标记位点(图中*为15N标记位点),因此该碎片离子可用于同位素丰度计算。由图3b可见,高丰度丙氨酸的特征离子为m/z 117,与图4中标记位点相符。尿素、甘氨酸、天冬氨酸和谷氨酸的特征离子选择原则与甘氨酸类似,特征离子的碎裂情况和相对分子量均列于表1。
3.3 同位素丰度计算
以丙氨酸衍生物为例,天然丰度的特征离子m/z 116具有天然的同位素分布,包括m/z 116,117和118的同位素峰簇,其天然的同位素丰度比为100∶12.8∶4.5,归一化之后为0.852∶0.109∶0.038。相应的,15N标记的特征离子所对应的峰为m/z 117,其同位素峰簇为m/z 117,118和119,如表2所示。然而,在实际样品中可能会出现不完全标记的情况,质谱图中同时存在C5H1414NSi +·和C5H1415NSi +·两种离子,定义以上两种离子的摩尔分数分别为X0和X1,二者相对分子质量差1 dalton,这两种离子均具有一致的同位素分布,即同位素峰簇的峰强比一致,定义A0i和A1i分别为X0和X1在m/z=i时的峰强,从而得出式(1)。在实测质谱图中m/z 60 ~ 63范围内的质谱峰强度为两种离子同位素峰簇的叠加,定义Amixi为实测质谱图在m/z=i时的峰强,则有式(2)~(5)。
同时,各类离子摩尔分数之和应该为1,因此x0 +x1=1。由于方程个数大于未知数,因此使用式(1)~(3)即可求解,通过联立解方程组,求得两种离子的摩尔分数。进而,由式(6)求得丙氨酸的15N同位素丰度。由于氨基酸的标记个数为1个,因此所得到分子百分比等于氨基酸的原子百分比。
使用相同的方法,结合表1中的特征离子和表3中的天然同位素分布,可对甘氨酸、天冬氨酸和谷氨酸进行计算,结果列于表3。由于15N标记的尿素有两个标记位点,因此在实际样品中会出现C6H17OSi214N14N+·,C6H17OSi214N15N+·和C6H17OSi215N15N+·这种情况,需要定义这3种离子为x0,x1和x2,相似的方法联立方程组求得3种离子的分子百分比。由于尿素-15N2的标记个数为2个,其15N 原子百分比与分子百分比不同,需要使用式(6)求解,计算结果列于表3。由于天然丰度分布的基准同样为衍生化后的特征离子,因此衍生化试剂所引入同位素丰度变化可以在计算过程中被抵消,所得到衍生化氨基酸的同位素丰度值即为目标氨基酸的同位素丰度。
由表3可见,方法精密度良好,符合检测要求。其中,4种氨基酸的精密度均小于0.1%,1: Alanine, 2: Urea, 3: Glycine, 4: Aspartic acid, 5: Glutamic acid.尿素为0.1%。上述5种高丰度化合物由同位素质谱仪测定的同位素丰度对照值同样列于表3,计算值与对照值基本符合,相对偏差均小于1.4%。
因此,所发展的同位素丰度计算方法可以满足测定需求。
3.4 实际血液样品的检测
对血液样品进行前处理,使用方法进行分析,GC-MS离子流图如图5所示,图中可以识别40余个峰,其中种目标化合物均被检出。丙氨酸、尿素、甘氨酸、天冬氨酸和谷氨酸衍生物的EI质谱图如图6所示,每种化合物的保留时间与天然丰度对照品一一对应(图1a),特征离子与表1一致。通过质谱图(图6)中特征离子峰簇,计算得出同位素丰度值列于表4。因此,所发展的方法可以成功测定血液中氨基酸和尿素的同位素丰度值。
4 结 论
建立了衍生化-气质联用测定血液中丙氨酸、甘氨酸、天冬氨酸、谷氨酸和尿素同位素丰度的方法。对衍生化的氨基酸和尿素的EI质谱图进行解析,选择了包含同位素标记位点且峰强度较高的碎片离子作为同位素丰度的计算依据,使用同位素峰簇算法对同位素丰度进行计算。使用高丰度的氨基酸和尿素对照品对方法进行验证,方法的精密度优于0.15%,同位素丰度相对偏差小于1.4%。方法还可以扩展至生物体组织、尿液等实际样品中氨基酸或尿素的同位素丰度检测。
References
1 LI Peng-Fei, WANG Yan, TAO Bei-Bei, WANG Jing, LUO Jing, ZHANG Xu-De, AN Zhuo-Ling, LIU Li-Hong. Chinese J. Anal. Chem., 2012, 40(5): 762-767
李鹏飞, 王 燕, 陶蓓蓓, 王 静, 罗 静, 张绪得, 安卓玲, 刘丽宏. 分析化学, 2012, 40(5): 762-767
2 ZHOU Ji-Hong, LI You-Sheng, LI Jie-Shou. Parenteral & Enteral Nutrition, 2005, 12(1): 46-49
周济宏, 李幼生, 黎介寿. 肠外与肠内营养, 2005, 12(1): 46-49
3 Webhofer C, Zhang Y, Brusis J, Reckow S, Landgraf R, Maccarrone G, Turck C W, Filiou M D. Journal of Proteomics., 2013, 88(2): 27-33
4 Le A, Lane A N, Hamaker M, Bose S, Gouw A, Barbi J, Tsukamoto T, Rojas C J, Slusher B S, Zhang H, Zimmerman L J, Liebler D C, Slebos R J C, Lorkiewicz P K, Higashi R M, Fan T W M, Dang C V. Cell Metabolism, 2012, 15(1): 110-121
5 SONG Ming-Ming, DU Xiao-Ning. Journal of Isotopes, 2010, 11(4): 23-27
宋明鸣, 杜晓宁. 同位素, 2010, 11(4): 23-27
6 LI Peng-Fei, TAO Bei-Bei, ZHANG Xu-De, AN Zhuo-Ling, ZHANG Qian, LI Yue, HAO Qian-Qian, LIU Li-Hong. Chinese J. Anal. Chem., 2013, 41(9): 1347-1352
李鹏飞, 陶蓓蓓, 张绪得, 安卓玲, 张 茜, 李 悦, 郝倩倩, 刘丽宏. 分析化学, 2013, 41(9): 1347-1352
7 YANG Fen, WANG Hong-Yun, HU Bei, JIANG Ji. Chin. J. Pharm. Anal., 2013, 33(8): 1322-1326
杨 芬, 王洪允, 胡 蓓, 江 骥. 药物分析杂志, 2013, 33(8): 1322-1326
8 Bruckner H, Haasmann S, Friedric A. Amino Acids, 1994, 6(2): 205-211
9 Nakamura H, Karakawa S, Watanabe A, Kawamata Y, Kuwahara T, Shimbo K, Sakai R. Anal. Biochem., 2015, 475(1): 67-77
10 JIANG Ji, WANG Shi-Zhen. Nuclear Electronics & Detection Technology, 1984, 4(1): 19-25
江 骥, 王世真. 核电子学与探测技术, 1984, 4(1): 19-25
11 LI Ming-Chao, HUANG Ming-Zhi, LIU Yu-Wei, CHU Ju, ZHUANG Ying-Ping, ZHANG Si-Liang. Chinese J. Anal. Chem., 2014, 42(10): 1408-1413
李敏超, 黄明志, 刘玉伟, 储 炬, 庄英萍, 张嗣良. 分析化学, 2014, 42(10): 1408-1413
12 WANG Jian, WANG Ze-Jian, HUANG Ming-Zhi, QIAN Jiang-Chao, CHU Ju, ZHANG Si-Liang. China Biotechnology, 2009, 29(7): 87-93
王 建, 王泽建, 黄明志, 钱江潮, 储 炬, 张嗣良. 中国生物工程杂志, 2009, 29(7): 87-93

