不同产地苦杏仁药材及其饮片水提液HPLC指纹图谱研究
胡祥昊,李亚男,孙志强,高鹏,代龙*
(1.山东中医药大学药学院,山东 济南 250355; 2.山东禹泽药康产业技术研究院有限公司,山东 德州 251200)
苦杏仁为蔷薇科植物山杏PrunusarmeniacaL.var.ansuMaxim、西伯利亚杏PrunussibiricaL.、东北杏Prunusmandshurica(Maxim.)Koehne或杏PrunusarmeniacaL.的干燥成熟种子[1],有降气止咳平喘、润肠通便的功效,主要含苦杏仁苷、脂肪、蛋白质和多种微量元素[2-3],其中苦杏仁苷口服进入体内后,在β-葡萄糖苷酶的作用下生成氢氰酸,为镇咳、平喘的主要药效成分,同时也是苦杏仁的毒性成分[4-5]。目前已有甲醇超声提取苦杏仁药材用于指纹图谱研究的相关报道[6],而古代典籍中经典名方大部分采用水煎煮[7]。因此,本实验采用苦杏仁药材水提液进行指纹图谱研究,并对比分析生杏仁与燀杏仁的指纹图谱,阐明苦杏仁炮制过程中有效成分的传递关系,旨在为含苦杏仁的制剂指纹图谱研究提供参考。
1 仪器和材料
1.1 仪器
LC-2030型高效液相色谱仪(日本岛津制作所);十万分之一分析天平(瑞士梅特勒-托利多仪器有限公司);KDM型可调控温电热套(山东鄄城华鲁电热仪器有限公司);高速万能粉碎机(天津市泰斯特仪器有限公司)。
1.2 药品与试剂
本实验所用15批苦杏仁药材由安徽济人药业有限公司提供,采购于山西省运城市万荣县等3个不同产地,见表1,经济南市食品药品检验所主任药师宋希贵鉴定为蔷薇科植物山杏PrunusarmeniacaL.var.ansuMaxim的干燥种子;苦杏仁苷对照品(批号:110820-201808)采购于中国食品药品检定研究院;水为娃哈哈纯净水,甲醇、乙腈均为色谱纯。

表1 苦杏仁药材来源信息
2 实验方法
2.1 色谱条件
采用Kinetex C18(2.6 μm, 100 mm×4.6 mm)色谱柱,流动相为乙腈-水,检测波长210 nm,流速0.6 mL·min-1, 柱温20 ℃,进样量10 μL;流动相梯度洗脱比例见表2。

表2 HPLC梯度洗脱程序表
2.2 对照品溶液的制备
精密称取苦杏仁苷对照品10.00 mg,置25 mL容量瓶中,加HPLC级甲醇定容至刻度,摇匀,作为对照品母液。精密量取1 mL母液置10 mL容量瓶中,加甲醇定容至刻度,摇匀,即得。
2.3 燀杏仁的制备
取苦杏仁药材,除去杂质。加10倍量水,煮沸后将苦杏仁倒入沸水中,燀制10 min,捞出,放入冷水中,除去种皮,60 ℃烘干[8]。
2.4 供试品溶液的制备
称取苦杏仁粉末(过二号筛)约1.0 g,置圆底烧瓶中,加水50 mL, 置电热套上回流1 h,加水补足减重,趁热滤过,续滤液过0.45 μm微孔滤头,即得。
3 实验结果与分析
3.1 精密度
取同一批苦杏仁药材供试品溶液,按2.1项下液相条件连续进样6次,结果见图1。以图6b中7号峰为参照峰,结果7个共有峰的相对保留时间、相对标准偏差均小于3%,相对峰面积的相对标准偏差均小于5%,表明仪器精密度良好。
3.2 稳定性
取同一批苦杏仁药材供试品溶液,按2.1项下液相条件分别在0、3、6、9、12、15 h进样6次,结果见图2。7个共有峰的相对保留时间相对标准偏差均小于3%,相对峰面积的相对标准偏差均小于5%,表明15 h内苦杏仁药材供试品稳定性良好。
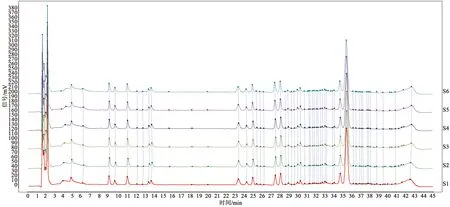
图2 稳定性实验图谱匹配结果Fig.2 Chromatogram matching results of the stability test
3.3 重复性
取同一批苦杏仁药材粉末称取6份,按2.4项下方法平行制备供试品溶液,按2.1项下条件测定,记录色谱图,结果见图3。结果7个共有峰的相对保留时间相对标准偏差均小于3%,相对峰面积的相对标准偏差均小于5%,表明该方法重复性较好。
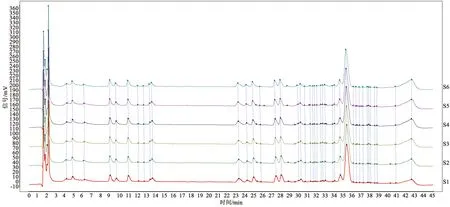
图3 重复性实验图谱匹配结果Fig.3 Chromatogram matching results of the repeatability test
3.4 参照峰的选择
取15批不同产地的苦杏仁药材,按照2.4项下样品制备方法平行制备15批样品,并依次按2.1项下液相条件进行指纹图谱分析,对比15批药材的7个共有峰,发现7号峰分离度较好且具有较大的峰面积,因此选择7号峰作为参照峰。
3.5 指纹图谱数据分析
通过对15批不同产地苦杏仁药材的指纹图谱色谱峰进行分析,共确定了14个共有峰,其中7个共有峰(图6b)峰形较好,且分离度大于1.5,因此选取7个峰作为共有指纹峰进行方法学考察。分别计算7个共有峰的相对保留时间,其相对保留时间的相对标准偏差均小于3%,符合指纹图谱的要求。运用中药色谱指纹图谱相似度评价系统计算可知[9],15批苦杏仁指纹图谱(图4)相似度在0.97~0.99之间(表3),表明各批次样品之间具有较高的相似度,不同产地的苦杏仁药材指纹图谱差别不大。

图4 15批苦杏仁药材指纹图谱Fig.4 Fingerprint chromatogram of 15 batches of Semen Armeniacae Amarae
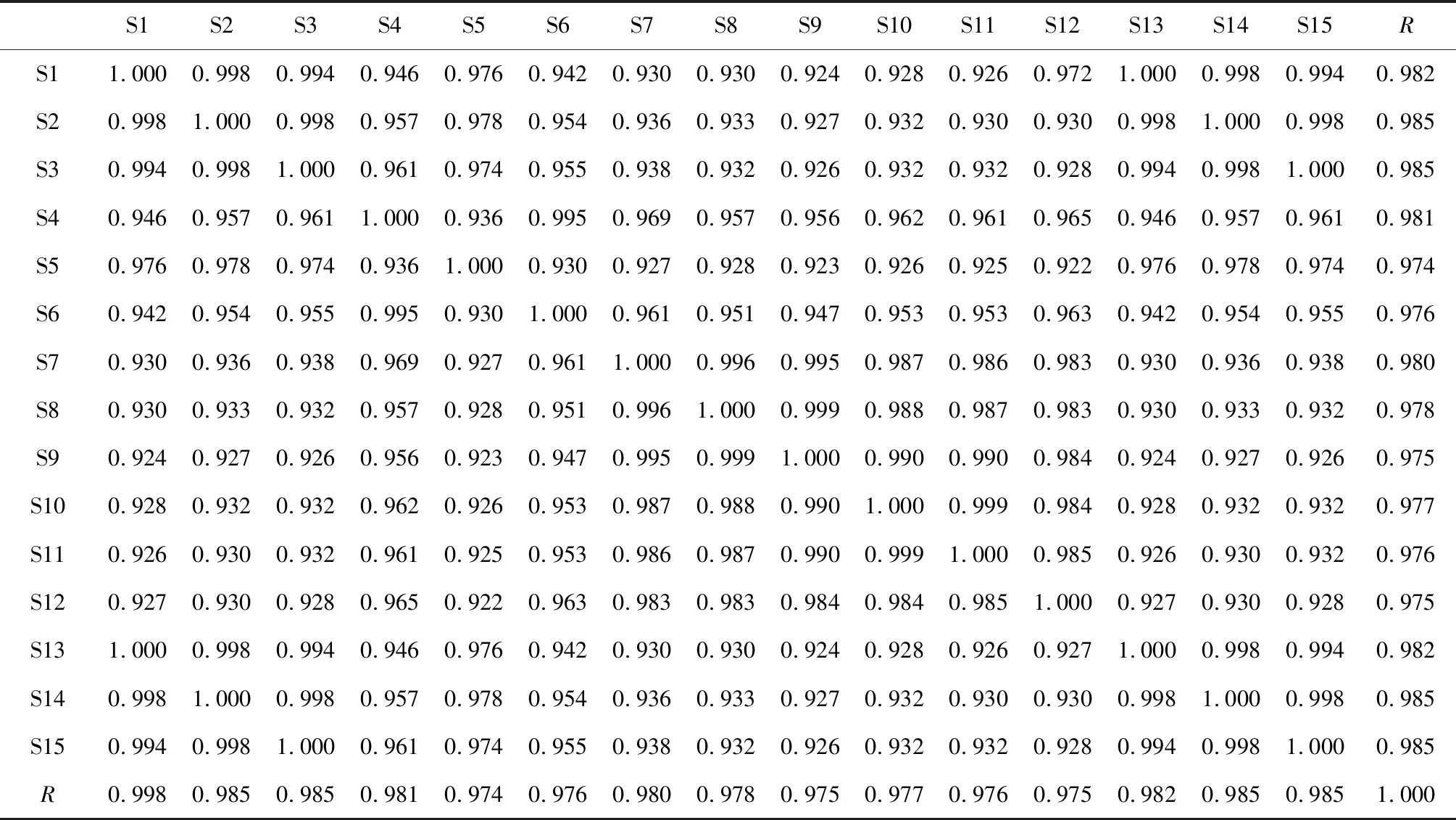
S1S2S3S4S5S6S7S8S9S10S11S12S13S14S15RS11.0000.9980.9940.9460.9760.9420.9300.9300.9240.9280.9260.9721.0000.9980.9940.982S20.9981.0000.9980.9570.9780.9540.9360.9330.9270.9320.9300.9300.9981.0000.9980.985S30.9940.9981.0000.9610.9740.9550.9380.9320.9260.9320.9320.9280.9940.9981.0000.985S40.9460.9570.9611.0000.9360.9950.9690.9570.9560.9620.9610.9650.9460.9570.9610.981S50.9760.9780.9740.9361.0000.9300.9270.9280.9230.9260.9250.9220.9760.9780.9740.974S60.9420.9540.9550.9950.9301.0000.9610.9510.9470.9530.9530.9630.9420.9540.9550.976S70.9300.9360.9380.9690.9270.9611.0000.9960.9950.9870.9860.9830.9300.9360.9380.980S80.9300.9330.9320.9570.9280.9510.9961.0000.9990.9880.9870.9830.9300.9330.9320.978S90.9240.9270.9260.9560.9230.9470.9950.9991.0000.9900.9900.9840.9240.9270.9260.975S100.9280.9320.9320.9620.9260.9530.9870.9880.9901.0000.9990.9840.9280.9320.9320.977S110.9260.9300.9320.9610.9250.9530.9860.9870.9900.9991.0000.9850.9260.9300.9320.976S120.9270.9300.9280.9650.9220.9630.9830.9830.9840.9840.9851.0000.9270.9300.9280.975S131.0000.9980.9940.9460.9760.9420.9300.9300.9240.9280.9260.9271.0000.9980.9940.982S140.9981.0000.9980.9570.9780.9540.9360.9330.9270.9320.9300.9300.9981.0000.9980.985S150.9940.9981.0000.9610.9740.9550.9380.9320.9260.9320.9320.9280.9940.9981.0000.985R0.9980.9850.9850.9810.9740.9760.9800.9780.9750.9770.9760.9750.9820.9850.9851.000
3.6 生杏仁与燀杏仁HPLC指纹图谱比较
取15批不同产地的苦杏仁药材,按照2.3项下制备方法制备15批燀杏仁,并按照2.4项下样品制备方法平行制备15批样品,依次按2.1项下液相条件进行指纹图谱分析,结果见图5。
通过对苦杏仁药材与燀杏仁的HPLC指纹图谱分析(图6),结果显示5、6号峰(图6b)为生杏仁和燀杏仁的共有峰,且燀杏仁中苦杏仁苷含量远大于生杏仁,说明燀杏仁中的苦杏仁苷酶在高温条件下失活,达到了“杀酶保苷”的作用。另外燀杏仁中明显缺少1、3、7号峰,可能是由于这3个峰为苦杏仁苷水解产物,生杏仁在提取过程中遇水酶解,而燀杏仁由于酶失活,无法酶解生成1、3、7号峰。
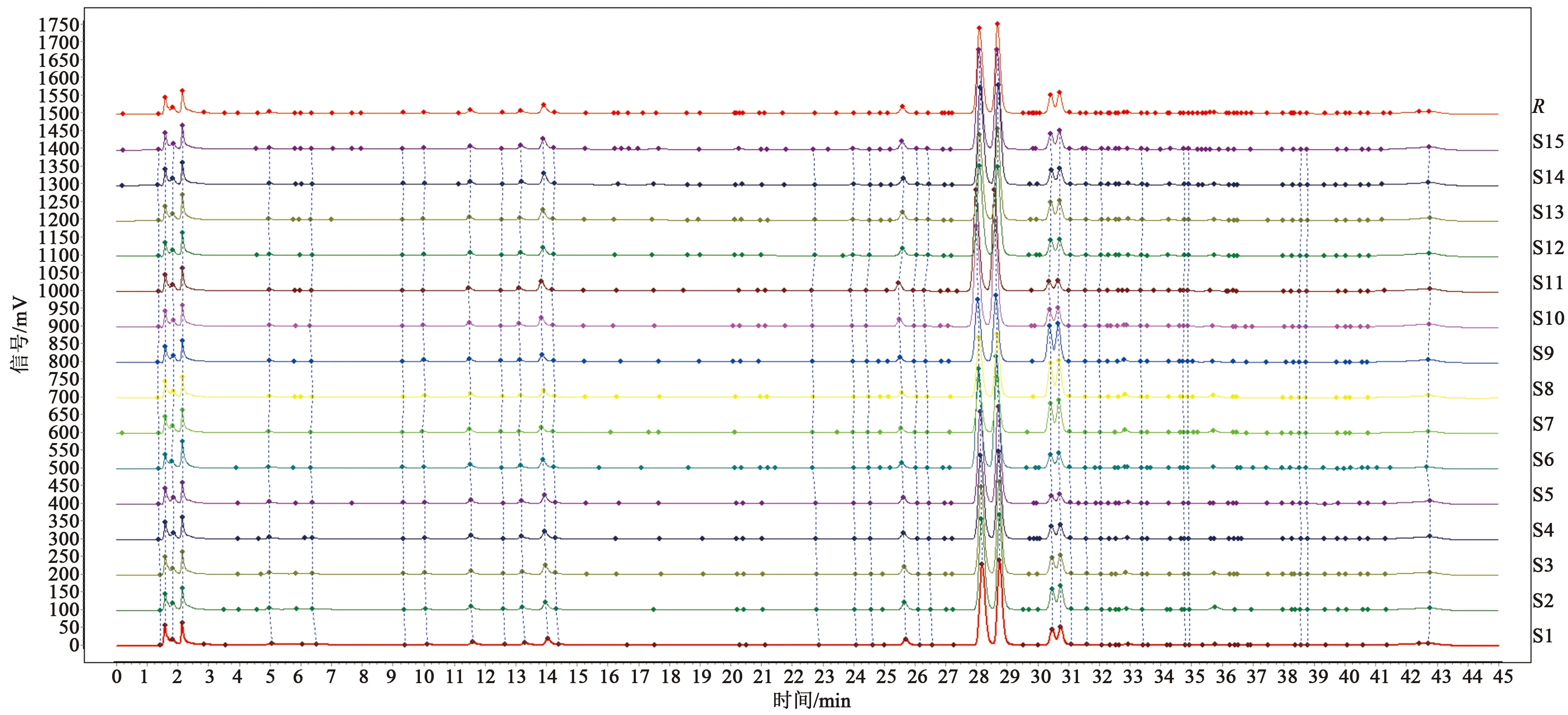
图5 15批燀杏仁指纹图谱Fig.5 Fingerprint chromatogram of 15 batches of blanched almonds
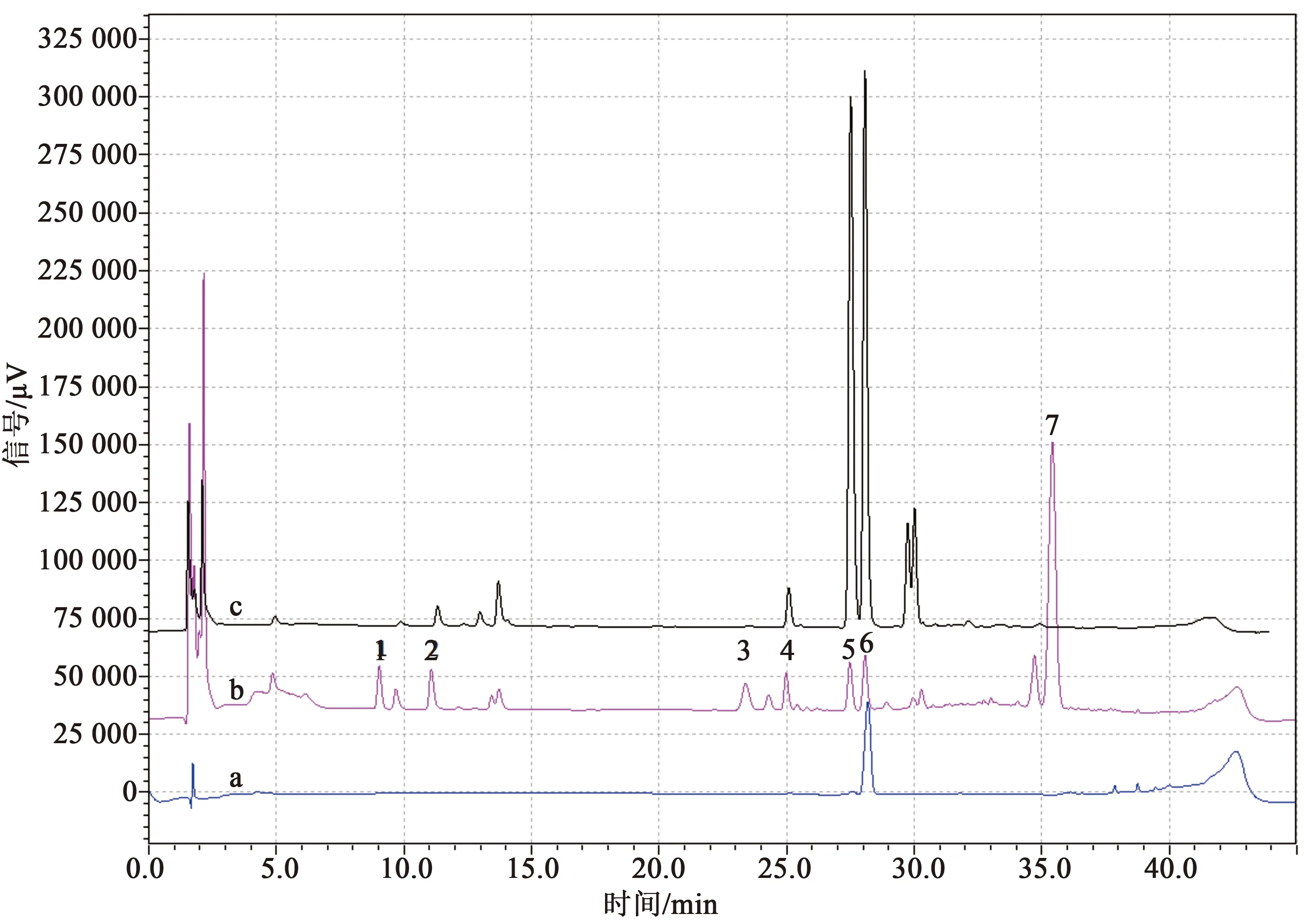
a苦杏仁苷对照品;b苦杏仁药材(批号:Y18052801)供试品;c燀杏仁(批号:P18052801)供试品图6 苦杏仁药材与燀杏仁高效液相色谱图Fig.6 High performance liquid chromatogram
4 讨论
本实验采用HPLC法进行苦杏仁药材指纹图谱分析,提供了一种苦杏仁药材水提液指纹图谱条件。苦杏仁苷在苦杏仁药材中通常以D-苦杏仁苷和L-苦杏仁苷两种形式存在,由于D-苦杏仁苷、L-苦杏仁苷化学性质接近,二者的色谱行为也较为一致,因此在HPLC中较难分离[10]。通过对比不同型号色谱柱的分离效果,发现Kinetex C18(2.6 μm,100 mm×4.6 mm)色谱柱对L-苦杏仁苷(图6b 5号峰)和D-苦杏仁苷(图6b 6号峰)有较好的分离效果。通过考察不同流速和柱温,发现在流速0.6 mL·min-1、柱温20 ℃条件下,图谱中1、2号峰能够达到基线分离。
15批不同产地的苦杏仁药材色谱峰中,共有7个共有峰。方法学考察结果显示其精密度、稳定性、重复性相对保留时间的相对标准偏差均小于3%,相对峰面积的相对标准偏差均小于5%,表明该方法准确、可靠、重复性良好。中药色谱指纹图谱相似度评价系统结果显示具有较好的相似度。通过对比生杏仁与燀杏仁的HPLC指纹图谱,发现燀杏仁中5、6号峰苦杏仁苷含量明显高于生杏仁,且缺少1、3、7号峰,推测是由于生杏仁中含有苦杏仁苷酶,导致苦杏仁苷在提取过程中遇水酶解未生成1、3、7号峰。本实验所建立的色谱条件能够为苦杏仁药材质量控制标准的建立及含苦杏仁的复方制剂质量控制提供参考。

