山桃幼苗响应镉胁迫的生理机制研究
罗彩云 王建武
(榆林学院/陕西省陕北矿区生态修复重点实验室,陕西 榆林 719000)
重金属是严重影响外界环境的主要污染因子之一,其中以镉(Cd)污染最为严重。据报道,我国农业土壤的Cd位点污染率已达到7%,Cd已成为我国土壤重金属污染的首要污染物[1]。前人尝试应用多种物理和化学方法修复Cd污染土壤,但这些方法普遍存在价格昂贵、对土壤损伤较大、抑制农作物生长等问题[2]。植物修复技术因具有花费少、效果好、对土壤无损害等特性[3-4],已成为当前研究热点之一。
研究表明,植物修复土壤Cd污染的主要途径是将一定量的Cd从地下部位吸收转移至地上部位,从而降低土壤中Cd含量。不同植物品种的吸收能力存在差异,且植物生长时期、Cd胁迫时间、土壤重金属含量、土壤pH值等对植物Cd的吸收和分布均有显著影响[5-6]。Cd对植物主要的毒害作用表现为叶片枯萎、生长抑制、呼吸作用和氮代谢紊乱、抑制光合作用、影响水分和矿质元素吸收等,同时导致活性氧(reactive oxygen species, ROS)含量上升而诱导氧化胁迫,继而造成膜脂质过氧化、蛋白氧化、酶活降低、核酸降解等[7-8]。为缓解ROS诱导的氧化胁迫,植物将会发挥多种抗氧化酶,如超氧化物歧化酶(superoxide dismutase,SOD)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)、过氧化氢酶(catalase,CAT)等,以及抗氧化剂[如抗坏血酸(ascorbic acid,AsA)、还原型谷胱甘肽(reduced glutathione,GSH)、类胡萝卜素(carotenoid)等]的作用,以清除过量ROS[9]。此外,非蛋白硫醇(non-protein thiol,NPT)和植物螯合素(phytochelatins,PCs)的螯合作用,以及细胞壁固定作用和液泡的区室化作用对降低Cd对植物的毒害效应亦具有重要意义[10-11]。
目前已报道的Cd超积累植物包括三叶鬼针草、龙葵、东南景天等草本植物,但其生物量较小,对生长环境要求较高,富集程度较低,对土壤重金属修复效果有限[12-14]。因此,筛选出生物量大,且对Cd具有一定积累、富集能力的木本植物已成为研究热点[15]。前期研究发现,榆林山桃树对陕北麻黄梁矿区土壤中的Cu、Zn、Pb、Cd、Cr、As等重金属污染物具有一定修复效应,尤其对Cd吸附能力较强,可使土壤中Cd含量降低62.61%。然而,其生理机制尚不清晰。因此,本研究以一年龄的山桃树为试验材料,探讨不同Cd胁迫时间对山桃幼苗光合作用、氧化还原水平、内源硫代谢物含量等的影响,以及Cd在山桃体内的分布情况,以期揭示山桃抗Cd胁迫的作用机理,为山桃在土壤重金属污染修复中的应用提供理论依据。
1 材料与方法
1.1 供试材料
供试苗木为一年生实生山桃苗(Amygdalusdavidiana),购自河北定州市诚信苗圃场。
供试土壤为沙壤土,基本理化性质为pH值6.12、有机质24.29 g·kg-1、全氮1.24 g·kg-1、碱解氮131.04 mg·kg-1、有效磷16.58 mg·kg-1、速效钾158.36 mg·kg-1,土壤Cd含量为0.018 mg·kg-1。
1.2 试验设计
采用盆栽试验,将山桃苗根系土壤冲洗干净(尽量避免根系损伤),移栽至装有5 kg园土的花盆(38 cm×31 cm×13 cm)中,每盆种植1株苗,浇施足量水以后,进行常规管理。为获得足够的测试样本,对照(CK)和Cd处理分别种植80株,种植培养条件一致。待苗木全部恢复生长后进行Cd胁迫处理。各处理均重复3次。
前期预试验筛选得到Cd2+处理最优浓度为10.0 mg·kg-1土壤。称取适量的CdCl2·2.5H2O(分析纯,上海迈瑞尔化学技术有限公司)配置成10.0 mg·L-1浓度的溶液,每盆植株浇施500 mL处理液,以未添加Cd处理的山桃幼苗为对照(CK)。于处理1、15、30、90 d后分别收集各时期的CK和处理组的山桃幼苗叶片,每株植物取叶片2~3片。轻轻刨开山桃幼苗,收集整个植株的根系,先用自来水冲洗干净,然后将根浸入10 mmol·L-1EDTA-Na2溶液中交换20 min,将根系表面吸附的Cd去除,再去离子水冲洗次3次,吸水纸吸干根部表面水分,用于组织及亚细胞Cd含量的测定。Cd处理后的培养过程,用等量去离子水进行养护,以维持山桃生长所需,同时注意防止雨水污染。
1.3 测定项目与方法
丙二醛(malondialdehyde, MDA)含量测定:参照张志良等[16]的方法。称取0.5 g山桃叶片组织,加入10 mL 0.5%(m/v)三氯乙酸进行充分研磨,将研磨液倒入10 mL离心管中,3 000×g离心10 min,取2 mL上清液与2 mL 0.67%(m/v)硫代巴比妥酸(thiobarbituric acid,TBA)充分混匀后,100℃水浴锅中反应30 min,于冰上迅速冷却,3 000×g离心10 min,取上清液,利用紫外分光光度计在450、532和600 nm波长处测定吸光度值。按照公式分别计算测定液中MDA浓度(CMDA,μmol·L-1)和提取液中MDA浓度(μmol·mL-1):
CMDA=6.45(A532-A600)-0.56A450
(1)
式中,A450:450nm波长下的吸光度值;A532:532 nm波长下的吸光度值;A600:600 nm波长下的吸光度值。
提取液中MDA浓度=CMDA×反应液体积/1 000×测定时提取液用量
(2)。
按照公式计算样品中MDA含量(μmol·g-1FW):
MDA含量=提取液中MDA浓度×提取液总量/植物组织鲜重
(3)。
1.3.2 叶片光合作用和叶绿素含量测定 选取充分伸展的山桃最上端叶片,利用LI-6400XT便携式光合测定仪(LI-COR 公司,美国)测定净光合速率(net photosynthetic rate, Pn, mmol CO2·m-2·s-1)、蒸腾速率(transpiration rate, Tr, mmol·m-2·s-1)、气孔导度(stomatal conductance, Gs, mol·m-2·s-1)、胞间CO2浓度(intercellular CO2concentration, Ci, mol·mol-1),选用红蓝光源,光强为1 000 μmol·m-2·s-1。叶室温度约25℃,每次测定时间为10:00-14:00。
参照文献[15]的方法进行山桃幼苗叶片叶绿素的提取和测定:称取0.2 g山桃叶片于研钵中,加入适量石英砂、碳酸钙粉和2~3 mL 95%乙醇,研磨成匀浆,然后加入9~10 mL 95%乙醇,继续研磨至组织变白,静置3~5 min,过滤至25 mL棕色容量瓶中,用乙醇润洗残渣 2~3次,并过滤。用95%乙醇冲洗漏斗中的残渣至无色,加乙醇于容量瓶中,定容至25 mL。摇匀后,以95%乙醇为空白对照,测定其在663和645 nm波长下的吸光度值。按照公式分别计算叶绿素a(Cchla,mg·g-1FW)、叶绿素b(Cchlb,mg·g-1FW)含量:
Cchla=A ×提取液体积(mL)/组织鲜重(g)
(4)
Cchlb=B×提取液体积(mL)/组织鲜重(g)
(5)
式中,A=12.72OD663-2.69OD645;B=22.88OD645-4.68OD663。
1.3.3 叶片矿质元素含量测定 取新鲜叶片用双蒸水冲洗干净,110℃杀青1 h,70℃烘干至恒重,用研钵将干叶研成粉末。准确称取0.5 g叶片粉末,加入5 mL HNO3-H2SO4-HClO4消解完全[17],定容至25 mL,利用 OPTIMA 2000A ICP-OES电感耦合等离子体发射光谱仪(美国 PerkinElmer公司)测定样品中Mg、Cu、Fe、Mn的含量。
1.3.4 抗氧化酶活性和抗氧化物质含量测定 参照赵秀峰等[18]的方法测定山桃幼苗叶片SOD、CAT、POD活性;参照徐莹[19]的方法测定谷光甘肽还原酶(glutathione reductase,GR)活性;参照Anderson[20]的方法测定GSH含量;参照张志良等[16]的方法测定AsA含量。
1.3.5 硫代谢相关酶活性和代谢物含量的测定 参照Khan等[21]的方法测定ATP硫酸化酶(ATP sulfurylase, ATP-S)活性;参照Giatonde[22]的方法测定半胱氨酸(cysteine,Cys)含量;参照Zhang等[23]的方法测定非蛋白硫醇(non-protein thiol,NPT)和植物螯合素含量(phytochelatins,PCs)。
1.3.6 Cd在植物组织的含量和亚细胞分布 分别收集胁迫处理后的山桃叶片、根,称量鲜重,测量长度,110℃杀青1 h,70℃烘干至恒重,称量干重。干样用HNO3-HClO4(4∶1,v/v)消煮(160℃)至澄清,定容后,利用iCETM3300 AAS原子吸收分光光度计(美国Thermo Scientific公司)测定各组织中Cd含量。
采用差速离心法分离不同的亚细胞组分:称取0.2 g山桃叶片或根于预冷的研钵中,加入10 mL预冷的提取缓冲液[250 mmol·L-1蔗糖、50 mmol·L-1Tris-HCl (pH值7.5)和10 mmol·L-1二硫苏糖醇],研磨至匀浆,300 r·min-1离心10 min,沉淀即为细胞壁组分(F1),取上清液于2 000 r·min-1离心15 min,沉淀为细胞核与叶绿体部分(F2),上清液于10 000×g离心20 min,沉淀为线粒体部分(F3),上清液即为含有液泡的可溶性组分(F4)。F2与F3合为细胞器组分。将提取出的各组分进行微波消解,利用原子吸收法测定Cd含量,消解液组成为5 mL HNO3和1 mL H2O2,消解后利用iCETM3300 AAS原子吸收分光光度计(美国Thermo Scientific公司)测定Cd含量,其中F4组分直接上机测定[24]。
1.4 数据统计
所得数据为相对每个时期的对照水平的相对值。采用SPSS 18.0对试验数据进行统计分析,各处理间数据采用方差分析,显著性差异水平为P<0.05。
2 结果与分析
2.1 Cd处理时间对山桃幼苗氧化胁迫和光合作用的影响
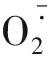
山桃幼苗叶片叶绿素a、叶绿素b含量随着Cd处理时间的延长整体均呈降低的趋势,但15和30 d间无显著差异。叶绿素a/b随着Cd处理时间的延长呈先升高后降低的趋势,表明在15 d前,Cd处理对叶绿素b的影响大于叶绿素a,15 d后,Cd处理对叶绿素a的影响较大。山桃幼苗叶片Pn随着处理时间的延长呈显著下降的趋势。结果表明,Cd处理可使山桃幼苗光合作用受到抑制。
2.2 Cd处理时间对山桃幼苗叶片中与光合作用密切相关的金属元素含量的影响
Mg、Fe、Cu、Mn在光合电子传递链中和叶绿素的形成起着重要的作用,缺乏任何一种元素都会对植物的光合作用造成较大影响。由表2可知,Mg和Mn在Cd处理后1 d较CK分别显著下降33.63%和43.94%,在处理后15、30 d的下降趋势均较为平缓,90 d后下降速度加快。Cu和Fe含量在Cd处理后均显著上升,其中Cd处理后1 d的含量均急剧增加,而在Cd处理后15、30和90 d上升幅度均趋于平缓。推测Cd处理诱导的山桃幼苗光合抑制和叶绿素含量降低与山桃对Mg、Mn的吸收受到抑制有关。
表1 Cd处理时间对山桃幼苗叶片氧化胁迫和光合作用的影响Table 1 Effects of Cd treatments time on oxidative stress and photosynthesis in Amygdalus davidiana seedlings
注:同行不同小写字母表示各处理时间间差异显著(P<0.05)。下同。
Note:Different lowercase letters in the same line indicate significant difference among treatment time at 0.05 level. The same as following.

表2 Cd处理时间对山桃幼苗叶片矿质元素含量的影响Table 2 Effect of Cd treatment time on mineral content in leaves of Amygdalus davidiana seedlings
2.3 Cd处理对山桃幼苗叶片抗氧化保护酶活性和抗氧化物质含量的影响
由表3可知,SOD和CAT活性在Cd处理后1 d急剧上升,在处理后15 d进一步得到提升,在处理后30 d,二者活性均明显下降,但仍高于CK。POD活性在Cd处理后15 d前虽有所上升,但与CK间无显著差异,在Cd处理15 d后,其活性显著提升,其中Cd处理90 d的POD活性较CK显著提升2.73倍。GR活性随着Cd处理时间的延长而显著增强。Cd胁迫下,山桃幼苗叶片中抗氧化物质AsA和GSH含量随着Cd处理时间的延长均显著增加,在Cd处理后15~30 d二者的增幅度变缓,在Cd处理后30~90 d时AsA与GSH含量的增幅均有所提升。结果表明,在山桃幼苗叶片中,不同抗氧化保护酶和抗氧化物质在各Cd处理时期所起的作用存在差异,处理前期(15 d前)以SOD、CAT和GR为主,而后期主要发挥POD和GR的功能,抗氧化物质AsA和GSH在整个Cd胁迫响应过程中均发挥了重要作用,以维持山桃幼苗叶片中ROS水平的稳定。
2.4 Cd处理时间对山桃幼苗叶片硫代谢的影响
ATP-S是植物体内硫同化过程中的关键酶,Cys是植物体内硫醇化合物合成的基础成分。由表4可知,山桃幼苗中ATP-S活性和Cys含量在Cd处理后1~90 d之间均显著上升,尤其是在处理后1 d内,ATP-S活性和Cys含量较CK分别增加1.12倍、1.04倍,Cd处理后30 d增幅有所减缓,但与CK间均存在显著差异。结果表明,Cd处理可以显著提升山桃幼苗叶片硫同化代谢。对山桃幼苗叶片中重金属螯合剂NPT和PCs而言, 二者含量在Cd处理15 d前,与CK间均无显著差异;在Cd处理30 d后,其含量均显著上升;在处理后90 d,NPT和PCs含量分别是CK的1.96倍和2.43倍。结果表明,在山桃幼苗叶片中,NPT和PCs在Cd处理后期才发挥其功能,以缓解Cd毒害。
2.5 山桃幼苗体内Cd含量的分布
由表5可知,山桃幼苗根和叶片的组织、亚细胞中的Cd含量随着Cd处理时间的延长均呈显著上升的趋势,且根中的Cd含量大于叶片,说明根系对Cd的吸收积累能力强于叶片。进一步分析Cd在山桃幼苗体内亚细胞分布情况发现,根细胞壁的Cd含量最多,其次是含有液泡的可溶性组分,细胞器组分中的Cd含量最低。叶片中Cd主要分布在含有液泡的可溶性组分中,细胞壁中Cd含量也较高。在叶片与根的3个亚细胞组分中,Cd含量均随着Cd处理时间的延长而增加。综上,细胞壁和液泡是山桃幼苗富集Cd的主要部位。

表3 Cd处理时间对山桃幼苗叶片抗氧化保护酶相对活性与抗氧化物质相对含量的影响Table 3 Effects of Cd treatment time course on relative activity of antioxidant enzymes and relative content of antioxidants in leaves of Amygdalus davidiana seedlings
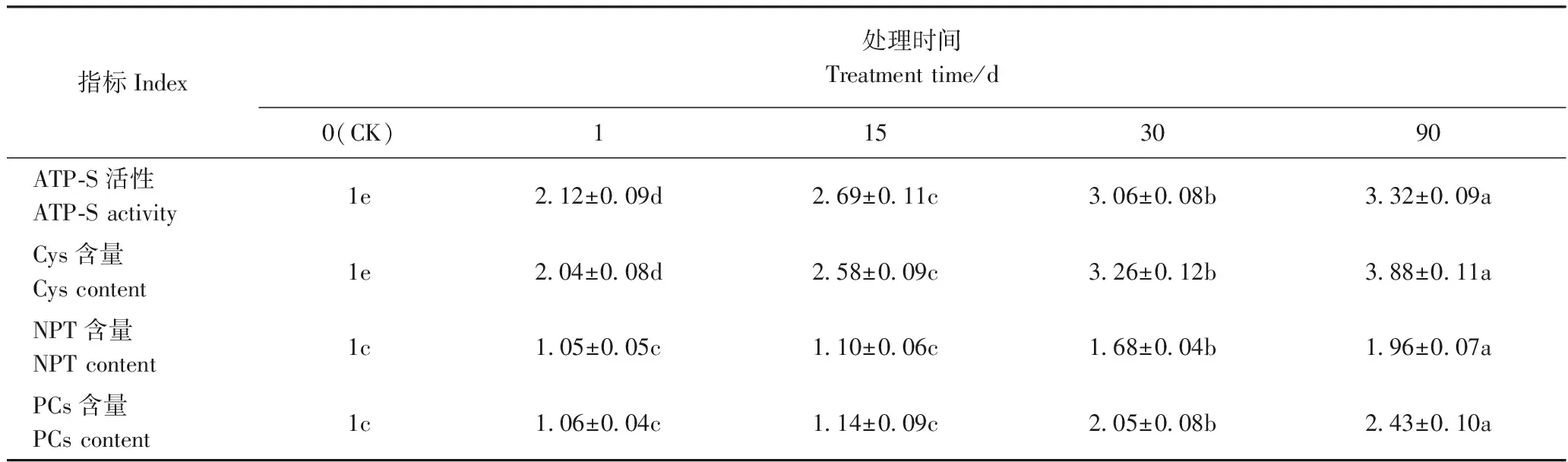
表4 Cd处理时间对山桃幼苗叶片硫代谢的影响Table 4 Effect of Cd treatment time course on S-metabolism in Amygdalus davidiana seedlings
3 讨论
根据逆境胁迫的强度和持续时间,可将植物响应逆境胁迫过程分为四个阶段[25]:1)起始预警阶段:该阶段会导致植物的快速应激反应,使植物的抗逆能力下降;2)适应阶段:该阶段会持续数天,植物会发生各种生理生化代谢反应,以建立一个新的内稳态系统;3)维持期:新建立的内稳态系统在该阶段会维持在一个较稳定的水平;4)植物由于长时间的逆境胁迫,将导致建立的新的内稳态系统紊乱,从而进入衰退期。每一个阶段对应植物不同的生理响应机制。
植物在逆境胁迫下维持叶片叶绿素含量的稳定,对维持植株正常的光合作用和提升植株抗逆能力至关重要,其中叶片中叶绿素a/b值的变化是关键。叶绿素a/b值越高,表明叶绿素a分子被光能激发的越多,由于叶绿素a对远红光的吸收可直接参与光化学反应,因此叶绿素a/b值越高,植株光合效率越高。叶绿素b主要吸收蓝紫光,作为天线色素之一对植物的光合作用亦起着至关重要的作用[28]。研究发现,Cd胁迫下的杨树、樟树叶片叶绿素a、叶绿素b和叶绿素a/b值显著降低[15, 29-31],这与本研究结果不同。这是因为上述报道均是研究不同Cd处理浓度对不同植物品种的生理影响,未研究不同Cd胁迫时期对植物光和色素的影响。本研究中,Cd胁迫可导致山桃幼苗叶片叶绿素a和叶绿素b含量显著降低,而叶绿素a/b值随着Cd处理时间的延长呈先升高后降低的趋势,表明Cd处理前期对山桃幼苗叶绿素b合成的抑制作用大于叶绿素a,抑制了山桃幼苗对蓝紫光的吸收;后期主要影响叶绿素a的合成,抑制山桃幼苗对远红光的吸收,最终导致光合作用受到抑制,光合速率降低。
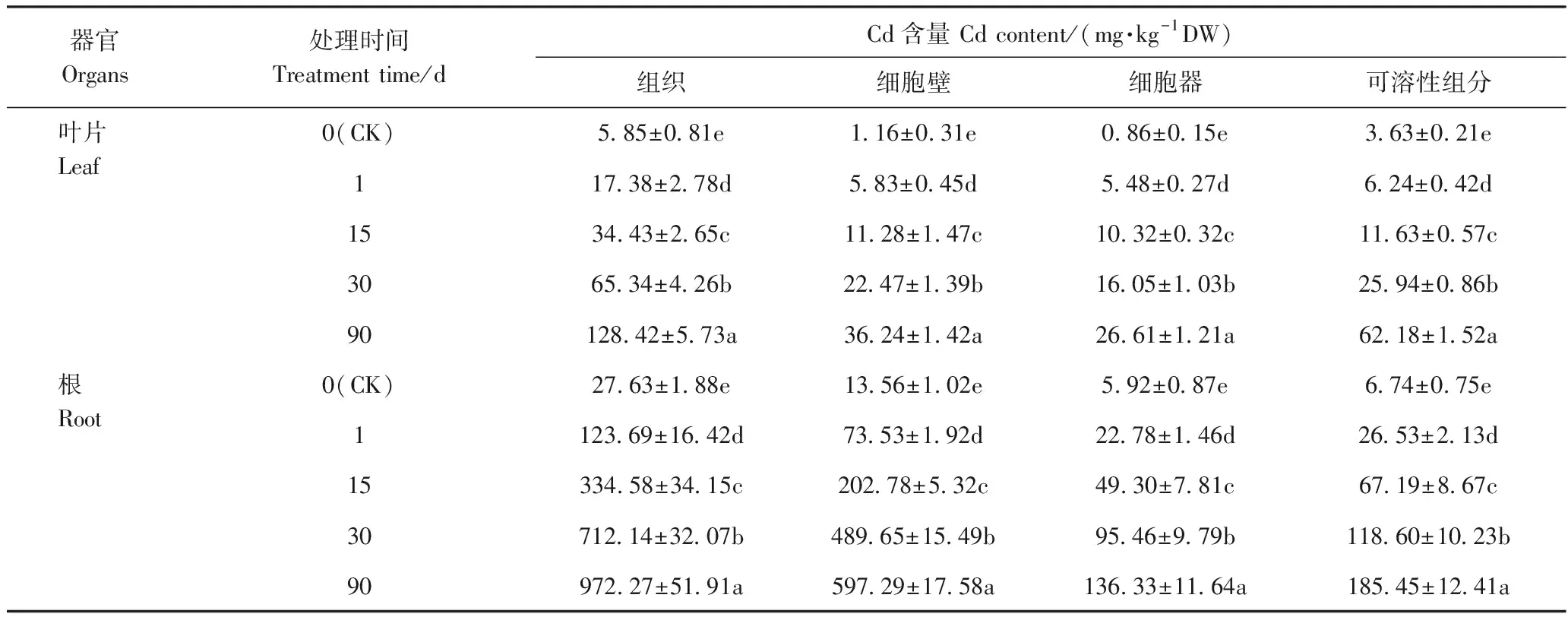
表5 Cd胁迫下山桃幼苗组织和亚细胞中Cd分布情况Table 1 The tissue and subcellular distribution of Cd in Amygdalus davidiana seedlings under Cd stress
注:同列不同小写字母表示同一器官不同处理时间间差异显著(P<0.05)。
Note: Different lowercase letters in the same column indicate significant difference among different treatment time with the same organ at 0.05 level.
目前,关于Cd诱导叶绿素含量降低的机理主要存在2种争议,一是认为Cd胁迫影响植物对Fe、Mg、Mn、Cu等矿质元素的吸收,间接抑制了叶绿素的生物合成而使叶片失绿;另一种则认为Cd胁迫诱导叶绿体合成抑制而间接导致失绿症[31]。本研究发现在Cd胁迫下的山桃幼苗叶片中Fe、Cu含量均显著上升,而Mg和Mn含量显著降低。Mg是叶绿素a和叶绿素b中卟啉环的重要组成部分,Mn是叶绿素合成的酶促反应辅助因子,说明Cd胁迫诱导的叶绿素含量降低不是由Fe、Cu引起的,而与Mn和Mg的吸收受抑制有关。Mn不仅参与叶绿素的合成,还是放氧复合体(oxygen-releasing complex,OEC)的重要组成部分,而OEC是光系统Ⅱ(PSⅡ)的最主要结构单元,Mn聚集体的破坏会抑制H2O的光解,导致电子传递受阻,PSII氧化端的电子供给不足,影响光能与电能之间的转换,最终导致光合作用受限[18, 31]。因此,本研究中山桃幼苗叶片中Mg和Mn含量的降低是光合速率降低的主要原因。这与Cd处理导致杨树对Mn2+吸收受到抑制,从而影响杨树叶片叶绿素合成,胁迫使PSⅡ反应中心氧化端出现电子传递障碍的研究结果一致[31]。
抗氧化酶促反应(SOD、CAT、POD等)和抗氧化物质非酶促反应(AsA、GSH等)是清除逆境胁迫诱导植物产生过量ROS的两种主要方式,但抗氧化酶活性和抗氧化物质含量随植物物种、逆境胁迫种类、胁迫浓度和时间的变化而不同[26]。研究发现,SOD、CAT、POD活性的提高是一种应急解Cd毒措施,以免植物遭受ROS诱导的氧化胁迫,但其调节Cd毒害的能力有限,高浓度Cd环境或者长时间Cd胁迫会使这些抗氧化酶活性和抗氧化物质含量显著降低[15]。本研究中,在Cd处理1和15 d后,山桃幼苗叶片SOD、CAT活性均显著上升,在Cd处理30和90 d则降低,POD活性在Cd处理15 d前呈上升趋势,但与CK间无差异显著,而在Cd处理15 d后显著上升,表明SOD、CAT在山桃幼苗响应前期Cd胁迫中起主要作用,而在Cd处理30 d后POD发挥重要作用。此外,GSH-AsA循环在小白菜抵抗Cd诱导产生的ROS而引发的氧化胁迫过程中具有重要作用,而GR是催化GSH-AsA循环的关键酶,其活性在Cd处理后的小白菜幼苗中显著上升,从而促进了基于GSH-AsA循环的ROS清除系统功能[32],这与本研究结果一致。
植物体内NPT、PCs等硫醇类化合物可与重金属Cd进行螯合,然后将其转运至液泡中,从而降低Cd对植物的伤害,因此NPT、PCs在解Cd毒过程中发挥着重要作用[33]。研究表明,NPT和PCs含量在Cd、Pb、Zn等胁迫后的植物体内显著上升[33],这与本研究结果不同。本研究中,ATP-S和Cys含量在Cd处理后显著上升,硫醇代谢物NPT和PCs含量在Cd处理前期变化不显著,在处理30 d后显著上升,但GSH在Cd处理后的山桃幼苗叶片中显著上升。推测在Cd处理早期(15 d前),山桃幼苗叶片中的硫同化过程主要以合成GSH为主,而在Cd处理30 d后,需要发挥NPT、PCs和GSH的功能,以缓解长期Cd处理对山桃幼苗造成的伤害。
细胞壁的草酸氧化酶、果胶、半纤维素可以与Cd2+结合,构成植物重金属防御的第一道屏障[24]。本研究发现山桃幼苗根中Cd含量显著大于叶片,表明根是山桃幼苗吸附Cd的主要部位。亚细胞分布情况表明,根中Cd主要富集在细胞壁中,液泡的区室化作用也发挥了重要功能,而在叶片中,Cd主要富集在液泡中,尤其是在Cd处理30 d后,液泡中的Cd含量极显著增加。这与Cd处理后期叶片中NPT、PCs含量的变化趋势,以及Cd在水稻幼苗体内分布的结果一致[24],表明细胞壁吸附和液泡的区室化作用在山桃幼苗的响应Cd胁迫过程中起着重要作用。
4 结论
本研究结果表明,Cd胁迫导致山桃幼苗叶片ROS水平上升,并影响植株对Mn、Mg离子的吸收,导致叶绿素合成受限,从而影响其光合作用。山桃幼苗Cd胁迫响应前期(15 d),主要以抗氧化酶(SOD、CAT)和抗氧化物质(GSH、AsA)的作用,清除Cd胁迫诱导产生的过量ROS。而在Cd处理后期,主要发挥抗氧化酶POD和抗氧化物质(GSH、AsA)的ROS清除功能,同时NPT、PCs与Cd的螯合作用,可促进Cd向液泡中转运,从而降低Cd对植株的毒害。本研究首次研究了不同Cd处理时期下的山桃幼苗响应Cd胁迫的生理特征,对山桃作为潜在的重金属植物修复材料具有重要的理论指导意义。但对其中的生理机制还需从分子水平作进一步的科学验证。

