番茄2个ERF-B1亚族转录因子基因的克隆及其对生物和非生物胁迫响应
王雅慧 李 彤 黄 莹 刘洁霞 王 枫 熊爱生
(南京农业大学园艺学院/作物遗传与种质创新国家重点实验室/农业农村部华东地区园艺作物生物学与种质创制重点实验室,江苏 南京 210095)
植物在生长发育过程中会受到各种生物和非生物因素的影响。在适应外界环境的过程中,转录因子发挥着关键性作用。转录因子是一类能与基因上游特定序列专一性结合并调控基因表达的蛋白质分子[1]。转录因子通过直接或间接作用调控靶基因的转录和表达,从而调控植物的生长发育、逆境响应以及信号转导[2-3]。大量研究表明,转录因子在植物响应胁迫过程中起重要作用[4]。其中AP2/ERF转录因子家族是植物所特有的一类转录因子,可以调控植物的生长发育和逆境响应[5]。因此分离植物AP2/ERF家族基因并探索其在不同生物及非生物胁迫下的响应,对于进一步阐明植物抗逆分子机理具有重要意义。根据所含AP2/ERF结构域数目不同,Sakuma等[6]将AP2/ERF转录因子家族分为AP2、RAV、DREB、ERF 4个亚族和单独亚族成员(soloist)。乙烯响应因子(ethylene-responsive factor,ERF)是AP2/ERF家族中一个重要亚家族,其蛋白质序列中含有一个由60~70个氨基酸组成的高度保守的AP2结构域[7]。ERF转录因子可以通过结合顺式作用元件GCC-box(保守序列为GCCGCC)来调控基因的表达水平,进而参与植物体内多种生理反应和逆境胁迫响应[8]。近年来,在拟南芥(Arabidopsisthaliana)[9]、水稻(Oryzasativa)[10]、油菜(Brassicanapus)[11]、大豆(Glycinemax)[12]等植物中均有关于ERF家族转录因子的研究报道。
ERF转录因子在响应非生物胁迫过程中发挥着重要作用。研究发现ERF转录因子可以参与激素、蜡质、代谢物合成、活性氧清除等多种生物过程[13]。如Zhang等[14]发现在番茄和烟草中超表达ERF2基因可以通过调控乙烯信号转导途径增强植株对低温胁迫的耐受力;Gao等[15]发现在水稻中过量表达TERF1后增强了转基因水稻对干旱和高盐胁迫的耐受力;Wu等[16]研究表明,JERF3通过结合GCC-box,激活NtSOD表达,提高了超氧化物歧化酶(superoxide dismutase,SOD)活性,从而提高烟草的耐盐性;SlERF3能通过降低膜脂过氧化进而增强植株对盐胁迫的耐受性[17]。ERF亚家族是逆境信号交叉途径中的连接因子。研究表明,脱落酸(abscisic acid,ABA)、水杨酸(salicylic acid,SA)、乙烯(ethylene,ET)等植物激素可以诱导大豆中9个不同ERF亚家族基因的表达,在干旱、低温和高盐胁迫下,分别有9、5和9个ERF亚家族成员基因被诱导表达,表明ERF家族成员在参与激素信号转导及非生物胁迫响应中存在交叉互作[12]。
大量研究表明,ERF家族大部分转录因子在植物响应生物胁迫过程中发挥重要作用[18-19]。Ken等[20]采用过量表达和插入突变体的方法研究了AtERF4对枯萎病抗性的反应,结果发现过表达AtERF4的植株枯萎病抗性降低,而erf4突变体的抗性增强;Fischer等[21]也发现,过表达NtERF5的转基因烟草可以通过限制烟草花叶病毒(tobacco mosaic virus,TMV)的复制来增强其抗性。Huang等[18]研究发现,番茄ERF转录因子可以通过与下游基因互作并调控多种激素信号转导途径来抵御番茄黄化曲叶病毒(tomato yellow leaf curl virus, TYLCV)的侵染,但不同番茄材料ERF转录因子的表达模式不同。因此,不同番茄ERF转录因子家族成员参与胁迫应答的分子机理有待进一步明确。
本研究以番茄(Solanumlycopersicum)浙杂-301为试验材料,克隆得到AP2/ERF家族ERF亚族的SlERF83和SlERF109基因,并对其进行同源序列比对、进化树、理化性质和三级结构、启动子顺式作用元件等方面的分析;通过酵母单杂交和β-半乳糖苷酶活性测定验证番茄SlERF83蛋白体外结合活性;利用实时荧光定量PCR分析SlERF83和SlERF109基因在非生物胁迫、不同激素处理以及番茄黄化曲叶病毒侵染下的表达,以期为研究番茄ERF转录因子响应生物和非生物胁迫的分子机制提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 植物材料及处理 试验材料番茄浙杂-301于2017年11月种植于南京农业大学作物遗传与种质创新国家重点实验室植物生长室。将四叶期生长状态良好的番茄植株分别进行高盐(NaCl,200 mmol·L-1)、干旱(PEG,200 g·L-1)、水杨酸(SA,2 mmol·L-1)和茉莉酸甲酯(methyl jasmonate,MeJA,100 μmol·L-1)处理,每处理设3次生物学重复,分别于处理后1、3、6、12、24 h取样。SA和MeJA溶解于含2%无水乙醇的蒸馏水中,喷洒植株叶片,以用蒸馏水喷洒的叶子为对照。200 g·L-1PEG和200 mmol·L-1NaCl以灌根方式施入,以灌入等量蒸馏水为对照。选取生长至两叶期的番茄幼苗移至大棚中借助烟粉虱进行番茄黄化曲叶病毒的侵染,分别于侵染后2、4、6、7、14、21 d取样,并迅速浸入液氮中,-80℃条件保存备用。
1.1.2 主要试剂和试剂盒 植物总RNA提取试剂盒(RNA simple Total RNA Kit)购自北京天根生化科技有限公司;DNA凝胶回收试剂盒(AxyPrep DNA Gel Extraction Kit)购自江苏康宁生命科学有限公司;质粒pPC86、大肠杆菌菌株DH5α及酵母菌株EGY48由南京农业大学作物遗传与种质创新国家重点实验室保存;pMD19-T载体、ExTaq聚合酶、反转录试剂盒(Prime Script RT with gDNA Eraser)以及实时定量SYBR PremixExTaq试剂盒均购自大连TaKaRa生物科技有限公司。
1.2 试验方法
1.2.1 总RNA提取及cDNA的合成 按照植物总RNA提取试剂盒(RNA simple Total RNA Kit)说明书提取番茄浙杂-301叶片材料总RNA,采用One-Drop OD-1000+超微量核酸分析仪(南京五义科技有限公司)测定样品RNA浓度并按照反转录试剂盒(Prime Script RT with gDNA Eraser)说明书将RNA样品反转录为cDNA。
1.2.2 番茄SlERF83和SlERF109基因的克隆 根据番茄转录组数据库[22]检索获得番茄中SlERF83、SlERF109基因序列,设计两对克隆引物,引物序列详见表1,以浙杂-301叶片cDNA为模板,采用20 μL体系进行PCR扩增。扩增程序:94℃预变性5 min;94℃变性30 s,54℃退火30 s,72℃延伸1 min,共35个循环;72℃延伸10 min。用1.2%琼脂糖凝胶电泳对PCR扩增产物进行分离,采用DNA凝胶回收试剂盒进行回收,连接到pMD19-T载体并转化到大肠杆菌DH5α中,进行菌液检测后送至南京金斯瑞公司测序。
1.2.3 序列分析 在NCBI相关网站(http://blast.ncbi.nlm.nih.gov/Blast.cgi)中完成核苷酸和氨基酸序列的BLAST比较搜索和保守域预测。将获得的启动子序列在PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)中进行顺式作用元件预测分析[23]。不同物种间ERF蛋白多重序列比对及氨基酸疏水性/亲水性分析在软件DNAMAN 6.0中完成。通过SMS序列处理在线工具包(http://www.biosoft.net/sms)及BioXM 2.6软件进行氨基酸理化性质和组成成分分析[24]。利用MEGA 5软件构建系统发育树[25]。利用Swiss-Model程序(https://www.swissmodel.expasy.org/)预测蛋白质三级结构[26],并通过DS ViewerPro软件编辑分析模型。在Excel 2013及SPSS20.0软件中完成荧光定量PCR数据分析。
1.2.4 酵母单杂交和β-半乳糖苷酶活性的测定 设计重组引物(详见表1),选择含有色氨酸(Trp)合成基因和半乳糖诱导蛋白(GAL4)激活域的pPC86质粒为载体,将其与SlERF83基因连接,转化至能够合成尿嘧啶(Ura)并含有GCC元件控制的LacZ报告基因的酵母EGY48中。将转化的酵母细胞在SD/-Ura/-Trp固体培养基上28℃倒置培养3 d,利用20 μg·mL-1的X-gal鉴定阳性克隆。挑取X-gal筛选呈蓝色反应的菌落于SD/-Ura/-Trp液体培养基中与底物o-硝基-β-D-半乳糖苷共培养进行β-半乳糖苷酶活性的测定。
1.2.5 番茄SlERF83和SlERF109基因的表达分析 按照SYBR PremixExTaq试剂盒的操作说明,根据克隆所得的SlERF83和SlERF109基因序列分别设计表达检测引物(详见表1)。选用番茄SlTUB基因为内参基因[27],利用CFX96荧光定量PCR仪(美国Bio-Rad公司)及配套软件进行荧光定量PCR操作。扩增程序:95℃预变性30 s;95℃变性5 s,60℃退火20 s,40个循环。通过从65℃到95℃逐步扩增来获得熔解曲线。每个处理样本设3次生物学重复,采用2-ΔΔCt法[28]计算相对表达量。
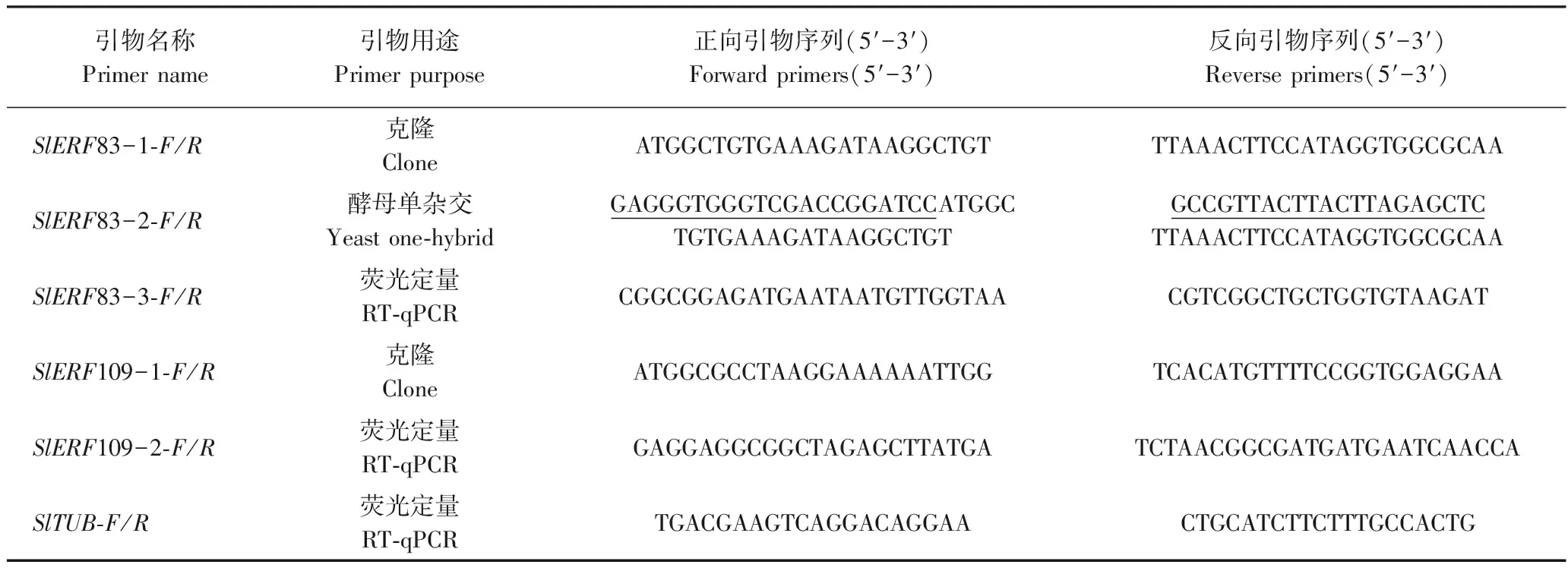
表1 SlERF83和SlERF109引物序列Table 1 Sequences of SlERF83 and SlERF109 gene primers
注:下划线表示引物设计中的重组序列。
Note:Underline represents the recombinant sequences in primers.
2 结果与分析
2.1 番茄SlERF83和SlERF109基因的克隆
利用RT-PCR方法,以浙杂-301叶片cDNA为模板,扩增得到了2个约700 bp的片段。序列测定结果分析表明,SlERF83基因含有1个678 bp的开放阅读框,编码225个氨基酸;SlERF109基因含有一个669 bp的开放阅读框,编码222个氨基酸(图1)。
2.2 番茄SlERF83和SlERF109基因的启动子作用元件分析
从NCBI数据库中分别获得2个ERF转录因子基因起始密码子ATG上游1 500 bp的启动子区域序列。在PlantCARE中对其进行顺式作用元件分析发现,2个启动子含有数量相近的核心启动子元件TATA-box和增强子区域调控元件CAAT-box。此外,2个ERF转录因子启动子均存在植物激素响应相关元件(ABRE、CGTCA-motif、ERE)、光调控元件(Box Ⅰ、Box 4)、抗病相关元件(TC-rich repeats)和热胁迫相关元件(HSE)(表2)。
2.3 SlERF83和SlERF109转录因子氨基酸序列比对和进化树分析
利用NCBI数据库对番茄SlERF83和SlERF109转录因子进行保守结构域预测,由图2-A可知,2个转录因子均具有AP2保守结合域,分别位于23~84和26~86氨基酸位点之间,符合AP2/ERF家族中ERF亚族的典型结构特征。
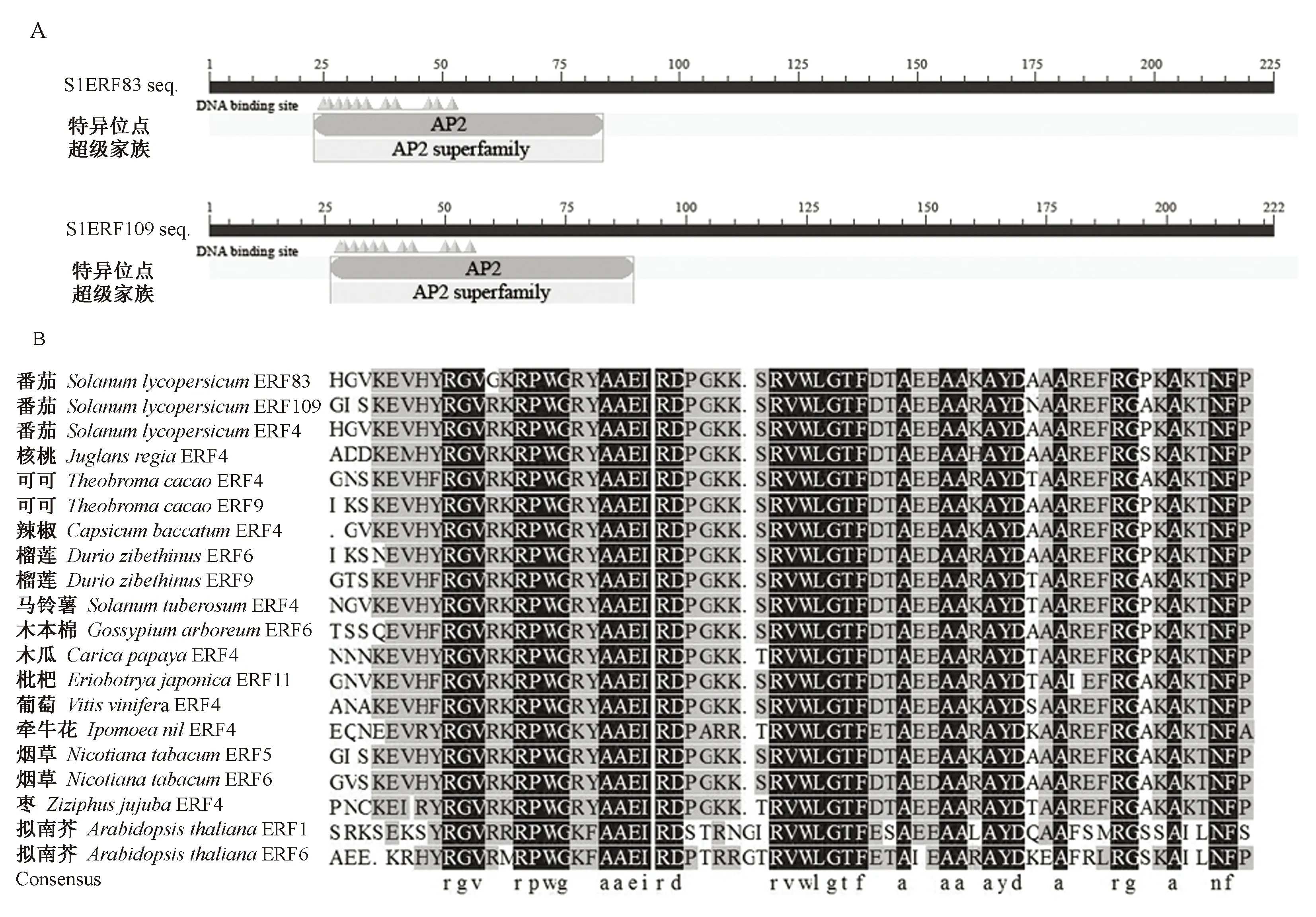
图2 番茄SlERF83和SlERF109转录因子保守域(A)及与其他物种氨基酸序列的多重比对(B)Fig.2 Conserver domain of SlERF83 and SlERF109 transcription factors (A) and multiple alignment of amino acid sequences in tomato and other different plants (B)
利用DNAMAN 6.0软件对番茄中2个转录因子SlERF83和SlERF109与拟南芥(Arabidopsisthaliana)、马铃薯(Solanumtuberosum)、辣椒(Capsicumbaccatum)、烟草(Nicotianatabacum)、葡萄(Vitisvinifera)等13种植物ERF转录因子氨基酸序列进行多重比对。由图2-B可知,SlERF83和SlERF109的氨基酸序列一致性为43.59%。SlERF83氨基酸序列与马铃薯ERF4(XP_006367798.1)一致性高达91.11%;SlERF109氨基酸序列与烟草ERF5(AAV54033.1)和烟草ERF6(BAJ72665.1)的一致性分别为60.62%和59.27%。不同物种AP2结构域相似度均较高,均具有典型的WLG元件。
选取拟南芥AP2/ERF家族成员与番茄中2个ERF转录因子构建进化树,进一步分析番茄SlERF83和SlERF109与AP2/ERF家族成员的进化关系。由图3可知,番茄SlERF83与SlERF109转录因子均属于AP2/ERF家族中ERF亚族的B1组。它们与拟南芥AtERF4(AT3G15210.1)、AtERF8(AT1G53170.1)、AtERF11(AT1G28370.1)关系最近,共处于同一分支。
2.4 番茄及其他物种ERF转录因子的氨基酸组成与理化性质分析
由表3可知,各物种ERF蛋白残基数介于211~252之间,相对分子质量介于22.75~27.06 kDa之间,理论等电点介于8.82~10.25之间;酸性氨基酸所占比例基本高于碱性氨基酸,芳香族氨基酸比例介于6.5%~8.8%之间,而脂肪族氨基酸比例介于11.6%~19.1%之间,约为芳香族氨基酸比例的2倍。
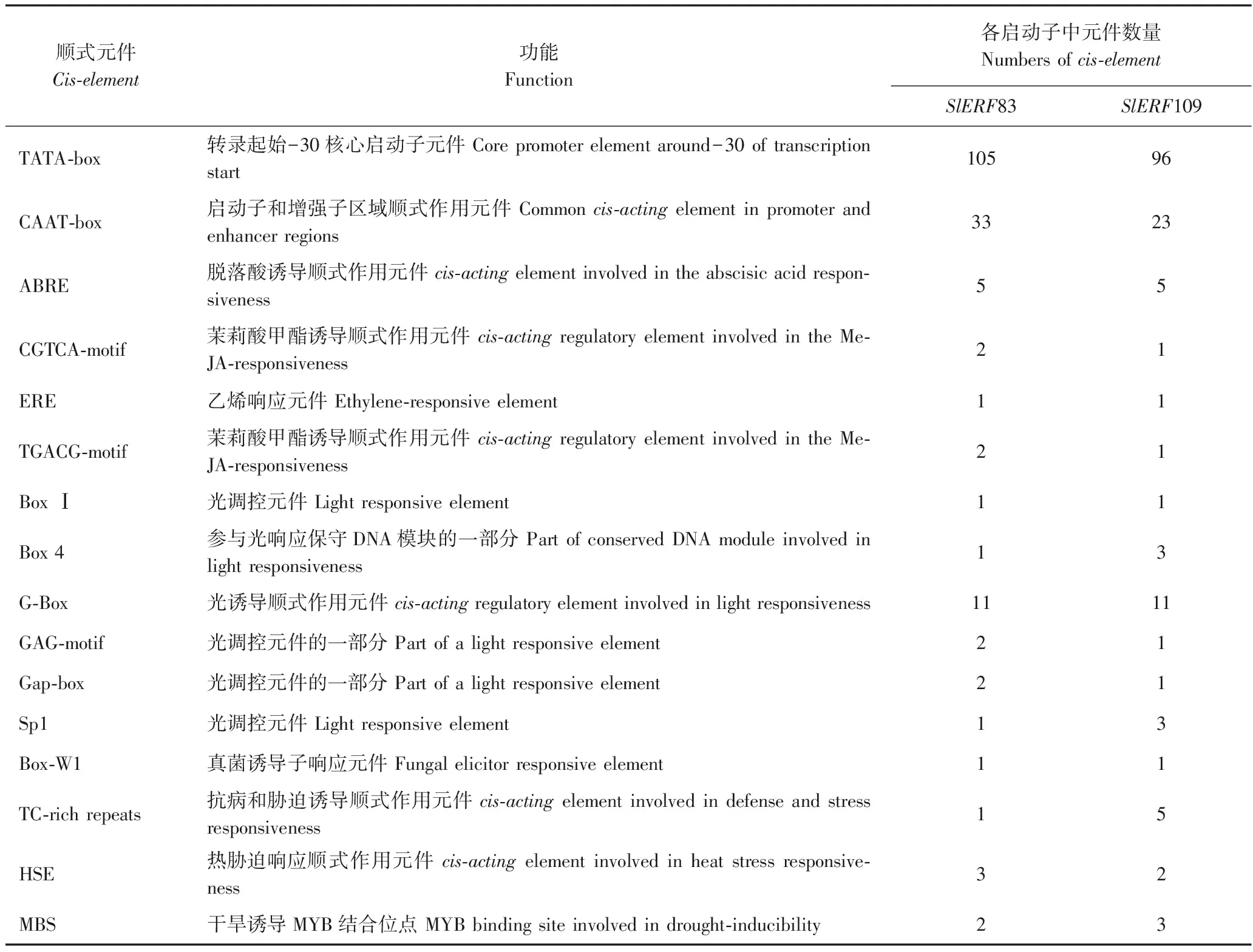
表2 番茄SlERF83和SlERF109基因启动子区域中的部分顺式作用元件Table 2 Cis-elements of SlERF83 and SlERF109 promoter regions in tomato
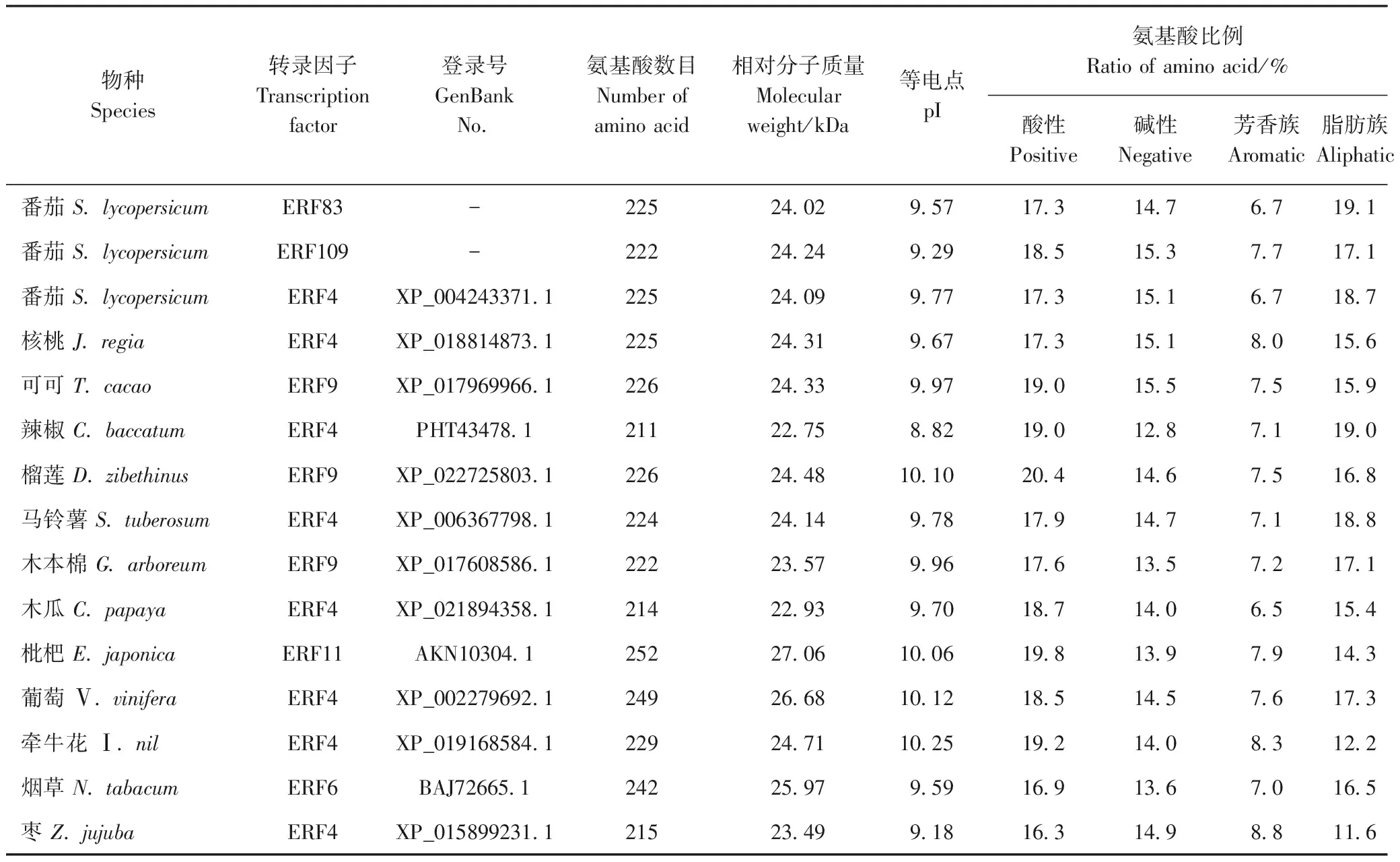
表3 不同植物中ERF家族转录因子氨基酸理化性质分析Table 3 Analysis of physical and chemical characterization of amino acid sequences of ERF transcription factors among different plants
注:“-”表示无基因登录号。
Note:‘-’ indicates no GenBank number.
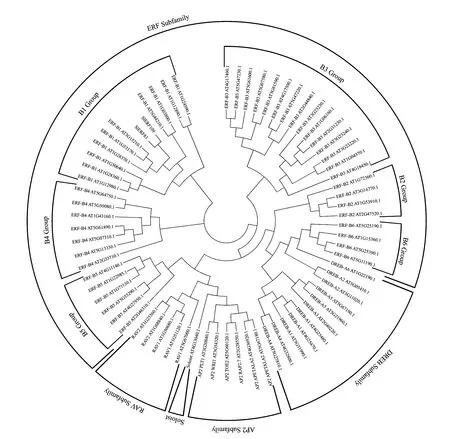
图3 番茄SlERF83和SlERF109转录因子与拟南芥AP2/ERF家族转录因子进化分析Fig.3 Phylogenetic analysis on transcription factors of SlERF83 and SlERF109 from Solanum lycopersicum and AP2/ERF family from Arabidopsis thaliana
2.5 番茄SlERF83与SlERF109转录因子疏水性/亲水性分析
对番茄的2个ERF转录因子进行疏水/亲水性分析,结果表明,番茄ERF83疏水性最强的位点为第190位的丙氨酸(Ala),其次是位于第187位的甘氨酸(Gly)以及位于第151、第152位的缬氨酸(Val)和丙氨酸(Ala);位于第42位的脯氨酸(Pro)亲水性最强,其次是第6位的赖氨酸(Lys)。而ERF109疏水性最强的位点为第9位的苏氨酸(Thr),其次是第12、第13位的甘氨酸(Gly);第88、第91位的谷氨酸(Glu)和第89位的赖氨酸(Lys)亲水性最强。综上,2个ERF转录因子均属于亲水性蛋白。
2.6 番茄SlERF83与SlERF109转录因子三维结构预测与分析
番茄SlERF83与SlERF109转录因子的保守域与拟南芥AtERF1具有较高的相似性,以AtERF1(PDB ID:3gcc)为模型,对SlERF83和SlERF109转录因子进行蛋白质三级结构预测。由图4可知,SlERF83和SlERF109转录因子蛋白质结构具有较高的相似性,均有1个α-螺旋和3个β-折叠。在结合域内,2个转录因子的差异位点有4个,主要集中在α-螺旋上,但差异位点对其蛋白质空间结构影响不大。
2.7 番茄SlERF83转录因子在酵母中的转录激活活性鉴定
ERF转录因子可以与GCC-box顺式作用元件结合来调控基因的表达。为验证番茄SlERF83转录因子在酵母中的转录激活活性,对其进行酵母单杂交实验,获得了能在SD/-Ura/-Trp培养基上正常生长并在显色培养基上显蓝色的酵母菌落(图5),表明SlERF83转录因子可以与GCC-box结合。进一步测定其β-半乳糖苷酶活性,发现SlERF83的β-半乳糖苷酶活性是对照的2.06倍(图6)。
2.8 番茄SlERF83与SlERF109基因的表达分析
2.8.1 非生物胁迫 由图7可知,NaCl处理1 h后,SlERF83和SlER109基因的表达水平均显著低于CK,分别为CK的0.28倍和0.46倍,处理3 h和6 h后,表达水平持续下降,处理12 h后,表达量略有升高,但仍低于CK,表达量分别为CK的0.14倍和0.19倍。PEG胁迫下,处理1和12 h后,SlERF83和SlER109基因的表达量均显著低于CK,6 h时表达量较CK略微上调,分别为CK的1.38倍和2.13倍。
2.8.2 激素处理 由图8可知,SA和MeJA 2种激素处理下SlERF83和SlERF109基因均被诱导表达。在SA处理下,SlERF83的表达量持续上调,至处理12 h后表达量开始下降;SlERF109基因的表达水平除6 h略低于CK外,其他处理时间均显著高于CK。MeJA处理下,SlERF83的表达水平呈先升高后降低的趋势,6 h时达到最高;而SlERF109在12 h时表达水平达到峰值,其他处理时间下表达量均较低。
2.8.3 番茄黄化曲叶病毒侵染 由图9可知,SlERF83和SlERF109基因对番茄黄化曲叶病毒的响应趋势基本一致。侵染前期2个基因的表达水平均较低,侵染4 d和6 d后表达水平均显著低于CK,侵染7 d后表达量逐渐上升且均高于CK。其中SlERF83基因的响应较为明显,侵染7、14、21 d后的表达量分别为CK的4.83倍、1.30倍和1.65倍。
3 讨论
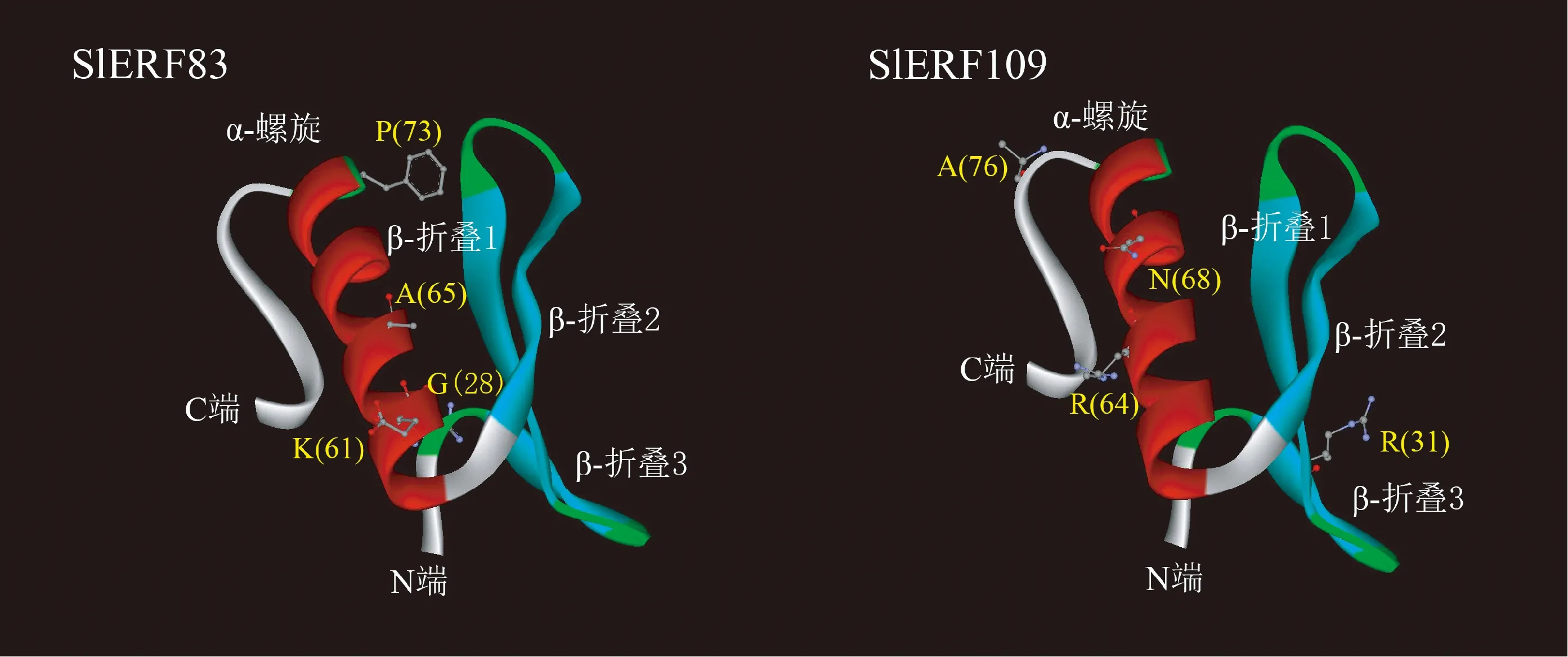
图4 番茄SlERF83和SlERF109转录因子蛋白的三维结构预测Fig.4 The three-dimension structures of SlERF83 and SlERF109 transcription factor in tomato
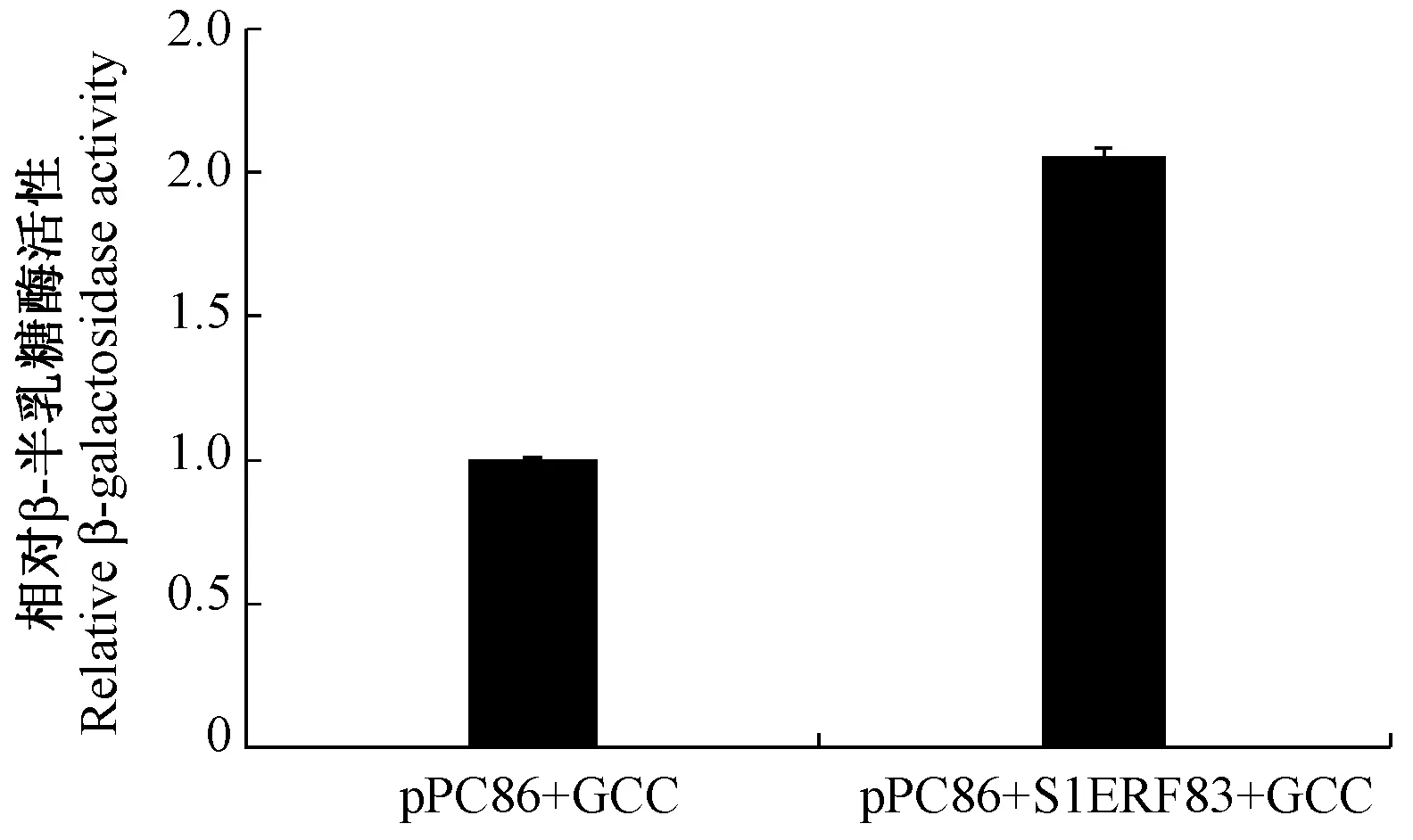
图6 番茄SlERF83转录因子与GCC-box结合的相对β-半乳糖苷酶活性Fig.6 Relative β-galactosidase activity of SlERF83 transcription factor with GCC-box
AP2/ERF家族是植物中重要的转录因子家族之一,广泛地参与着植物生长发育及各种逆境胁迫反应的调控[13]。ERF家族是AP2/ERF转录因子家族中一个主要的亚族,含有一个保守的AP2结构域[6]。本研究克隆得到2个番茄ERF转录因子基因SlERF83和SlERF109,它们均含有一个由约60个氨基酸组成的AP2结构域,属于AP2/ERF家族的ERF亚族。进化分析表明,这2个转录因子属于ERF亚族的B1组。氨基酸理化性质分析发现,2个转录因子的氨基酸数目、相对分子质量以及理论等电点较相似,且均属于亲水性蛋白。三级结构分析表明,SlERF83与SlERF109蛋白AP2结构域相似度较高,仅有4个差异位点,主要集中在α-螺旋区域。N-端具有3个反向平行的β-折叠结构,此结构可能参与蛋白质-蛋白质的相互作用[29]。
研究表明,拟南芥AtERF9基因通过结合下游PDF基因的GCC-box,调控PDF基因的表达,从而控制植物对灰霉病的抗性[30]。此外,ERF转录因子还可以与VWRE(wound-responsivecis-element)[31]、CE1(coupling element 1)等顺式元件结合[32],对不同功能基因进行调控,从而在不同生物学过程中发挥作用[33]。本研究中,酵母单杂交结果表明,番茄ERF转录因子可以识别下游基因启动子区域GCC-box顺式作用元件,进而激活或抑制下游非生物胁迫应答基因的表达。
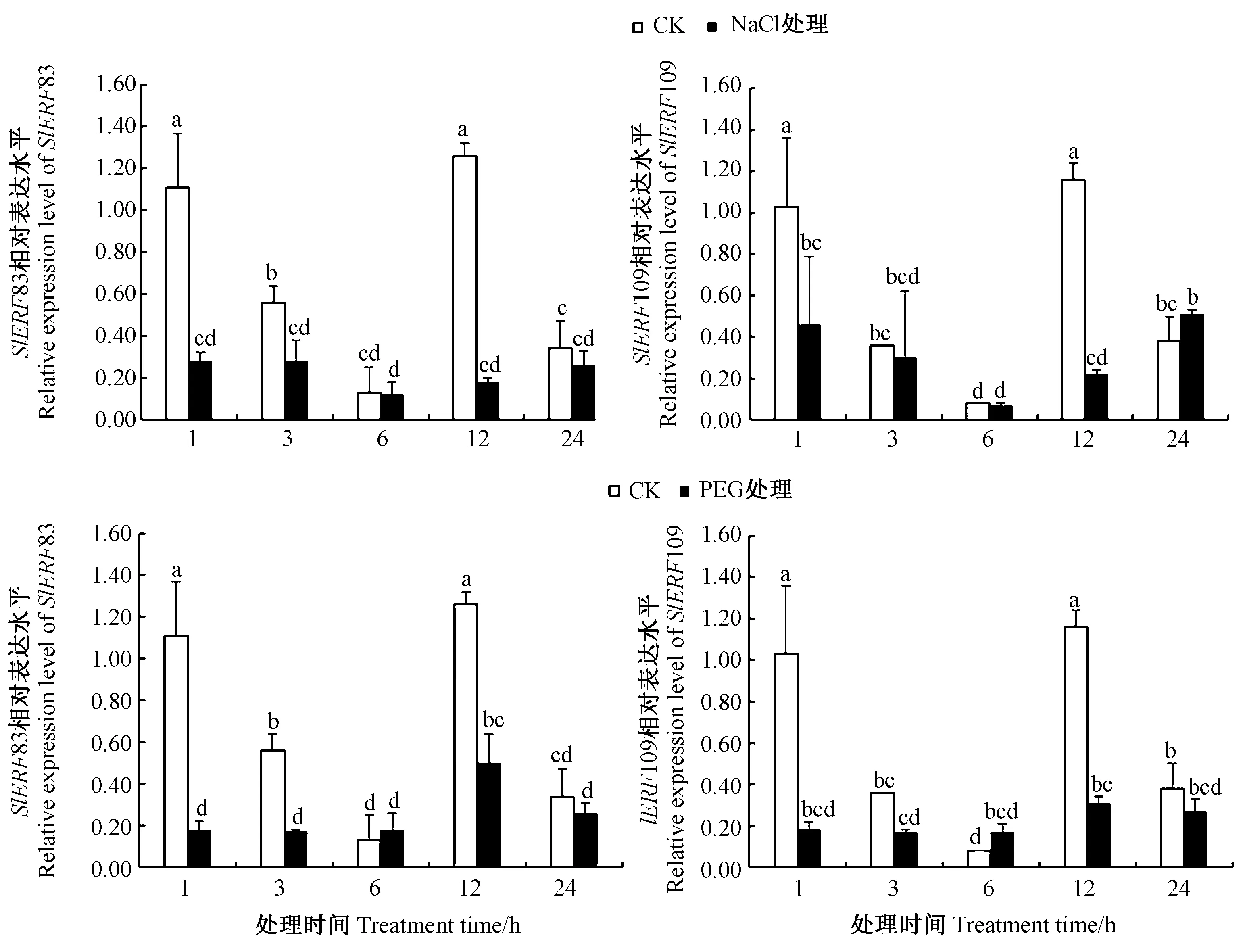
注:不同小写字母表示在0.05水平上差异显著。下同。Note: Different small letters indicate significant difference at 0.05 level. The same as following.图7 番茄SlERF83和SlERF109基因在不同非生物胁迫下的表达水平Fig.7 Expression analysis of SlERF83 and SlERF109 gene in tomato under different abiotic stress treatments
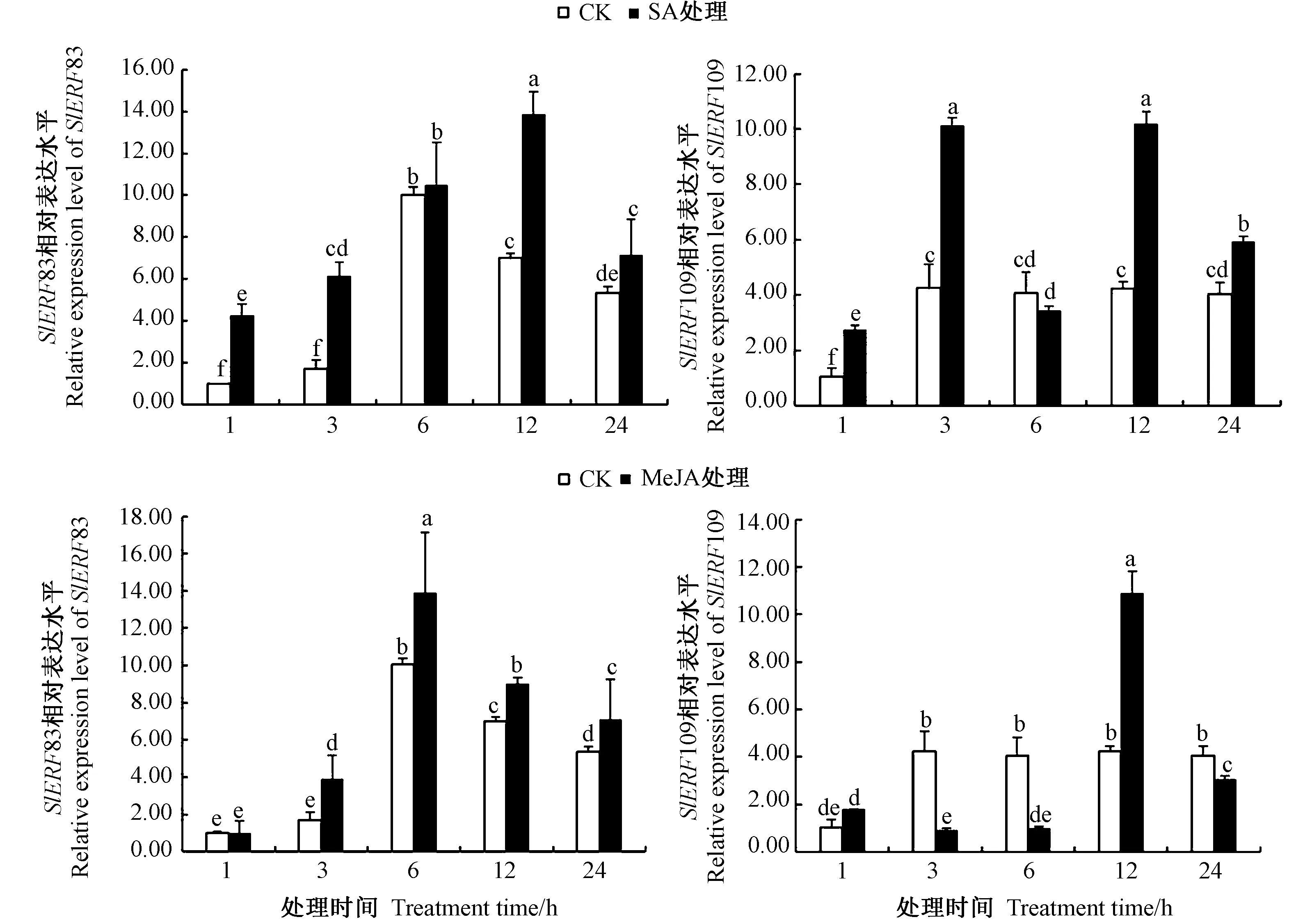
图8 番茄SlERF83和SlERF109基因在不同激素处理下的表达水平Fig.8 Expression analysis of SlERF109 gene in tomato under different hormonal treatments
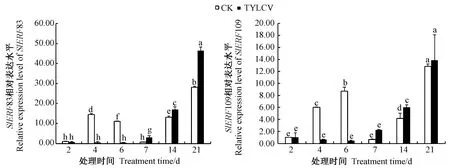
图9 番茄SlERF83和SlERF109基因在番茄黄化曲叶病毒侵染下的表达水平Fig.9 Expression analysis of SlERF83 and SlERF109 gene in tomato under TYLCV infection
通过分析SlERF83与SlERF109的启动子序列发现,番茄SlERF83与SlERF109基因启动子区域均具有多种响应干旱、高温等非生物胁迫以及ABA、MeJA等激素的顺式作用元件,SlERF83与SlERF109基因在干旱、高盐胁迫下与对照相比表达水平均有所下调,表明番茄SlERF83与SlERF109基因可能受到多种逆境胁迫诱导,与Zhu等[34]的研究结果一致。大量研究表明过量表达干旱或高盐胁迫相关ERF基因可以提高烟草、水稻、番茄植株的抗盐或抗旱能力[15,35-36]。此外,2个番茄ERF基因在SA处理下均被诱导表达,而MeJA处理下SlERF83的表达水平升高、SlERF109的表达量有所下降,表明ERF转录因子可以影响不同信号途径之间的协同或拮抗作用[37]。同时,植物激素在植物抗病防卫系统中具有重要作用,ERF转录因子可通过植物激素相互作用共同调控非生物胁迫反应。番茄黄化曲叶病毒侵染前期,SlERF83与SlERF109基因的表达水平均较低,这可能与侵染处理中烟粉虱噬咬引起植株创伤诱导相关。有研究表明,烟粉虱侵染导致番茄黄化曲叶病毒具有一定的时间滞后性,侵染7 d后,番茄黄化曲叶病毒经过多轮复制,番茄SlERF83与SlERF109基因均被诱导表达,说明番茄中的ERF转录因子也参与了对番茄黄化曲叶病毒的响应[38]。ERF基因过量表达可以提高植物对某一种病害的抗性[39],且某些ERF基因过表达可以使植物对多种病害表现出抗性,并具有一定的广谱抗病性[39-40]。本研究结果对进一步阐明番茄ERF转录因子调控植物抗逆分子机理具有重要意义。
4 结论
本研究结果表明,番茄SlERF83和SlERF109均为亲水性蛋白,含有一个保守的AP2结构域,属于AP2/ERF家族中ERF亚族的B1组;SlERF83与SlERF109启动子区域含有多种逆境响应元件;三维结构预测显示SlERF83和SlERF109都含有1个α-螺旋和3个β-折叠;酵母单杂交试验表明SlERF83蛋白可以与GCC-box结合。在不同生物和非生物胁迫下,SlERF83与SlERF109基因的表达水平与对照相比差异明显,表明番茄ERF转录因子可能参与植物对逆境胁迫的响应。本研究为深入开展番茄ERF转录因子响应生物和非生物胁迫分子机理研究提供了理论依据。

