中国荷斯坦牛TLR1基因SNPs快速筛查及蛋白功能预测
吴恩芸 任稳稳 李耀东 刘丽霞 曹 忻 张 丽
(西北民族大学生命科学与工程学院,甘肃 兰州 730124)
Toll样受体(Toll like recepter,TLRs)是一类在生物进化中比较保守的模式识别受体,能在微生物病原体感染机体早期做出免疫应答,是机体天然免疫防御中的重要因子[1],可直接识别病原体的病原相关分子模式(pathogen-associated molecular patterns,PAMPs)进而启动免疫应答并建立获得性免疫[2]。研究表明,不同组织中,TLRs的表达水平直接影响其对入侵该组织的病原体的识别作用[1]。近年来,关于Toll样受体的研究主要集中在TLR2基因和TLR4基因上,而对TLR1基因的研究相对较少。TLR1基因为TLRs基因家族中的一员,是中国荷斯坦牛的重要免疫基因之一,同时还被认为与中国荷斯坦牛乳房炎的易感性有密切的联系[3]。陈亚冰等[1]研究发现TLR1基因能与TLR2基因形成异源二聚体,共同参与识别革兰氏阳性菌和阴性菌的细胞壁,并可以增强对PAMPs的特异性识别。全基因组扫描发现位于6号染色体上的TLR6-TLR1-TLR10基因族有显著影响泌乳性状和临床乳房炎的数量性状位点[2]。李春苗等[4]研究表明,荷斯坦牛的TLR1基因具有丰富的多态性,且TLR1基因中的H等位基因具有作为荷斯坦牛乳房炎抗性遗传标记的潜在有效性。Russell等[3]研究发现TLR1基因对荷斯坦牛的乳房炎的发生具有显著影响。
DNA池是将具有相同特征群体的个体DNA提取后按比例混合,再经PCR扩增测序后可直接检测出SNPs的一种方法[5],具有成本低、效率高的优点。单核苷酸多态性(single nucleotide polymorphisms, SNP)是指染色体基因组中单个核苷酸的突变而引起的DNA序列的多态性,以单个碱基的颠换、转换、插入和缺失等形式存在[6],是基因组水平上最常见的一种遗传变异类型[7-8]。研究发现,哺乳动物中平均每300 ~1 000 bp就有1个SNP位点[9]。作为第三代分子标记,SNP 标记具有较大的发展潜力,目前已经建立多种SNP检测分型技术[10],如DNA芯片技术、阵列杂交分析、同源杂交法、直接测序法等[8],而理想的SNP分型方法应同时具备以下优点:1)操作简单,可实现自动化;2)通量灵活,可根据需要加以选择;3)分析速度快,数据处理容易;4)适应性强,对样本要求不高;5)结果可靠,费用可接受。然而,目前的检测方法尚无法完全满足上述要求[11]。初芹等[12]认为采用DNA池测序法筛选奶牛高信息量SNP标记是可行和可信的。利用DNA混合池和直接测序技术对未知SNPs或已知SNPs等位基因频率进行快速筛查,可极大缩短试验周期,达到显著减少基因组DNA消耗的目的。DNA池进行直接测序时所要求的等位基因频率最低为10%[13]。采用DNA池技术,方法简便,效率较高,且有效结合了PCR的特点,使试验能够更加有效便利地进行。
本试验以宁夏回族自治区的中国荷斯坦牛为研究对象,采用DNA池和直接测序法对中国荷斯坦牛TLR1基因SNPs进行筛选,并对其进行蛋白质功能预测,以期明确TLR1基因对中国荷斯坦牛免疫及育种方面的影响,为中国荷斯坦牛在分子遗传相关方面的优良育种提供理论依据。
1 材料与方法
1.1 样品采集与基因组DNA提取
试验动物:303头中国荷斯坦牛,均来自宁夏贺兰山奶业有限公司同一奶牛场,用医用采血管从中国荷斯坦牛尾静脉采血10 mL,20℃保存。采用DNA提取试剂盒(北京天根生化科技有限公司)从冻存中国荷斯坦牛血样中提取基因组DNA,用1%琼脂糖凝胶电泳检测DNA提取效果,采用UV2100紫外分光光度计(厦门群创科技有限公司)检测每个DNA 样品浓度,加双蒸水调整DNA样品浓度至100 ng·μL-1,每45个样品构建1个DNA池。
1.2 引物设计与PCR引物扩增
根据NCBI收录的中国荷斯坦牛TLR1基因的DNA序列(NM_001046504),使用Primer 6.0软件设计9对特异性引物(表1),由苏州金唯智生物有限公司合成。PCR扩增的总体系为20 μL,包括上、下游引物各0.4 μL,蒸馏水7.4 μL,Taq PCR MasterMix 11.0 μL,DNA池模板0.8 μL。PCR扩增程序:95℃预变性3 min;35个循环×(95℃变性30 s、60℃退火30 s、72℃延伸30 s);72℃终延伸10 min,4℃保存。用1%琼脂糖凝胶对扩增结果进行检测。

表1 引物信息Table 1 The information of primers
1.3 SNPs的筛选和等位基因频率估算
将经琼脂糖凝胶电泳检测后特异性良好的PCR产物经凝胶回收试剂盒 (北京天根生化科技有限公司)纯化后送至苏州金唯智生物有限公司测序。测序结果使用BioEdit和MWSnap序列图谱分析软件标尺测量中国荷斯坦牛各突变位点的等位基因峰图高度,按照公式估算各等位基因频率:
(1)
式中,Fi:某突变位点等位基因频率(i=1,2);h1、h2:测序峰图中该突变位点等位基因1和2的峰高度。
1.4 生物信息学分析
参照文献[14]对中国荷斯坦牛TLR1基因编码区进行生物信息学分析,运用在线软件AAcompldent(http://web.expasy.org/protparam/)对中国荷斯坦牛TLR1基因编码的蛋白质进行理化性质分析,并对该基因编码的蛋白质进行疏水性和亲水性的分析(http://web.expasy.org/protscale/);运用在线分析软件NetNGlyc 1.0(http://www.cbs.dtu.dk/services/NetNGlyc/)对该基因编码的蛋白质进行N-糖基化位点分析;利用PredictProtein在线服务器预测TLR1蛋白二级结构;利用SWISS-MODEL同源建模方法构建TLR1蛋白三级结构模型,运用PyMOL 1.8.6软件对突变前后蛋白三级结构进行对比并绘制结果视图。
2 结果与分析
2.1 中国荷斯坦牛TLR1基因DNA池PCR扩增结果
中国荷斯坦牛DNA样品扩增结果经1%琼脂糖凝胶电泳检测特异性好,与预期目的片段大小一致。扩增产物测序结果与NCBI中普通牛TLR1基因编码区进行BLAST比对共发现8个SNPs,分别将其命名为A61T-TLR1、C632A-TLR1、C1408T-TLR1、C1451T-TLR1、A1461G-TLR1、A1475C-TLR1、G1550A-TLR1、G1596A-TLR1(图1),导致5个氨基酸发生改变(表2)。其中A61T-TLR1错义突变使氨基酸由原来的赖氨酸(Lys)替换为甲硫氨酸(Met);C632A-TLR1突变使苯丙氨酸(Phe)变为亮氨酸(Leu);C1408T-TLR1突变使丙氨酸(Ala)替换为缬氨酸(Val);A1461G-TLR1突变使异亮氨酸(Ile)转变为缬氨酸(Val);G1596A-TLR1突变使缬氨酸(Val)转变为异亮氨酸(Ile)。
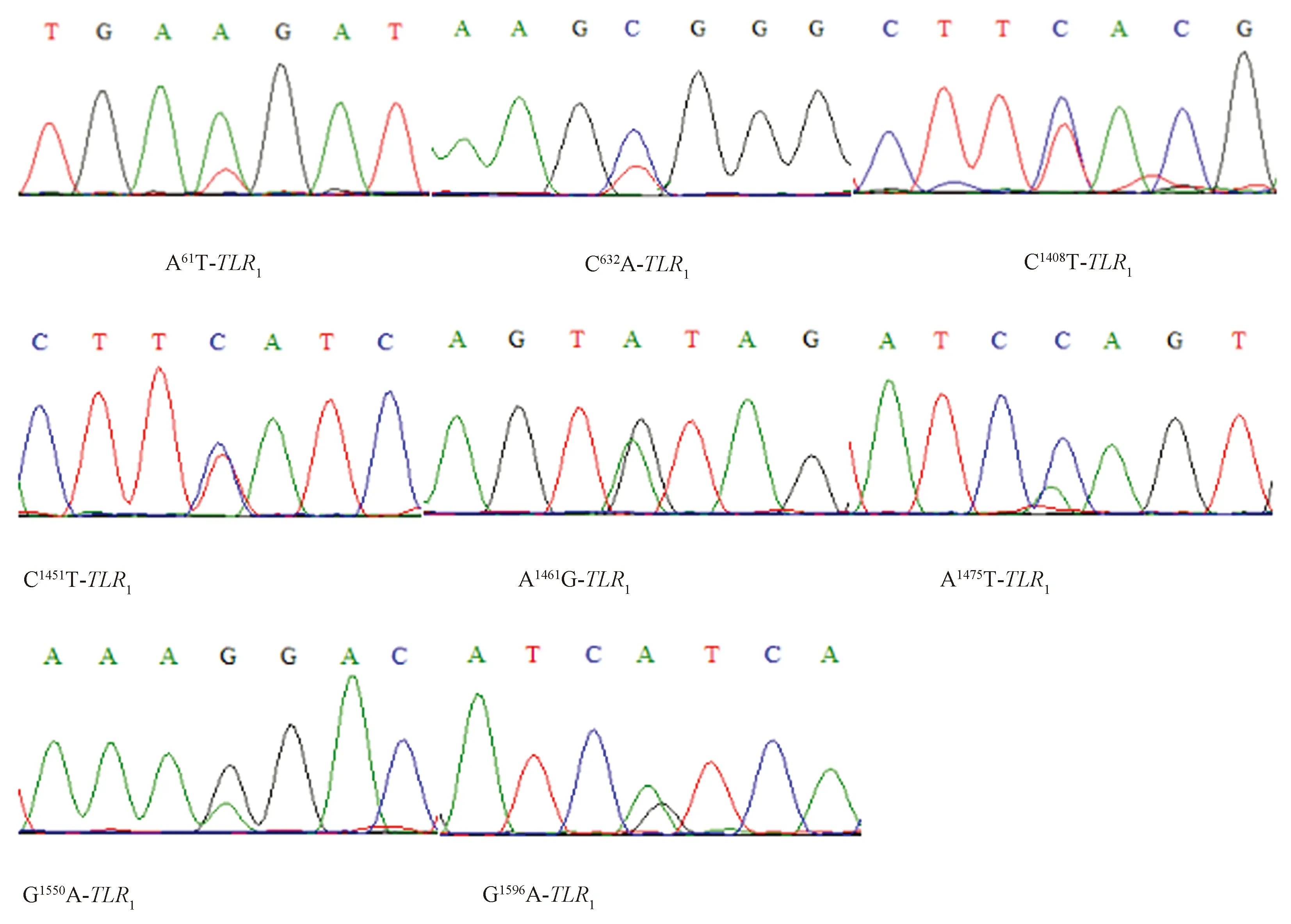
图1 中国荷斯坦牛TLR1基因编码区测序结果Fig.1 Sequencing of TLR1 coding region of Chinese Holstein cattle
2.2 SNPs筛查及等位基因频率估算
由表2可知,C632A-TLR1、C1451T-TLR1、A1461G-TLR1、A1475C-TLR1和G1596A-TLRTLR15个SNPs位点的等位基因频率在突变前后差值分别为0.190 4、0.130 4、0.117 6、0.136 4、0.181 8,而其他SNPs突变前后等位基因频率的差值分别为0.555 6、0.416 6、0.481 4。前后两组数据进行对比发现C632A-TLR1、C1451T-TLR1、A1461G-TLR1、A1475C-TLR1和G1596A-TLR15个SNPs位点的等位基因频率在突变前后差异较小,其余SNPs位点的等位基因频率在突变前后均有明显差异。

表2 中国荷斯坦牛TLR1基因的SNPs位点突变类型及等位基因频率估算Table 2 SNPs locus mutation types and estimation of allele frequency of TLR1 gene in Chinese Holstein cattle
2.3 SNPs中国荷斯坦牛TLR1基因影响mRNA二级结构
由图2可知,中国荷斯坦牛TLR1基因SNPs突变前后,mRNA二级结构发生改变,导致其最小自由能从突变前-628.48 kcal·mol-1增加到-482.80 kcal·mol-1,使mRNA二级结构的稳定性发生了改变,对蛋白质的翻译可能会造成一定的影响。
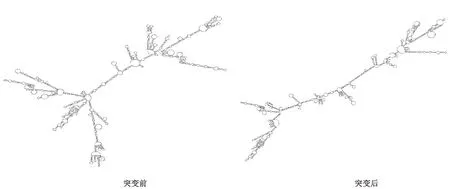
图2 中国荷斯坦牛TLR1基因mRNA二级结构Fig.2 mRNA secondary structure of TLR1 gene in Chinese Holstein cattle
2.4 中国荷斯坦牛TLR1蛋白质理化性质分析
由表3、表4可知,中国荷斯坦牛TLR1基因编码的蛋白质由727个氨基酸组成,氨基酸组成数量和频率如表4所示,其中亮氨酸(Leu)频率最高,为14.3%,色氨酸(Trp)频率最低,为1.4%,这2种氨基酸的频率之差为12.9%。由表3可知,TLR1基因编码的蛋白质分子式为C3742H5871N979O1090S32,分子质量为83.041 kDa,负电荷残基总数(Asp + Glu)为72,正电荷残基总数(Arg + Lys)为59。编码产物不稳定指数为45.64,大于40,说明该蛋白质属于不稳定蛋白。
2.5 中国荷斯坦牛TLR1蛋白质疏水性/亲水性预测和分析
由图3可知,第523位异亮氨酸(Ile)疏水性最强(+3.400);第700位谷氨酸(Glu)疏水性最弱(-2.800)。亲水性氨基酸占整条氨基酸肽链的47.43%,疏水性氨基酸占整条氨基酸肽链的52.57%,总体表现为疏水性。由此推断,TLR1蛋白质是一种非可溶性蛋白。

表3 中国荷斯坦牛TLR1基因编码蛋白质理化特性Table 3 The encoding a protein physicochemical properties of TLR1 gene in Chinese Holstein cattle
2.6 中国荷斯坦牛TLR1蛋白质信号肽分析
利用Signal P信号肽预测工具,采用神经网络法对中国荷斯坦牛TLR1蛋白质信号肽进行分析,结果中包括C值、Y值、S值3个重要参数。其中,C值是指剪切位点值,每个氨基酸会有1个C值,在剪切位点处C值是最高的;S值是指每个氨基酸对应的1个S值,在结果中有一条曲线显示S值的变化趋势,信号肽区域的S值较高;Y值是用来综合考虑S值和C值的参数,较单独考虑C值更为精确。因此,在一条系列中C值可能有不只一个较高的位点,但是剪切位点只有一个;此剪切位点可由Y-max值来推测,且该剪切位点处的S值陡峭,C值最大。中国荷斯坦牛TLR1蛋白质信号肽分析结果如图4所示,中国荷斯坦牛TLR1基因编码产物C值为0.427,Y 值为0.586,S值为0.950,其切割点位于30位的氨基酸左右,分值曲线与TLR家族其他成员相似,由此预测荷斯坦牛TLR1蛋白质存在信号肽。
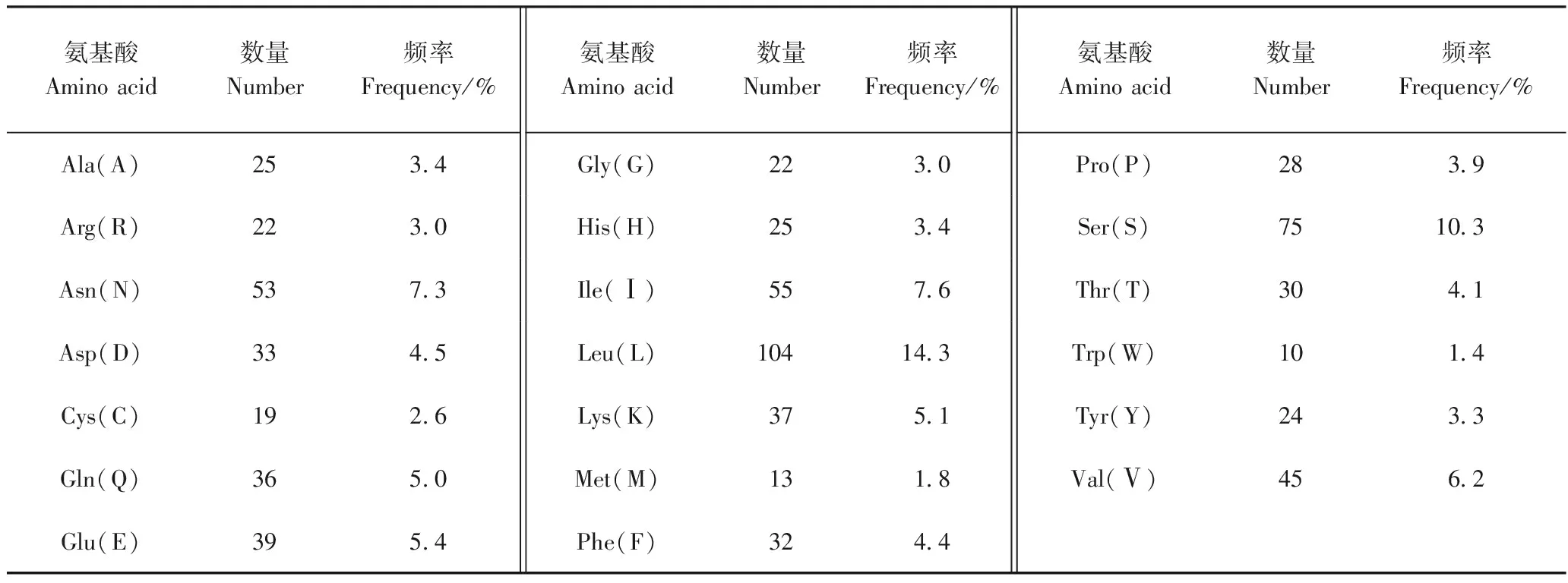
表4 中国荷斯坦牛TLR1蛋白质的氨基酸组成Table 4 The amino acid composition of TLR1 protein in Chinese Holstein cattle
2.7 中国荷斯坦牛TLR1蛋白质的N-糖基化位点分析
由图5可知,中国荷斯坦牛TLR1编码蛋白质中有 6个潜在N-糖基化位点,分别为Asn31、Asn96、Asn176、Asn260、Asn330、Asn369。蛋白质糖基化是指糖蛋白的蛋白结构共价结合糖链结构形成的位点,与蛋白质的高级结构存在密切联系,具有定向调节蛋白质的功能,并参与包括细胞识别、细胞分化、发育、信号转导、免疫应答等各种重要的生命活动[15]。研究发现在肿瘤、神经退行性疾病、心血管病、代谢性疾病、免疫性疾病及感染性疾病中,均伴随着蛋白质糖基化异常的发生[16]。N-糖基化位点存在的越多,发生异常的可能性越大,对机体的免疫应答亦会有影响。由此预测,中国荷斯坦牛TLR1基因可能与乳房炎的发生密切相关。
2.8 突变前后中国荷斯坦牛TLR1蛋白质功能预测分析
由表5可知,多种与免疫相关因子的几率相对较高,其中生长因子的几率为2.857,胁迫应答和免疫应答的几率分别为2.534和1.447,几率最高的是荷尔蒙,达到17.538。由此预测,中国荷斯坦牛TLR1基因在免疫调节和机体生理调节发挥着重要作用,与牛的抗病能力提高密切相关。
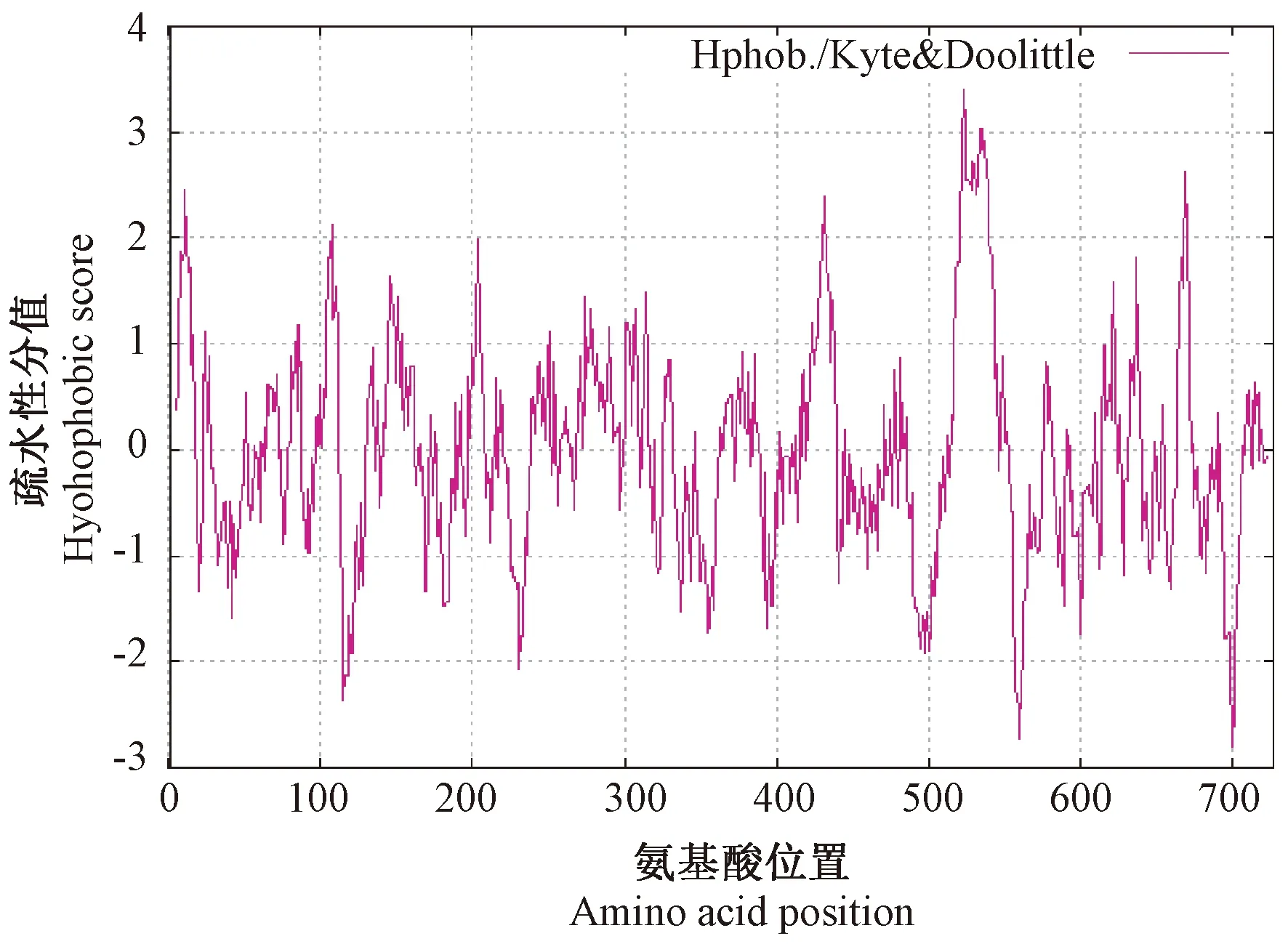
注:正值:亲水;负值:疏水。Note:Positive value:Hydrophobicity. Negative value: Hydrophilicity.图3 中国荷斯坦牛TLR1蛋白质疏水性/亲水性预测分析结果Fig.3 Hydrophobicity/hydrophilicity prediction results in Chinese Holstein cattle TLR1 protein
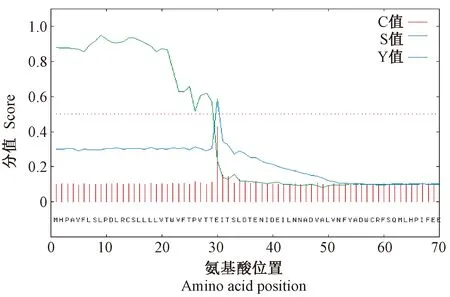
图4 中国荷斯坦牛TLR1蛋白的信号肽分析结果Fig.4 Signal peptide analysis results in Chinese Holstein cattle TLR1 protein
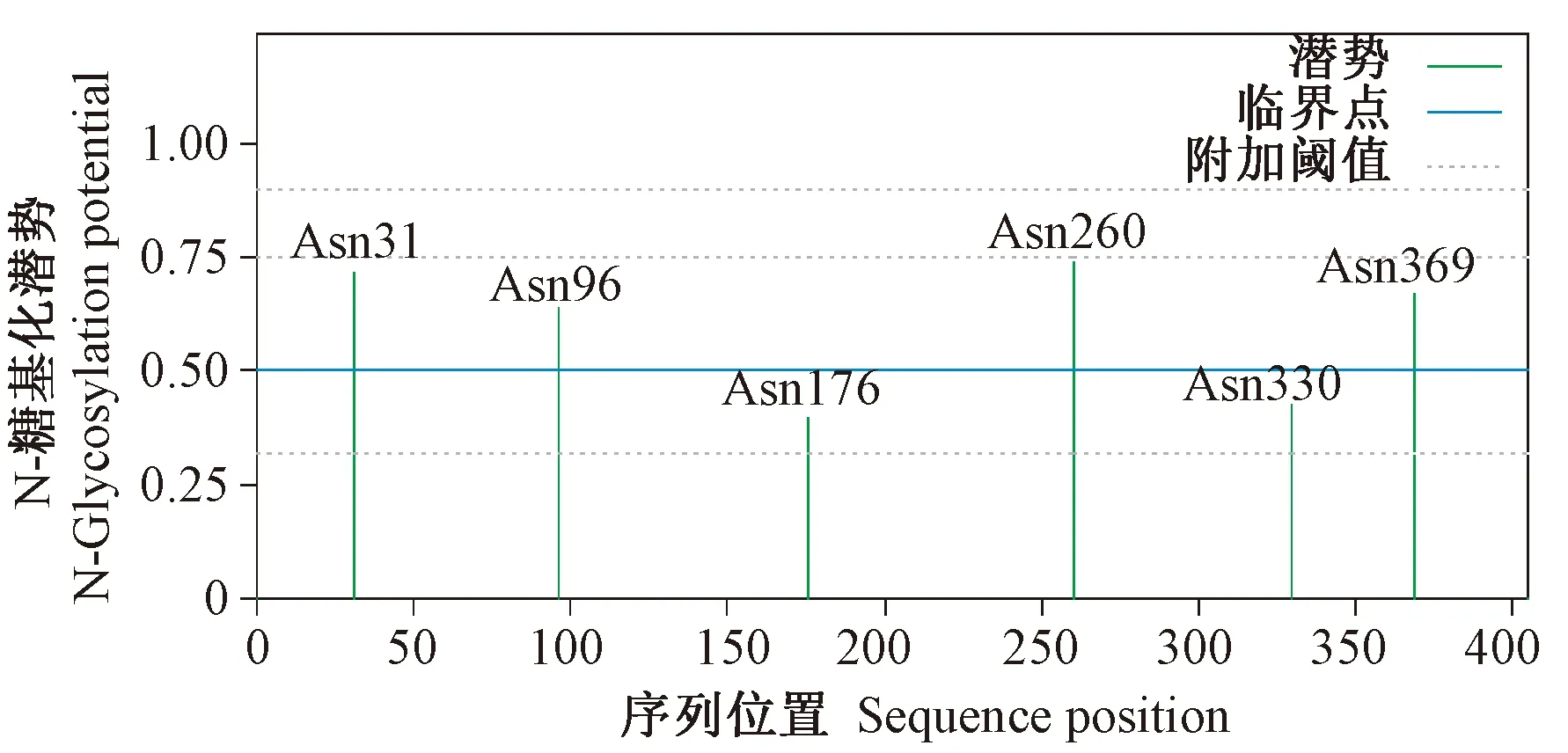
图5 中国荷斯坦牛TLR1蛋白质的N-糖基化位点预测结果Fig.5 N-glycosylation site prediction results in Chinese Holstein cattle TLR1 protein

GO功能 GO function几率 Probability信号转导 Signal transduction1.271受体 Receptor0.047荷尔蒙 Hormone17.538结构蛋白 Structural protein0.107运载体 Transporter0.394离子通道 Ion channel1.386电压门控离子通道 Voltage-gated ion channel0.136阳离子通道 Cationic channel0.217转录 Transcription0.242转录调控 Transcriptional control0.248胁迫应答 Stress response2.534免疫应答 Immune response1.447生长因子 Growth factor2.857金属离子转移 Metal ion transfer0.056
2.9 突变前后中国荷斯坦牛TLR1蛋白质二、三级结构预测分析
由表6、图6可知,突变后,α-螺旋(alfar helix, Hh)变化量最大,含量增加了1.24%;β-折叠(beta sheet, Ee)、无规则卷曲(random coil, Cc)含量均有所减少,其中无规则卷曲降幅较大,为1.10%,β-折叠减少了0.14%;β-转角(beta-turn, Tt)含量未发生改变。α-螺旋在中国荷斯坦牛TLR1基因编码的蛋白质二级结构中含量最高,起主导作用,如果α-螺旋含量发生改变,该蛋白质结构的稳定性也会发生一定的改变。
对TLR1蛋白进行三级结构预测,可使用ESypred3D Web Server 1.0同源建模。由图7可知,TLR1蛋白三级结构是由多个α-螺旋和β-折叠构成,且2种结构平行交替排列,构成一个弯曲状螺旋结构;突变前后TLR1蛋白三级结构无明显变化。

表6 中国荷斯坦牛TLR1基因突变前后二级结构变化Table 6 Secondary structure changes before and after TLR1gene mutation in Chinese Holstein cattle /%

注:h:α-螺旋; e: β-折叠; t: β-转角; c: 无规则卷曲。Note:h: α-helix. e: β-strand. t: β-turn. c: Random coil.图6 中国荷斯坦牛TLR1蛋白二级结构预测Fig.6 Prediction result of secondary structure in Chinese Holstein cattle TLR1 protein
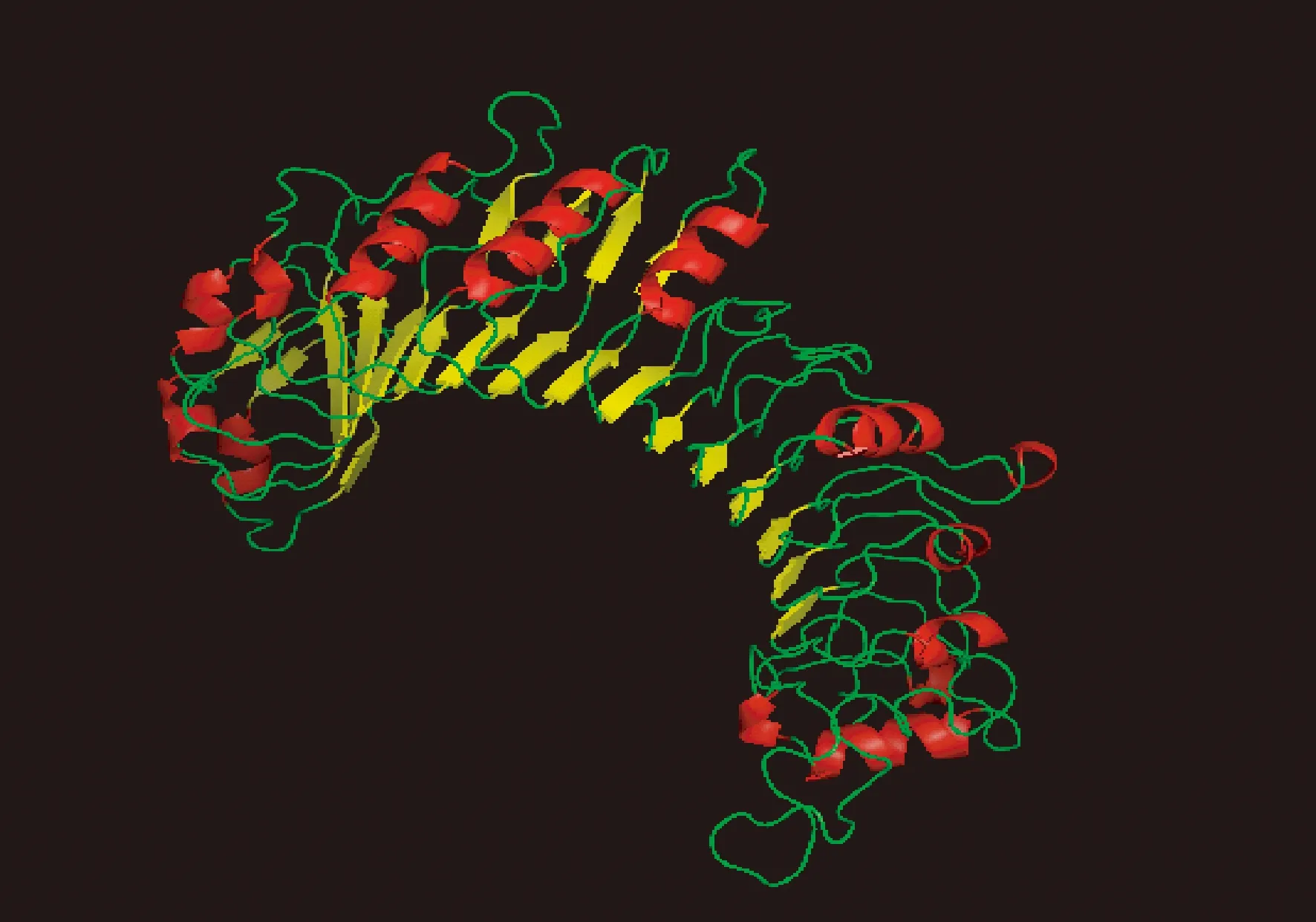
注:红色:α-螺旋;黄色:β-折叠;绿色:β-转角和无规则卷曲。Note: Red: α-helix. Yellow: β-strand. Green: β-turn and random coil.图7 中国荷斯坦牛TLR1蛋白三级结构模型预测Fig.7 Prediction result of tertiary structure in Chinese Holstein cattle TLR1 protein
3 讨论
TLR1基因在动物中的研究已有大量报道。Vahana等[17]研究发现在水牛肝脏、肺脏、脾脏、心脏中TLR1基因表达量较高,而在肾脏、卵巢中的表达量较低或不表达,而陈亚冰等[1]研究表明,TLR1基因在牦牛肾脏和卵巢中的表达量较高,并提出这可能与牦牛的局部组织免疫有关。Wang等[18]研究发现与水牛TLR1基因类似,鲤鱼的TLR1基因同样在脾脏中表达量较高,但不同的是,其在鲤鱼的后肠和口腔上皮细胞中表达较低,表明物种不同,TLR1基因表达的差异较大。Yang等[19]研究表明,非功能性TLR1602S/S 基因型可能通过减少Th1细胞反应,降低幽门螺杆菌感染相关胃病的发病风险。Hawn等[20]和Omueti等[21]研究发现TLR1多态性可调节对脂肽的先天性免疫应答反应和对广谱致病菌的临床易感性。Schumann等[22]研究表明,在广东汉族人群样本中,未发现在欧洲和非洲人群中高频且与疾病易感的非同义 SNPs 位点+1805G/T (Ile602Ser,rs5743618),且有证据表明,Ile602Ser位于TLR1跨膜区的SNP位点能调节细菌脂肽的识别,从而影响天然免疫应答和对一些病原体的临床易感性。在免疫研究方面,Moisan等[23]认为TLR1作为TLRs的亚家族,表达于多种免疫细胞受体,在免疫应答和感染中起重要作用,且与哮喘炎症及气道重塑有密切联系,这与本研究结果类似。本研究中,中国荷斯坦牛的TLR1基因与荷斯坦牛的免疫调节、生理调节均有密切联系。
截至目前,已发现15种TLRs,其中包含人体内TLR1-TLR10及TLR14;小鼠体内TLR11-TLR13;鸡体内存在TLR15[24],且与其抗病力显著相关[5];对荷斯坦牛TLRs基因多态性的研究主要集中在TLR2和TLR4基因,而国内关于对荷斯坦牛TLR6基因的研究[25-26]尚鲜见报道,而对中国荷斯坦牛TLR1基因的研究更为稀少,李春苗等[4]发现荷斯坦牛TLR1编码区(coding sequence, CDS)有4个SNP突变,但仅一个是非同义突变。Russell 等[3]对TLR1基因5′端和CDS区SNP突变进行了检测,发现-79.T>G和3′端UTR区+2 463C>T显著影响临床乳房炎(clinicalmastitis, CM)发生。陈亚冰等[1]研究发现麦洼牦牛TLR1基因的主要功能是协助TLR2增强对病原体相关分子模式的识别能力,TLR2与TLR1形成的异源二聚体可识别分枝杆菌三酰脂蛋白,并能够增强对PAMPs的特异性识别,因此TLR1也被认为是乳房炎易感性候选基因。
蛋白质是生命活动的承担者,在基因调控中起着重要的作用,同时其结构又会影响物种的生命活动代谢,蛋白质的一级结构、二级结构以及高级结构互相影响,发挥着一定的生理学功能[27]。本研究发现中国荷斯坦牛TLR1基因中存在A61T-TLR1、C632A-TLR1、C1408T-TLR1、C1451T-TLR1、A1461G-TLR1、A1475C-TLR1、G1550A-TLR1、G1596A-TLR1共8个SNPs位点,导致5个氨基酸发生突变,这与Russell等[3]和李春苗等[4]研究结果部分相同。Russell等[3]和李春苗等[4]研究发现SNPs位点仅有一个相同,即A1475C-TLR1,且为同义突变,而本研究中8个SNP位点中有3个同义突变,其余皆为错义突变,这可能与奶牛群体不同有关。宁夏回族自治区和河北地区的环境、管理和选育模式的差异在一定程度上也会影响荷斯坦牛的遗传背景,从而导致结果产生差异。本研究结果表明,A61T-TLR1、C1408T-TLR1、G1550A-TLR13个SNPs在突变前后基因频率差异较大,可能对中国荷斯坦牛乳房炎有显著影响。本研究结果表明,中国荷斯坦牛TLR1蛋白质的二级结构主要由α-螺旋、β-折叠、β-转角和无规卷曲组成,其中以α-螺旋为主,其含量远大于其他二级结构,对该蛋白质的稳定性具有显著影响,且该蛋白质的不稳定指数大于40,属于不稳定蛋白[28];中国荷斯坦牛TLR1蛋白质的三级结构在突变前后未有较大改变,预测结果与二级结构预测结果一致,结构的改变,导致与其相关的功能及其抗病能力也会发生一定程度的改变。蛋白质N端含信号肽,蛋白质肽链经过引导可进入腔内,从而定位蛋白质[29]。蛋白质的氨基酸序列中既含有决定蛋白质定位和靶向修饰的信号,还有决定蛋白质寿命信号[28]。本研究发现TLR1基因信号肽的切割点位于30位的氨基酸左右,它对于外分泌蛋白的分泌起主导作用,表明中国荷斯坦牛TLR1基因对机体的免疫应达具有重要影响。此外,本研究还发现,在中国荷斯坦牛TLR1基因编码的蛋白质中有6个潜在的N-糖基化位点,蛋白质糖基化主要修饰天冬酰胺上的N端,通过影响免疫分子的结构和功能,进一步影响机体对抗原的应答反应[30]。经过对中国荷斯坦牛TLR1蛋白质功能的预测发现,多种与免疫相关因子的几率相对较高,与中国荷斯坦牛的免疫能力有较大的相关性;与荷尔蒙相关的几率最高,表明TLR1基因对中国荷斯坦牛的生理调节具有重要影响,与该品种牛乳房的正常生理功能有密切的联系。
4 结论
本研究通过对中国荷斯坦牛TLR1基因进行多态性分析和蛋白质功能预测,发现该基因与中国荷斯坦牛的免疫能力与生理机能有密切相关,且对中国荷斯坦牛的乳房炎具有显著影响。今后工作应进一步对中国荷斯坦牛乳房炎的相关因子进行研究,为中国荷斯坦牛的抗病育种供理论基础。

