蓖麻WOX转录因子家族成员的全基因组分析及逆境胁迫响应
韩雯毓 李国瑞 风 兰 闫星伊白英俊 李孟建 孙佳欣 陈永胜,2,*
(1 内蒙古民族大学,内蒙古自治区 通辽 028000;2 内蒙古自治区高校蓖麻产业工程技术研究中心/ 内蒙古自治区蓖麻育种重点实验室/内蒙古自治区蓖麻产业协同创新中心,内蒙古自治区 通辽 028000)
WOX(WUSCHEL-related home-obox)转录因子是植物特异性转录因子,对植物的生长发育和应激反应具有重要作用[1]。WOX蛋白来自Homepbox(HOX)超家族,其具有由60~65个氨基酸组成的螺旋-环-螺旋-转角-螺旋结构(T-L-X-L-F-P-X-X,其中X代表任一氨基酸)的保守结构域。WOX转录因子家族在植物中广泛存在,目前已在拟南芥、水稻、玉米等[1]植物中得到鉴定。研究表明WOX转录因子与植物器官形成、干细胞分裂、胚胎发育等生命进程密切相关[2]。WOX家族可分为三个独立的进化支,即现代进化支(Modern clade)、中间进化支(Intermediate clade)和古代进化支(Ancient clade)。研究表明,拟南芥AtWOX1与AtWOX3可以调控叶片发育过程中侧生组织的发育,AtWOX9可以维持分生细胞的生长和分裂[3];AtWOX14和AtWOX4可调节形成层和原形成层分生组织的分化[4-5]。
蓖麻(RicinuscommunisL.)为大戟科一年生或多年生草本植物[6],在农业、工业、医药及纺织等领域具有较高的应用价值与经济价值[7-8],也是可再生生物能源的优质材料[9]。大部分石油产品均可由蓖麻油及其洐生物制备而获得,被人们誉为极具开发潜力又可再生的“绿色石油”[10]。随着耕地的减少、世界能源的日益紧缺,蓖麻作为唯一可替代石油的农作物产品,遗传改良其重要农艺性状和培育高产优质的抗逆品种是实现稳产增产的重要方法[11]。尽管目前在拟南芥、水稻等模式植物中已有关于WOX转录因子家族在系统发育规模及其功能的研究报道,但关于蓖麻WOX转录因子家族全面的分子进化研究尚鲜见报道。
本研究利用生物信息学技术手段对蓖麻WOX转录因子家族进行预测,分析其蛋白保守结构、基因结构、家族进化及其在干旱与盐胁迫下根、茎、叶不同组织的表达模式,旨在更好地了解WOX转录因子家族在蓖麻中的进化历史与多样性,为蓖麻WOX转录因子家族在逆境响应中的功能研究提供一定的理论参考。
1 材料与方法
1.1 材料
蓖麻植株材料由内蒙古自治区通辽市农业科学研究院提供,基因组文件下载自蓖麻基因组数据库(http://castorbean.Jcvi.org/index.php)。拟南芥WOX转录因子序列下载自TAIR(http://www. Arabidopsis.org/)。水稻WOX转录因子序列下载自PlantTFDB (http://planttfdb.cbi.pku.edu.cn)。
1.2 蓖麻WOX转录因子家族的鉴定与理化性质分析
通过蓖麻基因组文件构建本地数据库,WOX隐马尔科夫模型(PF00046)下载自Pfam[12](http://pfam.xfam.org)。采用HMMER提取蓖麻基因组中的WOX蛋白序列,将所得到的序列在NCBI数据库中进行比对,去除冗余序列。为确保序列准确性,将含有WOX结构域的序列提交至SMART再次进行鉴定[13]。最后将含有WOX结构域的序列在PlantTFDB中进行比对与分析,进一步鉴定其是否属于蓖麻WOX转录因子家族。利用ExPASy Proteomics (http://web.expasy.org/compute_pi)在线工具对WOX家族成员进行理化性质分析[14]。
1.3 蓖麻WOX转录因子系统发育分析
将蓖麻WOX蛋白分别命名为RcWOX1~RcWOX11,通过ClustalW将拟南芥、水稻与蓖麻的WOX蛋白序列进行比对[15-16];利用MEGA7.0进行系统发育分析,采用邻接法(neighbor-joining,NJ)法构建系统发育树,bootstrap参数设置为1 000,其他为默认参数。
1.4 基因结构与保守基序分析
利用在线软件GSDS (Gene Structure Display Server 2.0 http://gsds.cbi.pku.edu.cn)与MEME5.2(http://meme-suite.org)进行基因结构与保守基序分析[17]。
1.5 前处理试验
以蓖麻2129品系为试验材料,采用盆栽法,待蓖麻长出4片真叶后,选取长势一致的植株进行处理。干旱胁迫组采用霍格兰营养液+30%聚乙二醇(polyethylene glycol, PEG)处理;盐胁迫组采用霍格兰营养液+0.2 mol·L-1NaCl进行处理;对照组采用等体积的霍格兰营养液浇灌。在处理0、3、6、9、12、24 h后采集根、茎、叶样品,立即液氮速冻,-80℃保存备用。
1.6 蓖麻WOX家族基因的表达分析
按照RNA提取试剂盒(北京庄盟国际生物基因科技有限公司)说明书提取蓖麻根、茎、叶RNA,逆转录参照PrimeScriptTM1st Strand cDNA Synthesis Kit试剂盒[TaKaRa(日本)公司]说明书进行,实时荧光定量PCR(real time quantitative PCR,RT-qPCR)采用TB GreenTMPremix Ex TaqTM(Tli RNaseH Plus)试剂[TaKaRa(日本)公司]在7500荧光定量PCR仪(北京赛默飞世尔有限公司)上完成,以蓖麻18S为内参基因,引物序列详见表1。
1.7 数据统计与分析
利用Microsoft Excel 2010统计数据;利用SPSS 22.0对数据进行差异显著性分析。

表1 RT-qPCR引物序列Table 1 Primer sequences of RT-qPCR
2 结果与分析
2.1 WOX转录因子家族成员的鉴定及其理化性质分析
利用HMMER软件提取蓖麻WOX蛋白序列,利用Pfam和SMART确定含有WOX结构域的蛋白,去除冗余序列后,将序列与PlantTFDB中WOX转录因子进行比对,最后鉴定到具有典型WOX结构域的转录因子家族成员共11个,分别将其命名为RcWOX1~RcWOX11。由表2可知,RcWOX6蛋白序列最长(401 aa),分子量也最大,RcWOX1蛋白序列最短(163 aa);等电点为5.35~10.00,其中55%为碱性蛋白质。推测的蛋白分子量为19 451.27~45 168.8 kDa,脂肪族氨基酸指数为44.34~82.02。蓖麻WOX家族蛋白质的亲水性平均值为-0.429~-1.163,说明其均为亲水蛋白质,但在亲水程度上存在差异。
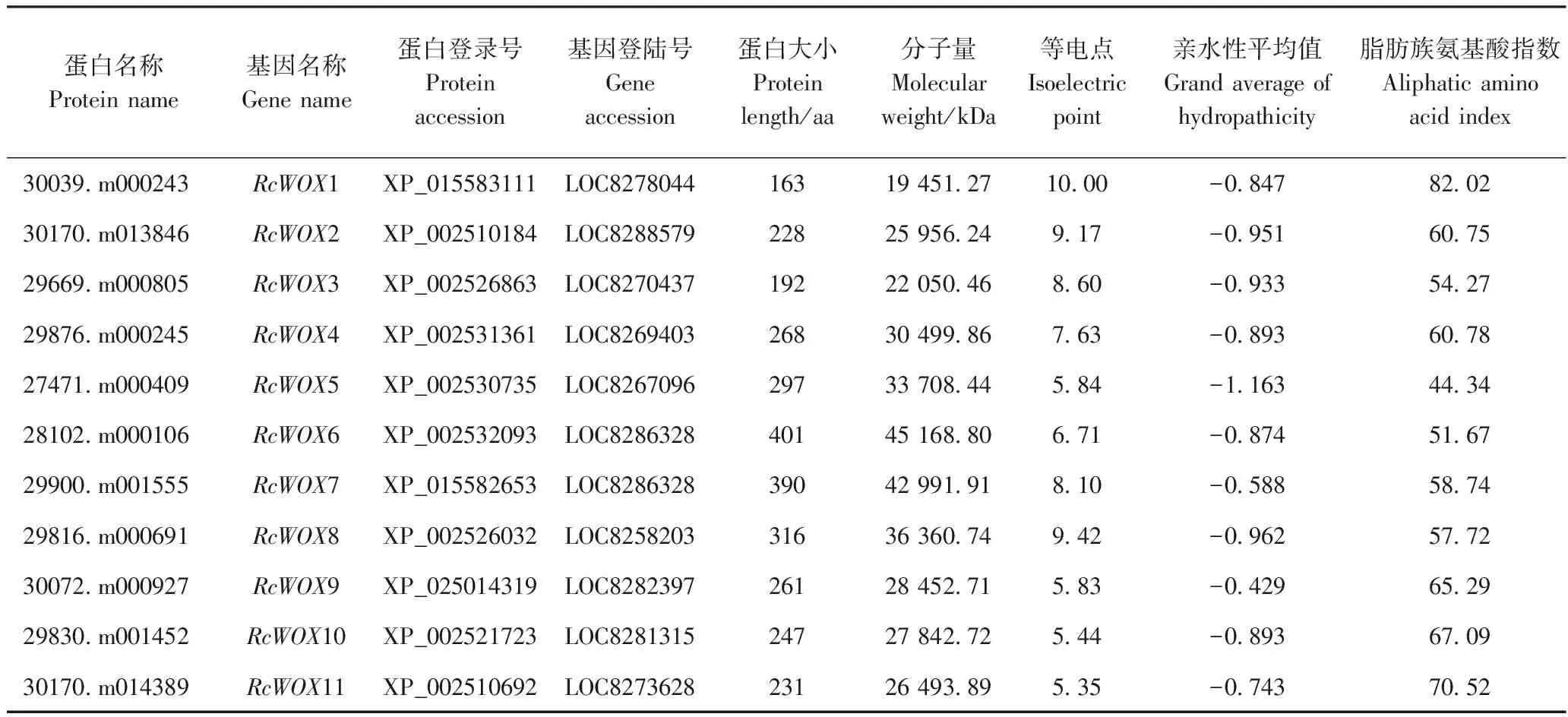
表2 蓖麻WOX转录家族成员的鉴定及特征Table 2 Characteristics and identification of WOX transcription factors in castor
2.2 蓖麻WOX转录因子家族系统发育分析
为揭示蓖麻WOX转录家族的进化关系,以拟南芥与水稻的WOX转录家族成员为参考,对鉴定的11个含有蓖麻WOX转录家族成员的同源异型结构域序列进行比对,使用MEGA7.0进行了系统发育分析。根据拟南芥与水稻中的报道,WOX蛋白分为三个亚家族,分别为古代进化支、中间进化支与现代进化支。由图1可知,在蓖麻RcWOX蛋白家族中,古代进化支与中间进化支各有2名成员,分别为RcWOX10、RcWOX11与RcWOX7、RcWOX9,现代进化支包括RcWOX1、RcWOX2、RcWOX3、RcWOX4、RcWOX5、RcWOX6及RcWOX8共7名成员。

图1 蓖麻与拟南芥WOX转录因子家族进化树Fig.1 The phylogenetic tree of WOX gene family in castor and Arabidopsis thaliana
2.3 蓖麻WOX转录家族基因结构及保守基序分析
由图2可知,同一进化支内成员的基因结构均较保守,且内含子、外显子数存在差异。RcWOX9、RcWOX11、RcWOX6分别含有2、3、4个外显子,表明WOX基因功能的多样性可能是由于基因家族进化过程中外显子的丢失或增加导致的。对5个保守基序进行分析发现,不同成员均含有约65个氨基酸残基组成的同源异型结构域,且不同分支的保守结构域与基因结构的数、种类均具有高度一致性,即系统发育分析可靠性较高。但对一些分支,有些基序是独特存在的,如基序4是古老进化支特有的,基序3是中间进化支特有的,从某种程度上讲,这些基序可能对进化支起重要作用,且对基因功能的多样性也具有一定作用。
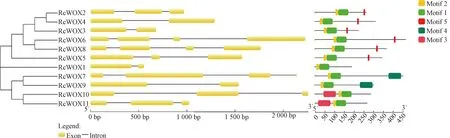
图2 蓖麻WOX转录因子家族基因结构与蛋白保守结构域Fig.2 Gene structure and conserved motif of WOX transcription factors in castor
2.4 蓖麻WOX基因在干旱胁迫下的表达模式分析
根据系统发育结果选取古代进化支成员RcWOX9,中间进化支成员RcWOX10与现代进化支成员RcWOX2、RcWOX4、RcWOX8共5个基因检测其在30% PEG处理下不同时间RNA水平上的表达情况。由图3可知,5个基因在3种组织中均有表达,且在不同组织中的表达模式存在差异性。在未胁迫处理下,5个基因均在根中相对表达量最高,且RcWOX2、RcWOX4、RcWOX8、RcWOX10在根、茎、叶中的相对表达量依次表现为根>茎>叶;RcWOX9在茎中相对表达量最低。干旱胁迫诱导RcWOX2、RcWOX4、RcWOX8、RcWOX9表达,处理时间3 h时RcWOX4、RcWOX8、RcWOX9在根中相对表达量迅速上调;RcWOX2在处理9 h内茎中的相对表达量持续上调,之后随着胁迫处理时间的增加持续下调。干旱胁迫抑制RcWOX10的表达,随着胁迫处理时间的增加,其在根中的相对表达量呈下调趋势。
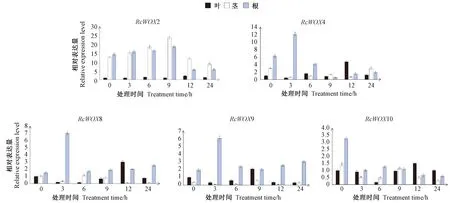
图3 干旱处理下蓖麻RcWOX基因的表达水平Fig.3 Expression level of RcWOX genes under drought treatments
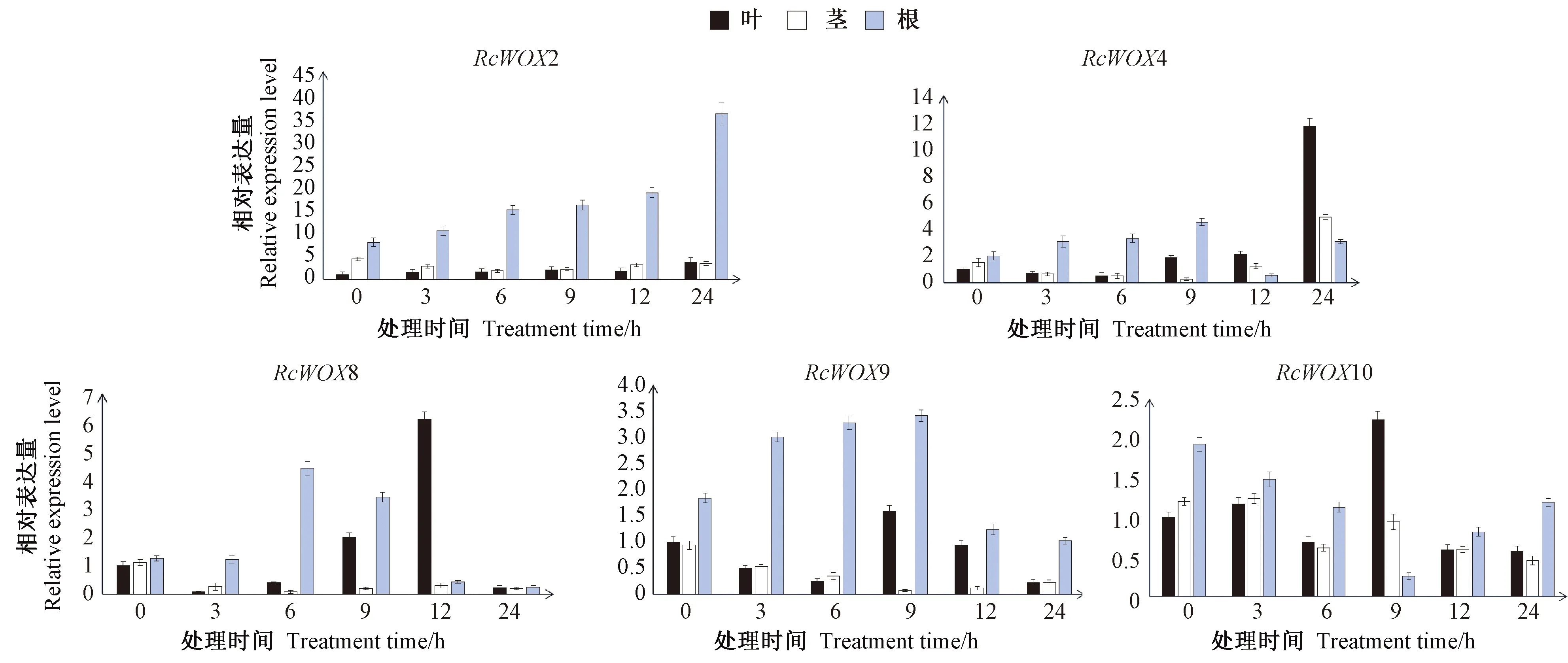
图4 盐处理下蓖麻RcWOX基因的表达水平Fig.4 Expression level of RcWOX genes under salt treatments
2.5 蓖麻WOX基因在盐胁迫下的表达分析
由图4可知,在盐胁迫下,5个基因均被诱导表达,不同胁迫处理时间下根中RcWOX2和RcWOX9的相对表达量均高于茎和叶,且根中RcWOX2的相对表达量随着胁迫处理时间的增加持续上调;随着胁迫处理时间的增加,RcWOX4、RcWOX8、RcWOX9在根中的相对表达量均呈现先升高后降低的趋势,RcWOX10则在盐胁迫处理后的9 h内急剧下降,之后又呈升高的趋势。
3 讨论
全基因组分析已成为研究某些物种的基因家族最基础的工具[18]。WOX转录因子作为植物中特有的转录因子,对植物的生长发育以及应激反应具有重要作用[19]。AtWUS是拟南芥WOX家族转录因子中最早被鉴定的成员,Haecker[20]利用WUS同源异型盒进行同源搜索得到14个编码WUS同源异型盒开放阅读框,将与WUS同源异型结构域具有38%~67%一致性和62%~87%相似性的蛋白命名为WOX蛋白家族,并将其根据进化树分为古代进化支、中间进化支与现代进化支三个进化支。本研究从蓖麻基因组中鉴定出11个WOX成员,在古代进化支、中间进化支和现在进化支分别有2、2和7个成员,系统发育分析结果与拟南芥[21]、番茄[22]、水稻[23]等模式植物类似。对不同成员理化性质进行分析,发现不同蛋白之间均存在差异。其中RcWOX6和RcWOX7是由同一基因LOC8286328编码而成,这可能是由RNA的选择性剪接造成[24]。研究表明,WOX转录因子家族广泛参与植物分生组织的调控。现代进化支的成员AtWUS和AtWOX5可以在根尖分生组织中维持干细胞稳定性[25];在中间进化支中,AtWOX11在形成层中特异性表达,可促进不定根的形成[26]。在古代进化枝中,AtWOX13可促进果实的胚胎发育[27]。不同物种进化支的紧密聚类表明其具有共同的起源,从直系同源基因的进化结果来看,RcWOX10可能与果实胚胎发育有关[28-29],蓖麻RcWOX4可能参与根的生长与发育[30],推测其可能在根的干旱与盐胁迫响应方面具有重要作用。
已有研究表明,干旱处理下,几乎所有水稻OsWOXs基因在处理12 h时均被诱导上调表达。盐胁迫能诱导OsWOX3和OsWOX5上调表达[31]。本研究中,干旱胁迫诱导RcWOX2、RcWOX4、RcWOX8、RcWOX9的表达,当处理时间达3 h时RcWOX4、RcWOX8、RcWOX9在根中表达量迅速上调,说明这些基因能在干旱胁迫中快速响应。盐胁迫下,5个基因均被诱导表达,RcWOX2在根中的表达量随着胁迫处理时间的增加持续上调,说明逆境胁迫诱导该基因表达;随着胁迫处理时间的增加,RcWOX4、RcWOX8、RcWOX9在根中的表达量均呈先上升后降低的趋势;RcWOX10则在盐胁迫处理后的9 h内急剧下降,之后又恢复并呈升高趋势,推测其可能参与了胁迫后期的修复过程[32],表明RcWOX2、RcWOX4、RcWOX8、RcWOX9、RcWOX10基因在蓖麻抗盐胁迫中具有重要作用。
4 结论
本研究从蓖麻基因组数据中鉴定并获得11个WOX转录因子,系统发育分析表明,蓖麻RcWOX转录因子家族成员分为三个分支,在古代进化支、中间进化支和现在进化支分别有2、2和7个成员;5个RcWOXs基因除RcWOX10受干旱胁迫抑制,其余基因在干旱和盐胁迫下均被诱导表达,表明WOX类转录因子可能对蓖麻逆境胁迫应答反应起调控作用。本试验结果为进一步研究蓖麻WOX转录因子家族在逆境胁迫中的功能提供了理论参考。

