海岛棉纤维均一化酵母双杂交文库的构建与GbTCP5互作蛋白的筛选
郑 凯 曲延英 倪志勇 蔡永生 石颖颖 陈全家
(新疆农业大学农学院/农业生物技术重点实验室,新疆维吾尔自治区 乌鲁木齐 830052)
棉花(GossypiumSPP)是全球重要的经济作物之一。目前,商用棉花在全球80多个国家都有种植,包括中国、美国、澳大利亚等。中国有着2 000多年的棉花种植历史,棉区主要分布在北纬19°~ 45°。随着品种改良和栽培技术的改善,我国棉花栽培产量也在稳步提升,逐渐进入世界高产国行列。海岛棉凭借其纤维细长、富有丝光、强力较高的优点,已成为高档纺织和特种棉纺品的重要原料。由于全球经济竞争加剧,纺织工业也对棉花纤维品质提出了更高的要求。随着消费理念的提升,人们对回归自然的渴望逐渐加剧,也加剧了对纯棉纺织品的需求,这都对纤维品质改良提出了更加迫切的要求。
环境条件影响植物的发育,与植物生长之间的发展也是动态平衡的,因此植物生长发育的可塑性对其生存显得尤为重要,这就意味着植物调整其生长之前必须相互感知和权衡多种环境刺激。因此,很多调节蛋白参与着调控植物对环境的应激反应,TCP蛋白就参与这种复杂生理的调控[1]。TCP是植物特有的一类转录因子,广泛存在于各类植物中,在植物生长发育过程中起着重要的调控作用。cDNA文库是筛选和克隆基因cDNA序列的重要方法之一[2]。而构建植物特定组织mRNA信息的cDNA文库,也是研究基因结构和蛋白功能的有效手段之一[3]。酵母双杂交是最早由Fields和Song创建的一种研究蛋白互作的技术[4],最先应用于酵母,然后被推广到植物和动物的研究中。该方法主要借助遗传学方法分析酵母蛋白质之间的相互作用,现已被广泛应用于蛋白质组学、细胞信号转导和功能基因组学等众多生物学领域。
TCP家族成员的序列中都含有一个保守的区域,称为TCP结构域(TCP domain)。TCP domain由55~59个氨基酸组成,其二级结构是一个碱性区螺旋-环-螺旋结构(bHLH结构域),该二级结构能促使TCP家族成员与DNA结合,并通过其bHLH结构域与其他蛋白相互作用,使TCP家族成员之间形成同源或异源二倍体[5-7]。目前,TCP蛋白已经被证实参与植物的生长和发育、种子的萌发、茉莉酸的合成以及调控叶片的衰老[8-9],还参与配子的发育[10-11],并在昼夜节律和防御反应中发挥着重要的作用[12]。研究人员针对植物中TCP转录因子家族开展了诸多研究,但所做研究不系统也不完全,因此TCP转录因子家族参与植物生长发育过程的相关分子机理的研究尚存在大量空白。海岛棉中TCP转录因子家族成员较多[13],功能十分复杂,不同成员之间基因差异很大,且存在冗杂、竞争、互作关系。此外,棉花的纤维发育又是一个复杂的动态过程[14],陈全家课题组在前期针对海岛棉不同时期纤维转录组数据的研究中发现,GbTCP5基因在纤维发育起始期有表达,但其相关功能未知。查阅文献发现,在棉花TCP转录因子中,相关的研究报道甚少。海岛棉中的一个GbTCP转录因子在棉花纤维细胞伸长阶段(5~15 d)高表达,且该基因能积极调控茉莉酸的水平,激活纤维和根毛伸长的下游基因,从而使纤维和根毛伸长[15]。而GhTCP14是陆地棉中的转录因子,主要在纤维发育的起始阶段特异表达,拟南芥中过表达该基因时,会改变生长素的分布,同时与生长素合成相关的基因,如AUX1、PIN2和IAA3的表达水平也会改变[16]。上述研究表明,GhTCP14可能通过直接调节与生长素相关的GhAUX1、GhPIN2和GhIAA3基因来调节棉花纤维发育。因此,针对海岛棉中TCP转录因子的研究显得至关重要。
1 材料与方法
1.1 试验材料
试验材料为海岛棉新海21号,由新疆农业大学作物遗传育种实验室提供。2017年4月种植于新疆阿拉尔市农一师16团新疆农业科学院实验站,该地区年日照时数2 556~2 991 h,无霜期平均在200 d以上,适合海岛棉的生长和发育。
海岛棉新海21号播种后实行正常田间管理,参照前期课题组的方法采集纤维样品[17],将开花当天的棉花花朵挂牌标记为0 d,分别采取新海21号开花当天(0 d)胚珠,以及开花后5、10、15、20、25、30、35 d的纤维组织,每个时期取2个重复。剥开棉桃取样时迅速将纤维与胚珠分离,立即将棉花纤维放置液氮中保存备用。室内采样的新海21号需先将种子剥去种皮,将种仁浸泡于70%无水乙醇消毒3 min,然后用无菌水反复冲洗3~5次,再将种子平铺在放有滤纸的发芽盒中,28℃暗培养4 d后取下胚轴,剩余的移植到营养液中继续生长,待子叶完全展开时取样,提取RNA。
1.2 试验方法
1.2.1 海岛棉不同发育时期的纤维总RNA提取 使用RNA prep Pure plant Kit试剂盒[天根生物(北京)有限公司],从液氮中取出海岛棉开花当天(0 d)胚珠,以及开花后5、10、15、20、25、30、35 d的纤维组织,迅速放于装有液氮的研钵中充分磨碎。称取适量的粉末置于2 mL无菌无酶的离心管中提取总RNA(具体方法参考说明书),用DNaseⅠ处理RNA以除去基因组DNA。

表1 本试验所需的引物汇总Table 1 Primers required for the experiment
注:表中下划线表示限制性内切酶位点。
Note: The underlines in the table indicate restriction endonuclease sites.
1.2.2 海岛棉GbTCP5基因的克隆及表达特性 根据海岛棉TCP家族的分类,得知GbTCP5基因的登录号为Gbscaffold9879.8.0,于美国华盛顿州立大学棉花基因数据库(https://www.cottongen.org/)中海岛棉全基因组数据库进行比对,获得1个cDNA序列。根据获得的海岛棉GbTCP5 基因的cDNA序列设计引物,用引物GbTCP5-F 和GbTCP5-R 扩增GbTCP5 基因的ORF。
根据GbTCP5基因的cDNA序列设计引物GbTCP5-qF和GbTCP5-qR,以GbUBQ7为内参基因,扩增引物为GbUBQ7-F和GbUBQ7-R(表1),利用实时荧光定量PCR,以不同时期的纤维组织,以及根、茎、叶、下胚轴、须根和开花当天的花瓣、花萼、托叶的反转录产物为模板,检测GbTCP5基因在不同组织和不同发育时期棉纤维中的表达情况。荧光定量PCR扩增体系:混合液2×TransStart Tip Green qPCR SuperMix 10 μL(全式金生物公司),校正液Passive Reference Dye(50×)0.4 μL(全式金生物公司),正反引物各0.4 μL,模板1 μL,ddH2O 7.8 μL。PCR扩增采用两步法,参考陈炜等[18]的方法并稍作改动:94℃预变性30 s;94℃变性5 s,60℃退火30 s,共40个循环。采用2-△△CT法[19]计算该基因在不同棉花组织和不同棉纤维时期的表达情况。试验进行3次生物学重复。
1.2.3 双链cDNA的合成 1)合成cDNA第一链。准备高质量的总RNA,在无菌的微量离心管中加入4.0 μL试剂(含2 μL高质量RNA样品、1.0 μL CDS Ⅲ引物和1 μL的ddH20)并混匀。将上述混合液置于72℃条件下孵育2 min,然后在冰上冷却2 min,14 000×g短暂离心10 s;取9.0 μL反应混合物(含2.0 μL 5×First-Strand Buffer、1.0 μL 100 mmol·L-1DTT、1.0 μL 10 mmol·L-1dNTP Mix 和1.0 μL SMART MMLV Reverse Transcriptase,ddH2O补足至9.0 μL)与上步的混合液轻弹混匀,然后置于42℃条件下孵育10 min,再加入 1 μL SMARTIII引物混匀,继续42℃孵育1 h,于75℃反应10 min终止第一链的合成,冷却至室温,最后加入1 μL RNaseH (2个单位),于37℃条件下孵育20 min,完成cDNA第一链的合成(此时样品可立即进行下一步试验,也可冻存于-20℃冰箱)。
2)准备LD-PCR,扩增双链cDNA。配置以下混合物:2 μL第一链 First-Strand cDNA、70 μL Deionized H2O、10 μL 10× Advantage 2 PCR Buffer、2 μL 50× dNTP Mix、2 μL 5′PCR Primer、2 μL 3′PCR Primer、10 μL 10× Melting Solution及2 μL 50× Advantage 2 Polymerase Mix,ddH2O补足至100 μL。
反应程序:95℃预变性30 s;95℃变性10 s,65℃退火6 min(每个循环+5 s),25个循环;68℃延伸5 min。将5 μL PCR产物点样,在120 Ⅴ/100 mA条件下于1×TAE缓冲液中进行电泳,用1%琼脂糖凝胶电泳分析质量。剩余95 μL cDNA样品使用一个CHROMA SPIN TE-400纯化柱进行纯化回收,加入20 μL去离子水溶解后,用1%琼脂糖凝胶电泳检测。
1.2.4 均一化cDNA文库的构建 构建均一化文库:采用Evrogen公司(俄罗斯)的DSN酶对ds-cDNA进行均一化处理(具体方法参照说明书),将均一化的ds-cDNA与pGADT7-Rec线性质粒共转入酵母菌株Y187感受态细胞中,参照文库构建试剂盒(Yeast makerTMYeast Transformation System 2) (Clontech公司,大连)操作说明,按照每板150 μL的量将得到的菌液涂布于100 mm SD/-Leu固体培养基。预计涂布100个平板,置于恒温培养箱中倒置培养3~5 d,待酵母菌落长到2~3 mm时,向每个平板加入5 mL预冷的含25%甘油的YPDA培养基,均匀铺平,室温静置1 min,然后使用刮铲将转化子收集到一个灭菌的500 mL三角瓶中。
均一化文库的滴定检测:取10 μL文库菌液,分别稀释10倍、100倍、1 000倍、10 000倍,然后涂布于SD/-Leu平板,置于恒温培养箱中倒置培养3~5 d,观察酵母的生长状况。分别统计平板上的菌落个数,计算酵母双杂交cDNA文库的文库容量和浓度。
1.2.5 诱饵载体pGBKT7-GbTC5的构建 根据酵母诱饵表达载体pGBKT7的限制性内切酶位点,再结合GbTCP5基因序列酶切位点特性,选取NcoⅠ、EcoRI作为两者的限制性内切酶位点,在基因的ORF两端设计特异引物,通过PCR获得目的片段。将酶切回收后的PCR产物和质粒pGBKT7片段按照1∶3的比例进行混合,22℃连接10 min,构建酵母转录激活载体pGBKT7-GbTC5。
1.2.6 pGBKT7-GbTC5毒性及自激活检测和酵母转化 自激活检测:以pGBKT7为阴性对照载体,将诱饵质粒(pGBKT7-GbTCP5)和对照质粒(空载体pGBKT7)分别转化酵母感受态细胞后涂布于一缺培养基上,培养2~3 d后长出菌落,挑取单菌落于无菌水中,然后取10 μL用无菌水稀释的单菌涂布于三缺培养基,倒置放于30℃恒温培养箱中继续培养2~3 d,观察单菌的生长情况。
毒性检测:从SD/Trp培养基上挑取单克隆在液体SD/Trp培养基中培养24 h,每间隔5 h测定一次菌液OD600值,观察两者在20 h后的OD600值。若两者OD600的值都大于1,说明诱饵表达载体对酵母细胞无毒性,反之则有毒性。
共转化酵母感受态细胞:将以上鉴定的含有诱饵载体的Y2H Gold菌株与文库菌株Y187进行杂交,用SD/-Leu/-Trp/-His/-Ade四缺培养基筛选,具体步骤:从转化后的SD/-Trp平板上挑取一个直径为2~3 mm酵母菌落,接到50 mL SD/-Trp液体培养基中,然后于30℃条件下250~270 r·min-1振荡培养至OD600达到0.8(培养时间约16~20 h)后,离心收集细胞,弃去上清液,再用4~5 mL SD/-Trp重悬细胞,使细胞密度大于1×108个·mL-1。室温水浴解冻一管文库菌株,将1 mL文库菌和4~5 mL诱饵菌(目的基因的酵母载体)共同加入2 L无菌三角瓶中,然后加入45 mL含50 μg·mL-1Kan+的2×YPDA液体培养基,在30℃条件下慢速(30~50 r·min-1)振荡培养20~24 h。培养20 h后,取5 μL培养物,用40×显微镜观察。如果出现杂合体,停止培养,如果没有,继续培养4 h。离心收集杂交培养的细胞,用10 mL 0.5×YPDA/Kan+液体培养基重悬沉淀细胞,估算重悬液的总体积,然后分别取100 μL经10倍、100倍、1 000倍和10 000倍稀释的杂交培养产物涂布于100 mm的SD/-Trp、SD/-Leu和SD/-Leu/-Trp(DDO)固体培养基上,将剩余的培养物按每个DDO/X/A平板涂布150 μL,共涂布55~60个平板,30℃培养3~5 d,筛选蓝色阳性克隆。
1.2.7 酵母质粒的提取与回转验证 用酵母DNA提取试剂盒(Clontech公司,大连)提取阳性克隆质粒后转化大肠杆菌感受态细胞,然后提取质粒与pGBKT7-GbTCP5共转化酵母菌AH109,涂布于SD/-Leu/-Trp/-His/-Ade+X-a-gal平板上,30℃培养3~5 d观察其生长情况。对回转验证成功的阳性克隆进行测序,将测序结果在NCBI 上进行BLAST 分析,寻找同源序列。
2 结果与分析
2.1 海岛棉不同发育时期的纤维总RNA
8个时期的纤维RNA,在A260/280的峰值均在1.8~2.1之间,属于高质量的RNA。为进一步检查不同时期的纤维RNA质量,将提取的不同时期的RNA置于0.1%琼脂糖胶上,经电泳检测(图1),条带清晰,无降解,符合后续建库试验要求。

注:M:Maker 2 000 bp;1~8分别表示开花当天(0 d)的胚珠及开花后5、10、15、20、25、30、35 d的纤维RNA。Note: M: Maker 2 000 bp. 1-8 represent the ovules of 0 day of flowering (0 d) and the fibrillar RNA at 5, 10, 15, 20, 25, 30 and 35 days, respectively.图1 海岛棉纤维不同发育时期的RNA电泳图Fig.1 RNA electrophoresis map of Gossypium barbadense fiber at different developmental stages
2.2 海岛棉GbTCP5基因的克隆与表达分析
以新海21号开花5 d棉花纤维cDNA为模板,根据海岛棉基因组数据库信息,设计引物GbTCP5-F和GbTCP5-R,用PCR方法获得目的片段。GbTCP5基因编码区长1 392 bp(图2)。借助实时荧光定量PCR方法分析GbTCP5基因在棉花不同纤维时期以及不同营养器官和生殖器官中的表达情况。由图3可知,GbTCP5基因在海岛棉纤维发育起始期和伸长期(0~ 5 d)的表达量较高,而在海岛棉纤维初生壁向次生壁转化的时期(5~ 20 d)表达量呈现降低趋势,推测该基因可能在纤维发育的起始期(0~ 5 d)发挥着功能。此外,GbTCP5基因在次生壁增后期(20~25 d)和脱水成熟期(30~35 d)表达量呈现上升趋势,猜测GbTCP5基因可能与加速植株成熟或者激素代谢存在着联系。
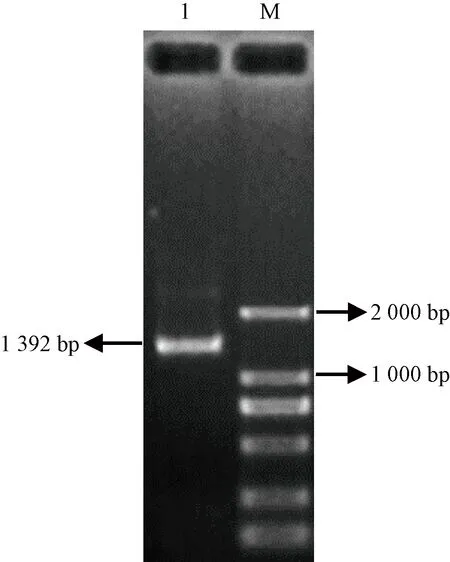
Note:M: Marker 2 000 bp. 1: GbTCP5.图2 海岛棉GbTCP5基因PCR产物电泳分析Fig.2 Electrophoresis of PCR product of GbTCP5gene in Gossypium barbadense

图3 海岛棉纤维不同发育时期中GbTCP5的表达分析Fig.3 GbTCP5 expression analysis in fibers of Gossypium barbadense at different developmental stages
由图4可知,GbTCP5基因在海岛棉生殖器官中的表达量高于营养器官,其中在花萼中的表达量最高,其次是花瓣。此外,GbTCP5基因在棉花幼苗须根中的表达量高于主根,这可能是须根上的根毛相对主根较发达所致。
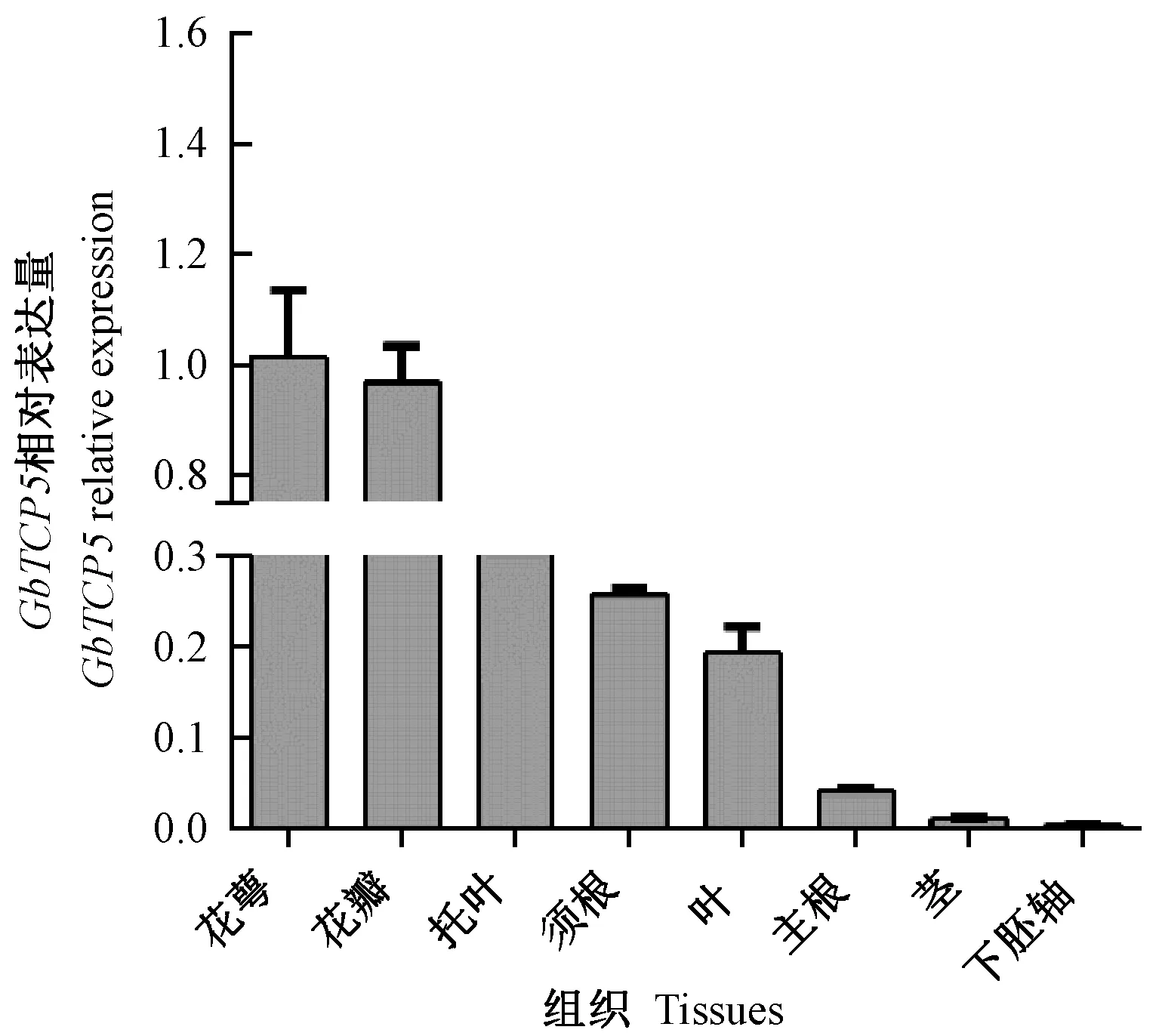
图4 海岛棉不同组织中GbTCP5基因的表达分析Fig.4 GbTCP5 expression analysis at of Gossypium barbadense different tissues
2.3 均一化cDNA的效果检测
DSN酶能够选择性地降解ds-cDNA和DNA-RNA杂交体中的DNA,因此在构建酵母cDNA文库时,要先对DSN酶活性进行检测。由图5可知,泳道4添加DSN后,能够有效地降解高丰度的DNA,表明DSN酶具有活性,后期能达到均一化效果。

注:1:Marker 15 000+2 000 bp; 2:不添加加DSN酶; 3:添加失活DSN酶;4:添加活性DSN酶。Note: 1: Maker 15 000+2 000 bp. 2: No addition of DSN enzyme. 3: Addition of inactivated DSN enzyme.4: Addition of active DSN enzyme.图5 DSN酶活检测Fig.5 DSN enzyme activity test
在反转录酶的作用下合成cDNA第一链,通过长距离PCR合成双链cDNA并进行纯化,结果见图6。泳道1~2的ds-cDNA经过DSN均一化处理后,电泳呈现一条均匀弥散的条带,长度分布在500~1 000 bp之间,说明泳道1~2的cDNA在未均一化之前的亮带已经消失,同时也说明均一化后高丰度的cDNA含量下降,使原本丰度较低的cDNA相对含量得到增加,证明均一化质量良好,可用于均一化文库的构建。
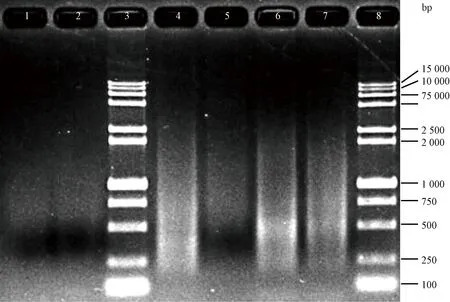
注:1、2是经过DSN均一化处理后,再经CHROMA SPIN+TE-400纯化柱分选后的ds-cDNA;3、8是15 000 bp的Maker;4是未经均一化处理的PCR产物;5是未经均一化处理但经过CHROMA SPIN+TE-400纯化柱分选后的ds-cDNA;6、7是经过DSN酶均一化处理后的PCR产物。Note: 1 and 2 are ds-cDNA after sorting by CHROMA SPIN+TE-400 purification column after DSN homogenization. 3 and 8 are 15 000 Maker. 4 is a PCR product that has not been homogenized. 5 is a ds-cDNA which has not been homogenized but has been sorted by CHROMA SPIN+TE-400 purification column. 6 and 7 are PCR products after homogenization by DSN enzyme.图6 均一化cDNA文库的ds-cDNA凝胶电泳图Fig.6 Ds-cDNA gel electrophoresis map of homogenized cDNA library
2.4 均一化cDNA文库的构建
将均一化的ds-cDNA与线性质粒pGADT7-Rec共转入酵母菌株Y187感受态细胞中,将所得杂交培养产物进行10倍、100倍、1 000倍和10 000倍、100 000倍稀释后,涂布于直径为100 mm的SD/-Leu培养基上,30℃倒置培养3 d,统计转化效率,结果见图7。稀释10倍和稀释100倍的SD/-Leu培养基上生长的单克隆较多,无法统计;稀释10 000倍的平板长出61个单克隆。均一化cDNA文库的滴度为9.1×107cfu·mL-1,符合标准(>2×107cfu·mL-1),库容量为9.15×107cfu·mL-1,符合建库库容标准(>1×106cfu·mL-1),构建的文库所得到的单克隆数目大于107cfu·mL-1,满足酵母双杂文库的要求,可用于后期的蛋白互作筛选。随机从一个平板中挑取34个单克隆以通用引物通过PCR验证插入片段大小(图8),验证结果表明,文库重组率约为100%,插入片段的大小为500~2 000 bp,平均值为750 bp。

注:A:文库酵母菌原液;B~F分别表示稀释10倍、100倍、1000倍、10 000倍、100 000倍的文库酵母菌。Note: A: Library yeast stock solution. B~F: Representative of the library yeast diluted 10 times, 100 times, 1 000 times, 10 000 times and 100 000 times, respectively.图7 不同稀释度文库的滴度检测Fig.7 Titer detection of different dilution libraries

注:M: Marker 2 000 bp; 1~17 为插入片段PCR扩增。Note: M: Marker 2 000 bp. 1-17 indicate insert PCR amplification.图8 均一化cDNA文库插入片段大小检测Fig.8 Uniform cDNA library insert size detection
2.5 诱饵载体的构建
以GbTCP5的cDNA为模板,以带有NcoⅠ、EcoRI酶切位点引物扩增获得GbTCP5基因1 392 bp 片段。将此片段克隆入pGBKT7 载体,筛选阳性克隆,得到pGBKT7-GbTCP5诱饵质粒。诱饵质粒经NcoⅠ、EcoRI双酶切成8 692 bp 和1 392 bp两个片段,片段大小与预计相符(图9)。测序分析结果显示,阅读框无误,表明诱饵质粒构建成功。
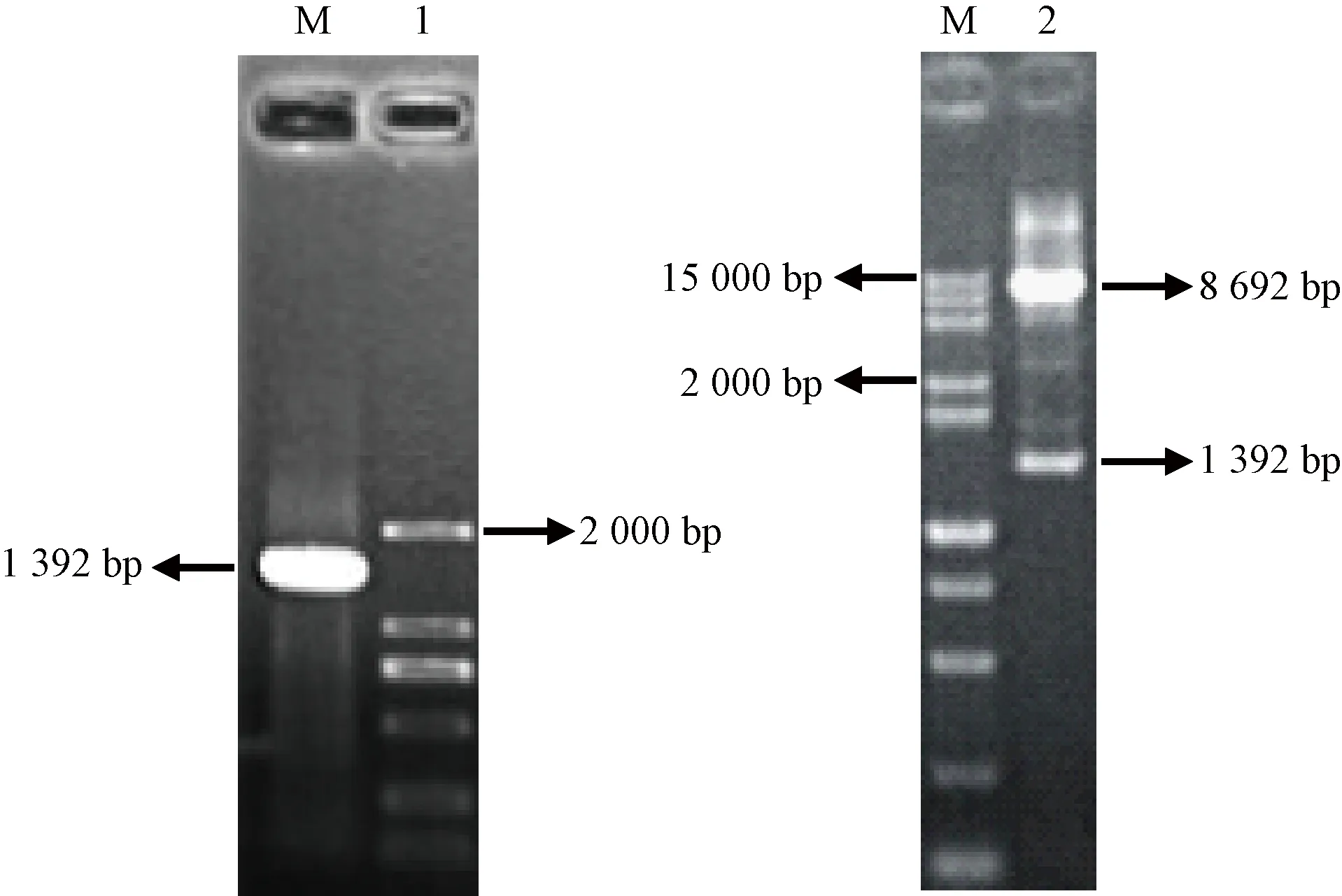
注:M:Marker;1:pGBKT7-GbTCP5菌液PCR;2:pGBKT7-GbTCP5质粒DNA双酶切。Note: M: Marker. 1: pGBKT7-GbTCP5 bacterial solution PCR. 2: pGBKT7-GbTCP5 plasmid DNA double digestion.图9 酵母表达载体pGBKT7-GbTCP5的 PCR产物及双酶切产物的电泳分析Fig.9 Electrophoresis analysis of PCR Product and double digested products of yeast expression vector pGBKT7-GbTCP5
2.6 重组载体pGBKT7-GbTC5毒性及自激活检测
为了检测重组质粒pGBKT7-GbTCP5是否存在自激活活性,将pGBKT7-GbTCP5转入酵母感受态细胞中,分别涂布于SD/-Trp和SD/-Trp/-Ade/-His平板上培养3~5 d(图10),结果显示,空载和目的载体在一缺培养基SD/-Trp上能长出酵母菌落,说明载体成功转入酵母细胞。紧接着将SD/-Trp培养基上生长的菌落转移到三缺培养基SD/-Trp/-Ade/-His+X-gal平板上,发现除了阳性对照能生长变蓝,其余均无菌落长出(图11),表明重组质粒pGBKT7-GbTCP5转入酵母感受态细胞中没有自我激活活性。

图10 酵母表达载体pGBKT7-GbTCP5与空载pGBKT7在SD/-Trp的生长情况Fig.10 Growth of yeast expression vector pGBKT7-GbTCP5 and empty pGBKT7 in SD/-Trp

图11 酵母表达载体pGBKT7-GbTCP5的转录激活检测Fig.11 Detection of transcriptional activation of yeast expression vector pGBKT7-GbTCP5
酵母试验表明,GbTCP5基因无自激活活性,但不能确定是否对共生体有毒性。因此,针对pGBKT7-GbTCP5菌株的毒性做了进一步检测,发现诱饵质粒酵母菌株和空质粒pGBKT7的AH109酵母菌株在液体培养基中培养到24 h后,二者的OD600值分别为2.466和2.306,差异不显著(P>0.05,图12),说明重组诱饵载体对酵母菌的生长无毒害作用。

图12 酵母表达载体pGBKT7-GbTCP5的毒性检测Fig.12 Toxicity detection of yeast expression vector pGBKT7-GbTCP5
将构建的文库菌和诱饵菌共同加入到一个2 L无菌三角瓶中,加入45 mL含50 μg·mL-1Kan+的2×YPDA液体培养基,置于30℃摇床50 r·min-1培养20 h后,通过细胞计数板统计,酵母双杂共培养液中酵母细胞密度达到7.9×109,已经达到酵母单细胞密度(>109)。取少量细胞在40倍显微镜下镜检,酵母杂交出现经典的三叶草形状(图13)。停止培养,取出菌液,在超净台中将菌液按每个DDO/X/A平板涂布150 μL,共涂布55~60个平板,30℃培养3 d。根据文库菌液能在SD/-Leu缺陷培养基上生长,诱饵载体能在SD/-Trp培养基上生长,而二者的融合体能在SD/-Trp/-Leu生长的特点,分别统计3种培养基上的细胞个数,计算得出酵母杂交率为3.8%。

注:A:酵母双杂交的经典三叶草型结构图;B:稀释100倍后的酵母双杂共培养液中的细胞。Note: A: Classical clover-type structure diagram of yeast two-hybrid. B: Cells in yeast double-hybrid co-culture solution diluted 100-fold.图13 酵母双杂交细胞的镜检Fig.13 Microscopic examination of yeast two-hybrid cells
2.7 GbTCP5互作蛋白的筛选及回转验证
将诱饵载体pGBKT7-GbTCP5和文库菌杂交后,涂布于SD/-Trp/-Leu平板上观察其生长状况,随后将二缺平板上的酵母细胞转移到含有X-α-gal的SD/-Trp/-Leu/-His/-Ade营养缺陷型平板上,置于30℃培养箱中培养3 d左右,经过3次营养缺陷培养基的初步筛选,获得9个阳性克隆(图14-A)。此时提前制备好酵母的感受态细胞,将获得9个阳性克隆扩大培养后提取质粒DNA,再进行回转验证,最终只有4个阳性克隆(图14-B)。
通过对阳性克隆进行测序和序列比对分析发现,最终获得4个与GbTCP5相互作用的蛋白。其中,有3个基因是TCP转录因子,根据海岛棉中TCP转录因子命名规则[13],分别命名为GbTCP20、GbTCP42和GbTCP45,还有一个是GbAHP1基因。
TCP转录因子在植物体内主要通过协同作用和拮抗作用参与植物的各种生理活动,为进一步研究与GbTCP5互作的其余TCP蛋白之间的关系,根据测序结果分别设计GbTCP20、GbTCP42、GbTCP45基因的RT-qPCR引物,在棉花纤维中观察这3个TCP基因的表达特性(图15)。结果表明,GbTCP20和GbTCP45与互作的GbTCP5基因有着相同的表达趋势,说明这2个TCP基因与GbTCP5之间通过协同作用参与纤维的发育。而GbTCP42基因与GbTCP5的表达趋势相反,二者可能以拮抗作用的形式参与纤维发育。通过表达模式仅初步探究了它们之间的作用模式,而其中的作用机理还需进一步研究。

图15 海岛棉纤维不同发育时期的GbTCP基因的表达分析Fig.15 GbTCP expression analysis in fibers of Gossypium barbadense at different developmental stages
3 讨论
研究表明,TCP家族之间可能存在许多蛋白-蛋白相互作用,并且这些TCP优先选择与本类的TCP结合[20],即Ⅰ类TCP优选与Ⅰ类TCP互作,Ⅱ类TCP优选与Ⅱ类TCP互作[21]。例如在拟南芥中AtTCP14和AtTCP15通过相互作用影响植株的节间长度和叶形[22]。此外,在植物中TCP蛋白常与其他蛋白以互作的形式参与植物的生长发育,例如在拟南芥中AS2与AtTCP3通过互作参与调控叶片的发育[23]。本试验进一步验证了该结论,在海岛棉纤维中与GbTCP5互作的蛋白多数是TCP家族蛋白,这也说明在海岛棉纤维发育期间,并不是单一的TCP转录因子在发挥作用,很可能是同一家族的多个转录因子之间相互协调参与调控纤维的发育。本试验成功构建得到的文库滴度为9.15×107cfu·mL-1,达到了文库筛选要求,从文库的鉴定结果来看,此次构建的文库重组率为100%,插入片段大小在500~2 000 bp之间,使用诱饵表达载体筛选到4个候选的互作蛋白,说明文库构建成功,这为进一步研究TCP家族在棉花纤维发育中的分子机制奠定了基础。
TCP也是目前植物中仅存的一类具有特异性的转录因子家族。作为一类古老的转录因子蛋白,TCP蛋白广泛存在于多细胞的藻类植物和苔藓类植物中[24],但在这些物种中,TCP家族只有几个成员。在裸子植物和被子植物中,由于基因的复制和进化,TCP家族成员的个数也在增加[25-27]。目前,已在拟南芥[28]、水稻[29]、杨树[30]、番茄[31]、西瓜[32]、意大利红门兰[33]、高粱[34]、雷蒙德氏棉[35]、亚洲棉[36]、陆地棉[37]、鹰嘴豆[38]及桃树[39]等植物中鉴定到20个以上的TCP成员。本研究中,海岛棉中有75个TCP成员[13],已知TCP基因参与棉花纤维的发育,并且在纤维发育期间有着不同的表达特性,但其相关功能及作用机制尚不清楚。
在研究TCP转录因子结合位点时,发现ClassⅠ和ClassⅡ类TCP基因有共同的结合位点序列,且不互相排斥,这说明在植物中至少有一类潜在的基因被Ⅰ和Ⅱ类TCP基因靶向。既然有协同作用,那么也可能存在拮抗关系。进一步研究发现,拟南芥Ⅰ类TCP转录因子AtTCP20和Ⅱ类AtTCP4基因与LOX2基因的启动子结合后,在转基因拟南芥叶片发育的初期中发现AtTCP4与AtTCP20的表达相反,其中LOX2基因的表达量在叶片发育的4~14 d持续增加,说明LOX2受AtTCP4的直接拮抗调控[40]。例如拟南芥AtTCP15与AtTCP20之间以功能冗杂的形式共同调节叶片的衰老过程[41]。
研究表明,TCP蛋白在植物的生长发育过程中发挥着拮抗和协同作用,这些生理过程中转录因子与TCP互作的蛋白质目前尚不清楚,因此借助酵母双杂技术,在海岛棉纤维中筛选转录因子的互作蛋白显得非常重要。本试验成功构建了纤维发育期间的均一化酵母双杂交文库,筛选到了与TCP5互作的蛋白,进一步证明该系统在研究棉花纤维发育期间蛋白互作筛选候选蛋白方面具有重要意义。后续研究将对筛选的蛋白逐一进行验证,通过互作蛋白来研究GbTCP5基因参与棉花纤维发育的调控机制。
棉花纤维的生长发育过程决定了成熟纤维的产量和品质。近几年,针对棉纤维发育的相关研究备受关注,但截至目前,控制纤维发育的关键基因和调控机理仍不清楚。因此发现和验证这些参与纤维发育过程中的蛋白质,是研究棉花纤维发育的重要一步,这对今后开展棉花纤维发育的分子机制研究具有重要的理论意义和应用价值。
4 结论
本研究构建了海岛棉不同发育时期的纤维均一化酵母双杂交文库,通过酵母双杂交技术筛选到4个与GbTCP5互作的蛋白,其中3个蛋白属于TCP家族,另外1个是作为细胞分裂素信号转导中的重要组成部分的GbAHP1基因。从这些基因在纤维中的表达特性来看,都参与棉花纤维的早期发育,可能在胚珠表皮细胞分化时发挥着重要作用。这对为今后开展海岛棉GbTCP5基因参与棉花纤维发育的分子调控机制研究奠定了基础。

