培养温度、水分活度对稻谷和大米黄曲霉生长及产毒的影响
吕 聪 王 平 常 鹏 靳 婧 刘 阳,*马龙雪 杨庆利 邢福国,*
(1中国农业科学院农产品加工研究所/农业农村部农产品质量安全收贮及管控重点实验室,北京 100193;2青岛农业大学食品科学与工程学院,山东 青岛 266108)
DOI:10.11869/j.issn.100-8551.2019.10.2033
稻谷是人类主要食用的粮食作物,全世界有超过半数的人口以其为主食,在我国粮食产业中占据重要地位,因此保障稻谷安全至关重要[1-2]。稻谷在储藏和加工过程中受贮藏温度、水分、氧气和虫霉等因素的影响,容易被霉菌污染[3]。2016年,中储粮成都粮食储藏科学研究所测定我国14个省农户储藏稻谷样品的黄曲霉毒素B1(aflatoxin B1,AFB1)含量,发现四川、贵州、云南、广西和江苏5省稻谷中AFB1检出率超过20%[4];2011年广西省抽样调查34批市售大米,其中有3批检测出(阳性)AFB1,检出率为8.8%,AFB1污染量均为1 μg·kg-1[5];2013年深圳福田区疾病预防控制中心抽样检测51份深圳地区市售大米的AFB1含量,检出率为33.3%[6]。由此可见,我国稻米黄曲霉毒素污染现象普遍,对人体健康构成了严重威胁。
黄曲霉毒素(aflatoxin,AFT)是由黄曲霉(Aspergillusflavus)和寄生曲霉(Aspergillusparasiticus)等产生的具有强毒性和致癌性的衍生化合物[7-8]。黄曲霉产生的强致癌性代谢产物AFT可以通过食物进入人和动物体内,对人畜健康造成巨大威胁[9-10]。黄曲霉可以产生多种毒素(B1、B2、G1、G2),其中危害性最强和致癌性最高的是AFB1。研究发现人体过量摄入AFB1后会诱发肝癌[11]。
在储藏过程中,AFT污染稻谷和大米程度主要受温度和湿度的影响。Ayerst[12]和Magan等[13]研究粮食储藏过程中温度和湿度对真菌生长的影响发现,不同的真菌孢子在粮食上萌发时所需的最低相对湿度略有不同。Cotty等[14]研究发现,在高温度和低湿度环境下,玉米上容易生长黄曲霉菌。岳晓禹等[15]研究粮食贮藏条件发现,当水分活度高于0.90时,黄曲霉生长较快,水分活度低于0.90时,黄曲霉生长延缓。实际上在较高的湿度条件下,稻米容易发生霉变,但此时霉菌尚处于菌丝早期生长阶段,带菌量的增加并不明显[16]。因此,本试验探究不同温度和不同水分活度(water activity,aw)下稻米受黄曲霉侵染及AFB1污染的相关情况,以期揭示稻米中AFB1污染的主要影响因素及相关机理,为科学制定稻米黄曲霉毒素污染的防控策略和方法提供数据支撑。
1 材料与方法
1.1 样品的采集与试剂
试验样品采用2017年收获的湖南黄华占稻谷和黑龙江五常稻花香大米,在当地进行常规包装后运输到实验室进行黄曲霉分离及AFB1含量的检测。每种样品采集100 kg。
培养基购自青岛海博生物技术有限公司;甲醇(分析纯)购自北京化工厂;甲醇(色谱纯)购自美国Fisher公司;AFB1黄曲霉毒素免疫亲和柱购自北京华安麦科公司;AFB1标准品购自美国Sigma 公司;Gotaq PCR Master Mix购自美国Promega公司;TaKaRa RNA PCR Kit Ver.3.0购自宝生物工程(大连)有限公司。
1.2 主要仪器与设备
Genius 3型涡旋振荡器,德国IKA公司; SZ2-1LST型电子显微镜,日本Olympus公司;T100型PCR仪,美国Bio-Rad公司;Aqualab 4TE水分活度测定仪,美国Decagon Devices公司;Moisture Analyzer MJ33水分测定仪,瑞士Mettler Toledo公司;实时荧光定量PCR仪,美国ABI公司。
1.3 试验方法
1.3.1 黄曲霉菌株活化及孢子液的制备 将农业农村部重点实验室刘阳实验室保存的黄曲霉菌株YC-15接种到DG18培养基上,在28℃培养箱中恒温培养7 d进行活化,随后用灭菌的50 mL 0.1%吐温80制成浓度为1×106的均匀孢子液,备用。
1.3.2 水分活度(aw)的调节 按照Abdel-Hadi等[17]的方法调节稻谷和大米aw:在稻谷和大米中添加不同量的水,于4℃冰箱中平衡过夜,使其水分活度达到目标要求(0.85、0.90、0.96、0.99),然后利用水分测定仪测定稻米水分含量,并采用水分活度测定仪测定稻米aw。
1.3.3 黄曲霉侵染稻米试验 将2 mL孢子浓度为1×106的黄曲霉孢子液接种至装有经紫外杀菌后的200 g目标aw稻米样品的三角瓶中。每组试验设置3个平行,封口后震荡、摇匀。然后分别置于不同温度(20、25、28、33、37、42℃)的恒温恒湿培养箱中培养7 d。
1.3.4 带菌量的检测 经7 d培养后,在生物安全柜中准确称量10 g稻谷和10 g大米样品,置于3% NaClO 溶液中清洗30 s,再用无菌水清洗2次,最后加入10 mL无菌水,得到1 g·mL-1的稻米样品菌悬液。然后依次梯度稀释,制成1∶10样品稀释液[18]。取100 μL各稀释度的样品菌悬液涂布于DG18平板[19],并置于28℃培养箱中恒温培养7 d,通过菌落计数分析样品的带菌数量。
1.3.5 AFB1含量的检测 将培养7 d后的稻谷和大米用高压灭菌锅灭菌30 min,磨粉后分别称取20 g研磨样品于150 mL三角瓶中,加入100 mL(70∶30,v∶v)甲醇/水萃取溶液[20],然后高速振荡1 h后静置30 min,收集滤液。按照1∶2的比例加入蒸馏水稀释滤液,然后取15 mL稀释后的滤液过柱,待滤液流干后用去离子水洗涤2次,每次10 mL,最后用1 mL色谱级甲醇洗脱,得到的洗脱液用0.22 μm微孔滤器过滤后转移至棕色进样瓶,备用。
HPLC检测条件:反向C18色谱柱(5 μm,4.6 mm×250 mm)、柱温30℃;流动相为甲醇/水(6∶4),流速为1 mL·min-1。荧光检测器为Waters2475型,激发波长360 nm、发射波长440 nm,进样量20 μL[21]。
1.3.6 实时荧光定量PCR分析试验 将培养7 d后的稻谷和大米上的黄曲霉菌丝剥离下来,液氮预冷后置于-70℃保存备用。总RNA的提取步骤按照RNeasy Plant Mini Kit说明书。将提取出的总RNA按照TaKaRa反转录试剂盒反应体系进行反转录,随后进行实时荧光定量PCR检测毒素合成相关基因的表达情况。
2 结果与分析
2.1 培养温度、水分活度对大米中黄曲霉生长及产毒的影响
由图1可知,高温(T≥42℃)几乎完全抑制了黄曲霉的生长和产毒,低温(T≤20℃)条件下大米上黄曲霉的生长和产毒也非常少,结果可将黄曲霉的最佳生长温度范围进一步缩小为28~37℃,且在20~42℃范围内黄曲霉的生长整体呈先上升后下降的趋势,其中黄曲霉最适生长温度为33℃。由图2可知,低温20℃条件下,水分活度(aw)为0.96时,黄曲霉的产毒量要高于aw为0.90时的产毒量;高温37℃条件下,aw为0.90时黄曲霉的产毒量高于aw为0.96时的产毒量。培养温度为42℃时,所有水分活度条件下的黄曲霉几乎不生长,且不适合毒素产生。综上,大米黄曲霉的最适生长和产毒的温度均为33℃。
不同大米水分活度(aw)对黄曲霉生长的影响差异较大(图1)。aw为0.90和0.96时,黄曲霉的生长要优于aw为0.85和0.99,且随着aw的增加,黄曲霉生长大体上呈先升高后降低的趋势,最佳生长aw为0.90。温度高于33℃条件下,aw为0.96时,黄曲霉生长量略低于aw为0.90时,但两者在25~37℃条件下都有较好的长势;当aw增加到0.99时,大米中黄曲霉生长量则大幅度下降。由图2可知,当aw为0.85时,黄曲霉产毒量较低,而aw为0.90~0.99时比较适宜黄曲霉产毒,其中最佳产毒aw为0.96。当aw从0.90升至0.96时,产毒量几乎均急剧上升,当aw从0.96增至0.99时,黄曲霉的产毒量下降;33℃下aw对大米中黄曲霉的生长和产毒影响最为显著,aw为0.90时,黄曲霉达到最大生长量,但其最佳产毒aw为0.96。综上,黄曲霉的最适生长aw为0.90,最佳产毒aw为0.96。
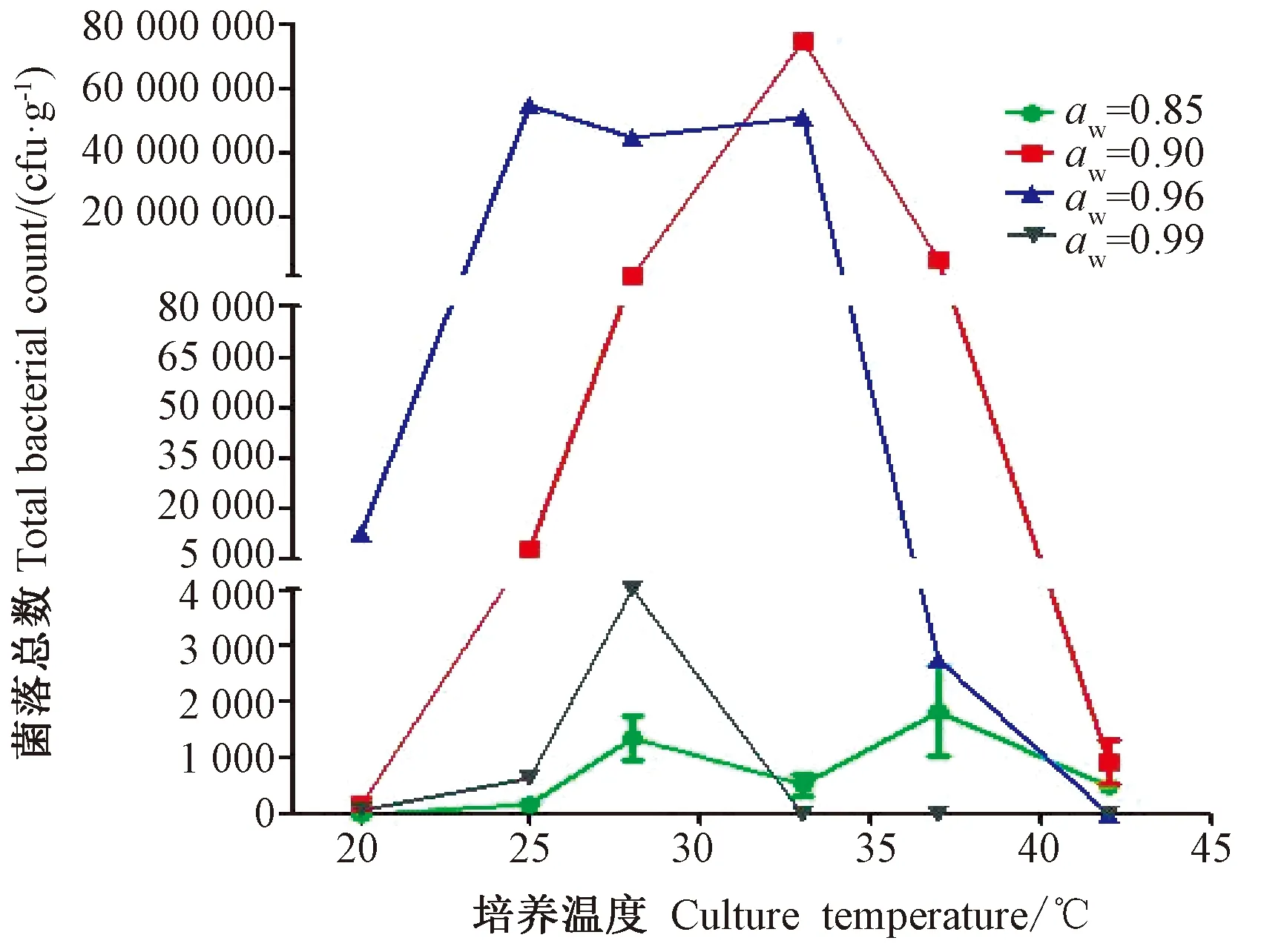
图1 培养温度、水分活度对大米中黄曲霉生长的影响Fig.1 Effect of culture temperature and water activity on the growth of A. flavus in rice
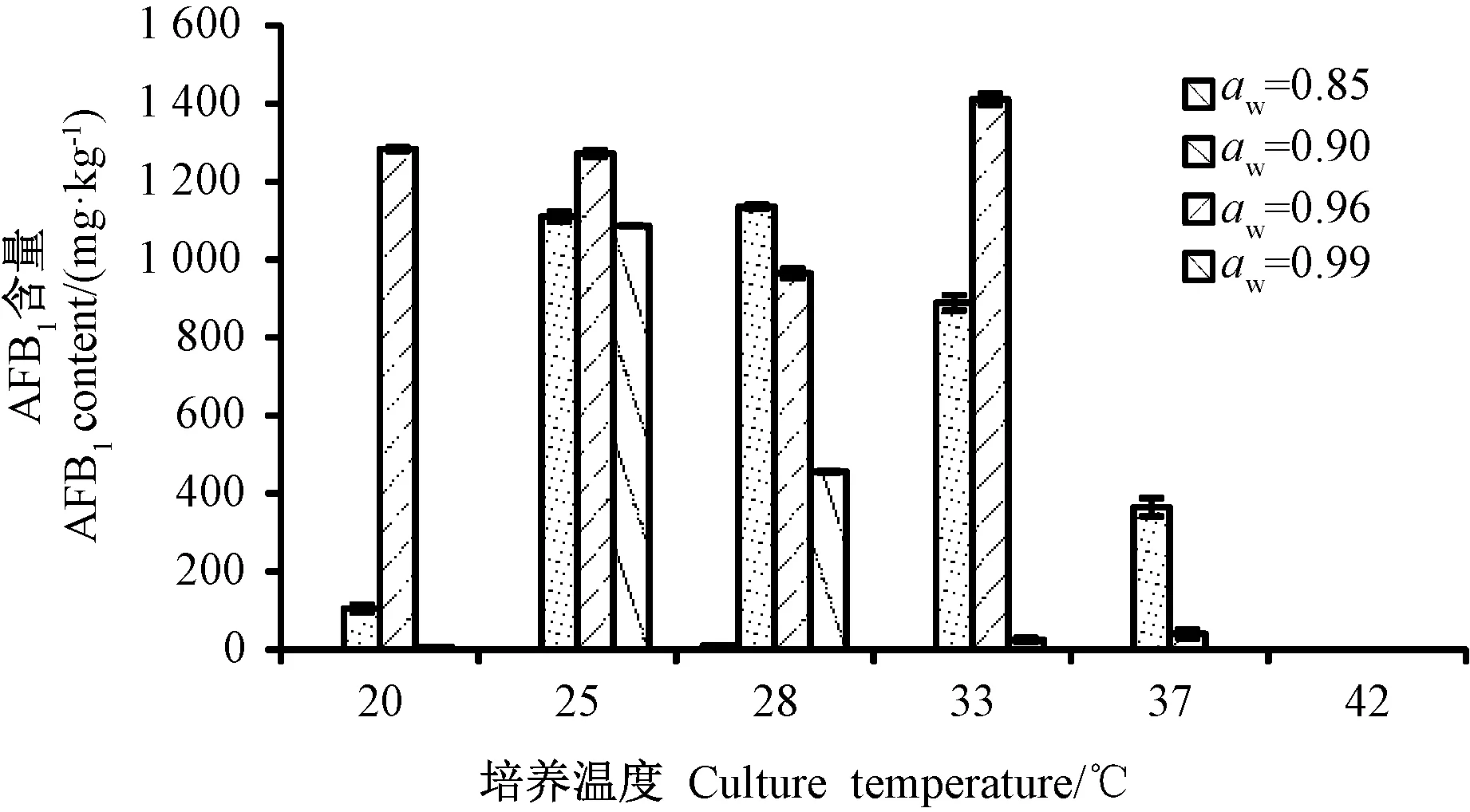
图2 培养温度、水分活度对大米中AFB1含量的影响Fig.2 Effect of culture temperature and water activity on the production of AFB1 in rice
2.2 培养温度、水分活度对稻谷中黄曲霉生长及产毒的影响
由图3可知,培养温度低于28℃时不适合黄曲霉的生长和产毒。培养温度为42℃时,aw在0.90~0.96范围内,黄曲霉可以生长,而其他过高或过低水分活度均不适合黄曲霉生长。稻谷上黄曲霉的适宜生长温度范围为28~40℃,其生长趋势为先上升后下降,其中最佳生长温度为37℃。由图4可知,培养温度为20~25℃时,各水分活度的稻谷中黄曲霉均不产毒,低温完全抑制了黄曲霉毒素的生物合成。但培养温度为25~37℃时,黄曲霉产毒量逐渐增加,其中最适产毒温度为37℃。培养温度为42℃时,各水分温度下黄曲霉几乎不产生毒素。
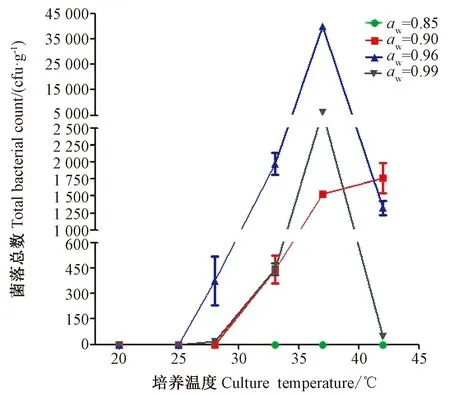
图3 培养温度、水分活度对稻谷中黄曲霉生长的影响Fig.3 Effect of culture temperature and water activity on the growth of A. flavus in paddy
由图3可知,aw为0.85时抑制了稻谷中黄曲霉的生长;培养温度为25~42℃,aw为0.90~0.99条件下,随着aw增大,黄曲霉的生长呈先升高后降低的趋势,并在aw为0.96生长最好,且aw为0.99的稻谷中黄曲霉生长情况优于aw为0.90的稻谷中的黄曲霉。由图4可知,aw为0.85时,几乎没有毒素产生,aw为0.90时产毒量达到最大,而后随着aw的增加,产毒量逐渐下降。对aw为0.99来说,在33℃时产毒最多,随后温度升高产毒降低。
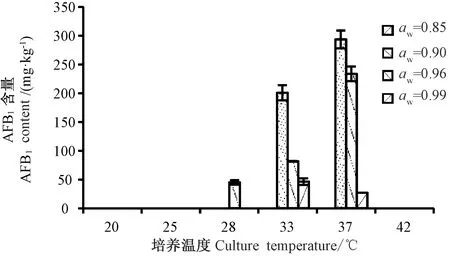
图4 培养温度、水分活度对稻谷中AFB1含量的影响Fig.4 Effect of culture temperature and water activity on the production of AFB1 in paddy
2.3 储藏温度对AFB1生物合成相关基因表达的影响
为了探究不同储藏温度(25、33、37℃)对AFB1生物合成相关基因表达的影响,选择大米最适产毒水分活度(aw)为0.96作为目标水分活度。由图5可知,以黄曲霉的最适产毒温度33℃为基准,低温25℃时的ABF1生物合成的大部分基因相对表达量显著上升(P< 0.05),其中aflG、aflE、aflH、aflJ、aflT基因相对表达量上调极显著(P<0.01);37℃下不同AFB1生物合成相关基因相对表达量较33℃时表现出较大差异,aflR、aflS、aflA、aflE、aflF、aflJ、aflL、aflG、aflH、afll基因相对表达量上调,其中aflE显著上调,而产孢基因abaA相对表达量显著下调,aflM、aflN、aflP、aflO、aflQ、aflU、aflX、laeA、brlA基因相对表达量也显著下调。温度低于25℃时,大多数的AFB1生物合成基因表达上调,但由于黄曲霉菌的生长量非常少,导致AFB1含量较低。综上所述,高温不利于黄曲霉产毒,主要可能是因为一些相关基因表达量下降,导致整个毒素的转录合成过程受阻。
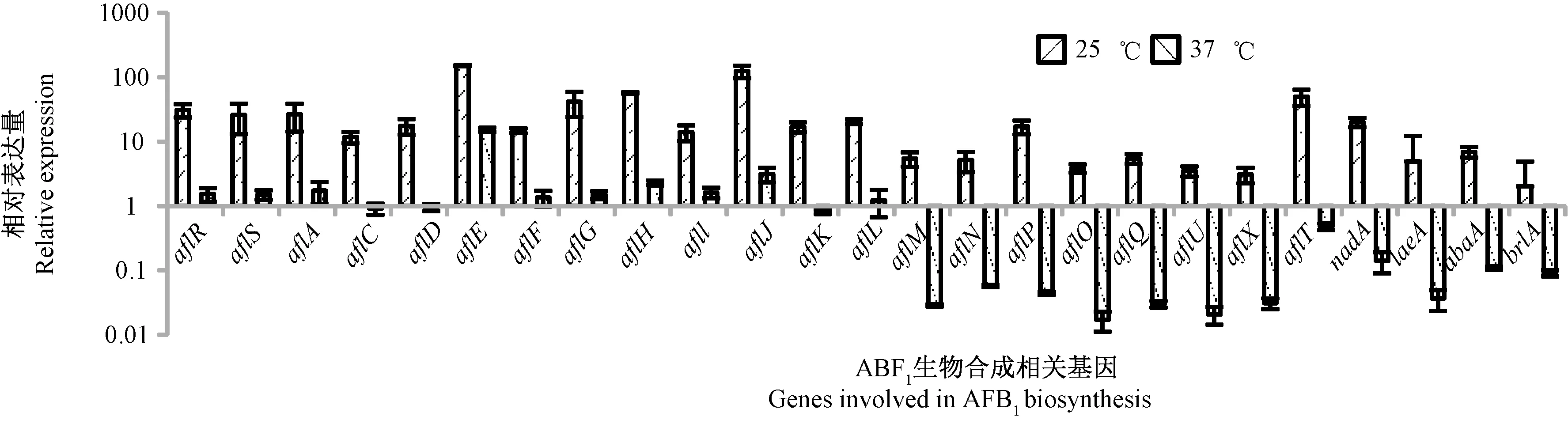
图5 储藏温度对ABF1生物合成相关基因表达量的影响Fig.5 Effect of storage temperature on gene expression of aflatoxin B1 biosynthesis
3 讨论
黄曲霉毒素的强毒性和强致癌性,对人们的生产生活产生了巨大的影响。国内外专家学者一直致力于揭示黄曲霉毒素产生的规律、黄曲霉及其毒素的防控、毒素产生后的去除和降解技术的研发。本研究结果表明,就稻谷和大米而言,低水分活度(aw=0.85)不适合黄曲霉的生长及产毒,当aw低于0.80时,黄曲霉的孢子基本停止萌发。路子显等[22]研究表明29~30℃是黄曲霉毒素合成的最适温度,温度过高黄曲霉毒素的合成会完全被抑制,而在低温下毒素的合成相对减少。Abdel-Hadi等[23]分析了不同aw(0.85、0.90、0.95、0.99)和不同温度(20~42℃)对YES培养基上黄曲霉生长及产毒的影响,发现黄曲霉在aw为0.85的YES培养基上的生长和产毒远落后于其他aw,随着aw的升高,黄曲霉的生长和产毒也呈上升趋势,并在aw为0.99时达到最适,此时黄曲霉生长最好,产毒最多,这与本试验结果类似,表明黄曲霉在低aw下的生长和产毒受到抑制,适当升高aw有利于毒素的产生。Gallo等[24]研究不同aw(0.90~0.99)和不同温度(20~37℃)下杏仁培养基中黄曲霉生长和产毒的情况,发现28℃下黄曲霉长势最好,明显优于20℃和37℃,黄曲霉的最佳生长及产毒条件是28℃、aw为0.96,与YES培养基中最佳产毒aw(0.99)不同,同时也与本试验中黄曲霉在稻谷和大米上的最佳生长及产毒的aw不同,说明不同培养基质对黄曲霉生长及产毒的影响存在差异,但导致这种差别的具体原因尚有待深入研究。Schmidt-Heydt等[25]通过探究不同温度和aw下YES培养基上黄曲霉毒素生物合成的变化规律,发现极端水分活度和温度条件不利于黄曲霉生长及产毒。Liu等[26]研究黄曲霉在不同aw的花生中产毒情况,发现随着aw的增大,AFB1含量呈先增加后减少的趋势,同时在不同温度范围内,最佳产毒aw也不同,当温度为20~33℃时,黄曲霉最佳产毒aw为0.96;温度为33~40℃时,黄曲霉最佳产毒aw降至0.92。本研究结果显示,就大米而言,温度33℃、aw为0.96是黄曲霉的最佳产毒条件;就稻谷而言,黄曲霉的最佳产毒条件为温度37℃、aw为0.90,与Liu等[26]的研究结果不同。
aw及温度等环境因子主要通过影响毒素合成相关基因的表达来影响真菌毒素的产生[27-29]。Schmidt-Heydt等[25]通过微阵列研究黄曲霉在不同温度和aw下毒素的生物合成,进而分析其相关基因的表达,结果与本试验类似,相较于高温37℃,33℃更能促进相关产毒基因的表达,表明相对于极端温度和水分活度,黄曲霉产毒关键基因更易在温和条件下表达。O′Brian 等[30]观察到aflR和aflS的差异表达与黄曲霉毒素生物合成相关,且在高温下即使调节基因高度表达,毒素的合成也较少。Yu等[31]对不同温度下的黄曲霉进行了转录组分析,发现大部分基因有差异表达,其中aflS在37℃仍有较高表达,但aflS/aflR的表达比例下降,从而导致产毒下降。刘肖[32]发现在37、42℃下黄曲霉毒素关键基因相对表达量相比28℃显著下降,但aflR、aflS、aflF、aflI、aflM、aflU、nadA基因在37℃的相对表达量上调,aflI、nadA基因在42℃的相对表达量上调;调控次级代谢的abaA基因相对表达量在37、42℃均上调,但生长发育基因brlA相对表达量只在37℃上调。本试验结果表明,温度和水分活度对大米中黄曲霉产毒基因的表达有着复杂的影响,低温25℃时黄曲霉毒素生物合成基因的表达量相对于33℃大部分均是显著上调的,表明低温激发基因表达,推测是因为黄曲霉菌的产菌量低,导致黄曲霉产毒减少;而高温37℃时,brlA、abaA、laeA基因相对表达量相比33℃时显著下调,laeA基因为次级代谢主要调控因子,brlA、abaA基因为生长发育调控因子,推测高温导致了重要结构基因的相对表达量降低,从而毒素的产生量降低。
4 结论
大米中黄曲霉的最适产毒条件是温度33℃、aw为0.96,aw低于0.85和低温20℃时黄曲霉基本不产毒,高温42℃下也不产毒;稻谷中黄曲霉的最适产毒条件是温度37℃、aw为0.90,aw低于0.85和温度低于25℃时黄曲霉基本不产毒,高温(42℃)和高aw(0.99)时黄曲霉也不产毒。低温25℃可以促进黄曲霉产毒基因表达,但因黄曲霉菌产菌量低而导致毒素含量低,高温37℃则抑制黄曲霉次级代谢调控基因及部分结构基因的表达,从而阻抑毒素的生成。因此,稻米在储藏过程中应遵循保持干燥、低温的原则,可极大地减轻毒素的污染情况,同时降低黄曲霉毒素生物合成基因的表达,从而有效降低毒素的产生,这对减少我国因霉变而造成的粮食浪费具有重要意义。

