不同变种甜瓜糖分积累及蔗糖代谢酶活性动态变化
叶红霞 吕 律 王同林 海 睿 汪炳良
(浙江大学蔬菜研究所/浙江省园艺植物整合生物学研究与应用重点实验室,浙江 杭州 310029)
甜瓜(CucumismeloL.)为葫芦科黄瓜属一年生蔓性草本植物,也是一种水果型蔬菜,享有“甜于诸瓜,独得甘甜”的美誉[1],被视为果品中的珍品。世界各地均有甜瓜栽培,目前我国的甜瓜栽培面积与总产量均居世界首位[2]。甜瓜类型丰富、品种繁多,不同类型(种群、变种)的甜瓜品种不仅在形态特征、生长发育上具有较大差异,且在品质特性上也具有多样性,表现为口感、风味和甜度均不相同[3]。随着农业种植结构的调整,甜瓜种植面积日益加大,消费者对甜瓜产量和营养品质的要求亦日益提高,且对品质的要求更趋向于个性化,因此提高甜瓜的产量和品质具有重要意义[4]。
在果实外观、可溶性固形物含量、果肉质地等影响甜瓜品质的诸多因素中,糖类物质的组成及其含量是最重要的一类品质指标[5]。果糖、葡萄糖和蔗糖是甜瓜果实中主要的可溶性糖,其中果糖的甜度最高,但葡萄糖风味最好[6]。诸多研究者对甜瓜果实发育过程中糖类物质的积累进行了研究[7-11]。不同类型(基因型)甜瓜的糖分积累规律存在较大差异,即多数甜瓜品种(甜型)果实在发育过程中会出现蔗糖快速积累的转折点,但也有部分甜瓜品种(非甜型)果实在整个发育过程中蔗糖积累始终维持在较低水平[12-17]。
研究表明,蔗糖合成酶(sucrose synthase,EC2.4.1.13,SS)、蔗糖磷酸合成酶(sucrose phosphate synthase,EC2.4.1.14,SPS)和转化酶(invertase,EC3.2.1.26, Ivr)是蔗糖代谢的关键酶,其中转化酶包括酸性转化酶(acid invertase,AI)和中性转化酶(neutral invertase,NI)[18]。甜瓜果实在这些酶的共同作用下实现了葡萄糖、果糖,特别是蔗糖的积累[19-21]。通常不同甜瓜品种含糖量的高低主要取决于果实发育后期SPS活性的提高程度和AI活性的下降幅度;SS对于甜瓜糖的积累作用不显著,其原因是甜瓜果实整个发育过程中SS无论是合成方向还是分解方向均无明显变化;SPS在成熟和完熟甜瓜果实中活性显著提高,与果实发育时期蔗糖浓度的提高一致,AI在果实发育前期活性较高,但随着果实成熟迅速下降,在成熟果实中几乎检测不到其活性[12-13,17]。但也有研究认为SS的合成活性升高也是甜瓜果实蔗糖积累的主要原因, 表现为甜瓜果实进入成熟期后,SS合成活性骤然升高,约是成熟期前的10倍,进入成熟期的果实中蔗糖含量与SS合成方向活性和AI活性均呈极显著相关[15,22]。研究蔗糖积累能力不同的甜瓜发现,AI活性具有相似性,但SPS活性各不相同,果实组织中蔗糖含量与合成活性(SPS +SS合成方向)-分解活性(AI活性+NI活性+SS分解方向活性)的最后净活性相关系数高达0.85,推测甜瓜中蔗糖的积累由蔗糖的合成活性(SPS活性+SS合成方向活性)和分解活性(AI活性+NI活性+SS分解方向活性)之间的平衡决定[23]。造成这种差异的原因可能与甜瓜不同品种之间果实糖分积累水平和蔗糖代谢参与酶活性变化存在基因型差异相关[12-13]。综观相关报道,多数研究者采用单一材料[2-3,6,10]或同类材料[5,7,9]进行研究,且在甜瓜果实糖分积累与相关酶关系的研究方面仍存在疑问,如越瓜果实发育期间几乎无蔗糖积累[14],这种低蔗糖现象是参与蔗糖合成的酶活性低,还是参与蔗糖分解转化的酶活性高,亦或者这些糖代谢酶活性均处于低水平,目前尚无定论。
本研究以高糖、中糖及低糖甜瓜品种为试验材料,研究不同变种甜瓜果实成熟过程中糖分积累及相关酶活性的变化,从而探究糖分积累与蔗糖代谢相关酶的关系,以期为探索甜瓜果实发育期间的糖代谢积累机制、调控果实糖组分及其含量奠定理论基础。
1 材料与方法
1.1 试验材料
供试材料为哈密瓜(厚皮甜瓜亚种)自交系X228(C.melovar.saccharinusNaud. cv. X228)、普通甜瓜(薄皮甜瓜亚种)自交系B154(C.melovar.makuwaMakino cv. B154)和越瓜(薄皮甜瓜亚种)自交系H227(C.melovar.conmmonMakino cv. H227)。其中X228为高糖型,果实发育期45 d左右,成熟果实可溶性固形物含量达14%~18%;B154为中糖型,果实发育期30 d左右,成熟果实可溶性固形物含量为10%~12%;H227为低糖型,果实发育期30 d左右,成熟果实可溶性固形物含量为4.0%~6.0%。
1.2 试验方法
3个甜瓜自交系种子于2017年2月13日播种,3月15日定植于跨度为8 m的单体大棚中,采用立架栽培,坐果及田间管理同常规甜瓜栽培。3个甜瓜品种选择同期开花的两性花授粉,授粉当天进行标记,分别于X228授粉后15、20、25、30、35、40、45 d取样,分别于B154和H227授粉后15、20、25、30、35 d取样。其中,可溶性固形物含量测定每次选取5个发育正常果实的中心果肉;糖和酶活性的测定每次选择3个发育正常果实,采收后切取果实赤道部位厚度约 2 cm的果肉,将果肉样品混合,用液氮速冻,-80℃保存备用,3次生物学重复。
1.2.1 可溶性固形物含量测定 用纱布挤出甜瓜汁液,采用PAL-1便携式糖度仪(ATAGO,日本)测定果实可溶性固形物含量(total soluble solid,TSS)。具体测定方法:待糖度仪校正后,在玻璃面上滴2滴果肉汁液进行测试,读取数显仪上的数据。
1.2.2 糖组分含量测定 糖组分的提取:参考管学玉[24]的方法并稍作改进。取5.0 g果肉混合样品,加入5 mL 80%乙醇并将样品研碎,于75℃下浸提10 min,4 000 × g离心15 min,收集上清液,重复3次,合并上清液,定容至25 mL,摇匀后取1 mL溶液于1.5 mL离心管中,并将离心管置于Concentrator plus真空离心浓缩仪(Eppendorf公司,德国)中进行浓缩(30℃),残渣用1 mL重蒸水溶解后经0.22 μm滤膜过滤,用于液相色谱,重复3次。
糖组分含量测定:参考朱勇等[25]的方法并稍作改进。Waters2695高效液相色谱仪(配Waters2414型示差折光检测器,Waters公司),色谱条件为流动相(乙腈/重蒸水=80∶20,v∶v),流速1.0 mL·min-1,柱温40℃,检测器温度35℃,进样量10 μL。色谱柱为Spherisorb-5NH2柱(Waters公司,美国)。以色谱级的果糖、葡萄糖和蔗糖标准品等比例混合配制标准工作液,进行液相色谱分析,以浓度为X轴,峰面积为Y轴进行线性回归,制作标准曲线。
1.2.3 酶活性测定 参考管学玉[24]的方法。取1.0 g混合样品,用3 mL HEPES缓冲液(50 mmol·L-1pH值 7.5 HEPES-NaOH,1 mmol·L-1EDTA,10 mmol·L-1MgCl2,2.5 mmol·L-1DTT,10 mol·L-1抗坏血酸)溶解,然后加入60 mg不溶性的交联聚乙烯吡咯烷酮(crosslinking polyvinylpolypyrrolidone,PVPP)粉末,在冰浴中研磨成匀浆,11 000 × g(4℃)离心20 min,取上清液逐渐加硫酸铵至80%饱和度,放置30 min后11 000 × g(4℃)离心1 h,弃上清液,用2 mL脱盐缓冲液(稀释10倍的提取缓冲液)溶解沉淀,再用D25 mm透析袋在脱盐缓冲液中透析20 h左右。以上酶的提取操作均在0~4℃条件下进行,重复3次。
1)AI活性测定:参照张明方等[26]的方法。采用490 μL反应体系:含80 mmol·L-1pH值4.5醋酸-磷酸钾缓冲液、100 mmol·L-1蔗糖、210 μL脱盐后的酶液。37℃反应30 min,加入490 μL 3, 5-二硝基水杨酸(3, 5-Dinitrosalicylic acid,DNS)试剂终止反应,沸水浴5 min,冷却后在Multiskan ascent台式酶标仪(Thermo Electron Co.,芬兰)中测定520 nm波长处的吸光度。以杀死酶液的上述反应混合液作为对照。酶活性单位用Glu μmol·h-1·g-1FW表示。
2)NI活性测定:与酸性转化酶类似,仅将醋酸-磷酸钾缓冲液的pH值调整为7.5。
3)SS合成方向测定:参考管学玉[24]的方法。采用70 μL反应体系:含80 mmol·L-1pH 值7.5 HEPES-NaOH缓冲液、100 mmol·L-1果糖、15 mmol·L-1UDPG、1 mmol·L-1EDTA、10 mmol·L-1MgCl2、20 μL脱盐后的酶液。30℃反应30 min,加入70 μL 5 mol·L-1NaOH终止反应,沸水浴10 min,冷却后加入1 mL 0.14%蒽酮(溶解于13.8 mol·L-1H2SO4中),40℃反应20 min,冷却后测定620 nm波长处的吸光度值。对照组反应体系中不含果糖。
4)SPS活性测定:参考赵智中等[27]的方法。采用70 μL反应体系:含50 mmol·L-1pH值7.5 HEPES-NaOH缓冲液、15 mmol·L-1MgCl2、1 mmol·L-1EDTA、5 mmol·L-1NaF、16 mmol·L-1UDPG、4 mmol·L-1F-6-P和20 mmol·L-1G-6-P、20 μL脱盐后的酶液。30℃反应30 min,加入70 μL 5 mol·L-1NaOH终止反应,沸水浴10 min,冷却后加入1 mL 0.14%蒽酮(溶解于13.8 mol·L-1H2SO4中),40℃反应20 min,冷却后测定620 nm波长处的吸光度值。对照反应体系中不含6磷酸果糖(Fructose-6-phosphate,F-6-P)和6-磷酸葡萄糖(Glucose-6-phosphate,G-6-P)。
1.3 数据统计与分析
采用Microsoft Office Excel 2016对试验数据进行统计;采用SPSS 19.0软件对数据进行分析并作图。
2 结果与分析
2.1 甜瓜果实可溶性固形物含量的变化
随着甜瓜果实的生长,3个品系的可溶性固形物含量均呈增加的趋势,其中B154和X228的增加幅度明显高于H227,而B154和H227的可溶性固形物含量快速积累期较短(授粉后25~30 d);X228的可溶性固形物含量快速积累期较长(授粉后25~40 d)(图1)。

图1 甜瓜果实发育过程中可溶性固形物含量的变化Fig.1 Changes of total soluble solid content during developing of melon fruits
2.2 甜瓜糖含量的变化
由表1可知,3个甜瓜品系果实发育过程中葡萄糖、果糖和蔗糖的变化趋势具有一致性,但也存在明显的差异。授粉后3个甜瓜品系果实葡萄糖、果糖含量略有起伏,其中H227在授粉后15~30 d果实中葡萄糖含量为10.62~11.77 mg·g-1FW,果糖含量为10.17~10. 76 mg·g-1FW,果实达到成熟期后,葡萄糖和果糖含量略有增加,且果实发育成熟过程中,葡萄糖/果糖比值(G/F)均在1~1.1之间;B154果实中葡萄糖和果糖含量分别在9.48~15.18 mg·g-1FW和9.71~15.83 mg·g-1FW范围内波动,而X228果实中葡萄糖和果糖含量分别在12.72~18.83 mg·g-1FW和14.23~20.63 mg·g-1FW范围内变动,在果实接近成熟时B154和X228的葡萄糖和果糖含量均降低,其中B154显著降低,B154和×228两个品系果实内葡萄糖/果糖比值(G/F)由未成熟期的1.1左右降低到1以下。此外,果实蔗糖含量在授粉15 d后除H227维持较低的含量(0.11~0.85 mg·g-1FW)外,B154和X228的蔗糖含量存在明显的转折点,其中,B154果实蔗糖含量在授粉后15 ~30 d呈现较快的增长态势,蔗糖含量快速积累,之后趋于稳定,并在授粉后30 d时果实蔗糖含量开始高于葡萄糖、果糖含量;X228果实蔗糖含量在授粉后15~25 d缓慢增长,之后呈现快速增加的趋势,授粉后35 d果实蔗糖含量超过了葡萄糖、果糖含量,并在授粉后45 d达到45.8 mg·g-1FW,显著高于其他发育时间。同时, H227在果实发育期间,果实蔗糖与葡萄糖+果糖的比值[S/(G+F)]均在0.04以下,但B154和X228的S/(G+F)随着发育进程的推进快速增大,且B154的 S/(G+F)增大速度快于X228,但在果实成熟时X228的S/(G+F)大于B154。
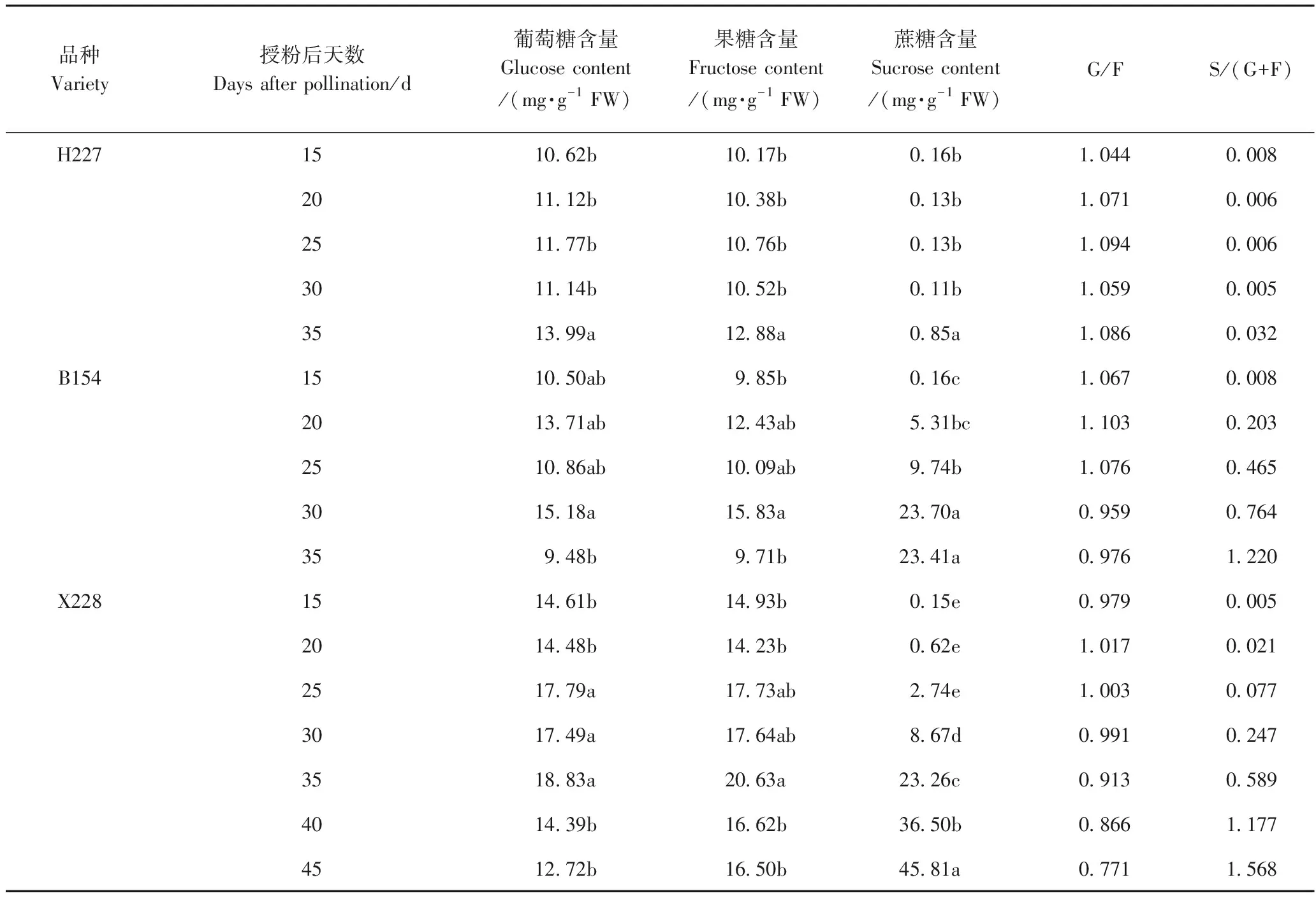
表1 甜瓜果实成熟期间葡萄糖、果糖蔗糖含量的变化Table 1 Changes of sucrose content, fructose content, and glucose contentduring developing of melon fruits
注:每个品种同列中不同字母表示在0.05水平差异显著。G/F表示葡萄糖/果糖比值;S/(G+F)表示蔗糖/(葡萄糖+果糖)比值。
Note:Different small letters in the same column of each variety indicate significant difference at 0.05 level. G/F represents the ratio of glucose/fructose, and S/(G+F) represents the ratio of sucrose/(glucose+ fructose).
2.3 甜瓜相关酶活性变化
由图2可知,甜瓜果实发育过程中与蔗糖代谢相关的SPS、SS、AI、NI活性变化具有一定的规律性。授粉15 d后,3个甜瓜品系果实SPS活性均呈上升趋势,其中H227各发育期果实SPS活性远低于B154和X228,即使在授粉后35 d(果实达到商品成熟度时)H277果实SPS活性仍处于极低水平;B154果实SPS活性在授粉后30 d达到高峰,之后随着生育期的推进有所下降;而X228果实SPS活性在授粉25 d后持续快速上升(图2-A)。3个品系的SPS活性变化与果实蔗糖含量及其变化趋势均基本一致。SS活性在授粉15 d后有所起伏,与SPS活性相比,3个品系果实的SS活性始终处于较低水平,其中H227果实SS活性低于B154和X228,且授粉后15~30 d,B154果实SS活性略高于X228(图2-C)。甜瓜果实发育期间AI活性的变化趋势与SPS活性相反,其中H227果实发育期间AI活性变化较小,一直处于较低水平;随着果实发育期的推进,B154果实AI活性持续降低,尤其在授粉后25~30 d果实蔗糖快速积累期间AI活性降低幅度较大;在授粉后15 d,X228果实AI活性处于较高水平,远高于B154,随着发育期的推进, X228果实的AI活性几乎呈直线下降,至授粉后25 d,X228果实AI活性下降趋势变缓(图2-B)。H227果实NI活性变化与AI活性相似,即在授粉后15~35 d均在低水平起伏;B154果实NI活性变化与AI活性相似,但随着果实发育期的推进NI活性的降幅低于AI活性;X228果实NI活性的变化既不同于其他2个品种,也与AI活性变化不同,授粉后15 ~20 d,X228果实NI活性快速上升,并在授粉后20 ~25 d快速下降,之后基本稳定(图2-D)。

图2 甜瓜果实发育过程中蔗糖代谢相关酶活性的变化Fig.2 Changes of enzymes activities related to sucrose metabolism during developing of melon fruits
2.4 蔗糖积累与蔗糖代谢相关酶活性的关系
由表2可知,H227果实发育期间蔗糖含量与SPS、SS、AI、NI活性均呈正相关,但除了与SPS活性的相关性达到显著水平外,与SS、AI和NI活性的相关性均不显著;B154果实的蔗糖含量与SPS活性呈正相关,但未达显著水平,与SS、AI、NI活性呈负相关,其中与NI、AI的相关性分别达显著和极显著水平;X228果实蔗糖含量与SPS活性呈极显著正相关,与SS、AI、NI活性呈负相关,且均未达到显著水平。进一步分析发现,(SPS+SS)与不同变种甜瓜品种的蔗糖含量均呈正相关,在H227与B154中差异显著,但仅与X228蔗糖含量达到极显著相关水平;(AI+NI)与H227果实蔗糖含量呈正相关,但差异不显著,与B154、X228果实蔗糖含量呈负相关,其中与B154达到极显著水平。此外,3个品系甜瓜果实蔗糖含量与蔗糖代谢相关酶的净活性(SPS+SS-AI-NI)均具有较高的正相关性,其中与X228和B154果实蔗糖含量的相关系数分别达到显著和极显著水平。
3 讨论
甜瓜种类(亚种、变种)和品种间果实含糖量的差异主要表现在蔗糖含量方面,可以分为蔗糖积累型和低蔗糖积累型2种。越瓜(C.melovar.conmmon)属于低蔗糖积累型品种,本研究中的越瓜品种H227在果实发育过程中蔗糖含量极低,这与前人报道一致[14,19];浙江大学甜瓜育种课题组研究发现,普通甜瓜(C.melovar.makuwa)特别是厚皮甜瓜(C. var.cantalupensis)属于蔗糖积累型,蔗糖是成熟果实中的主要糖分,品种间含糖量的差异主要表现为蔗糖含量的不同。虽然葡萄糖和果糖也是甜瓜果实的主要糖组分,但成熟果实中葡萄糖和果糖含量在种类(变种)、品种间的差异远小于蔗糖,这与前人研究结果一致[3,13,19]。

表2 甜瓜果实蔗糖含量与蔗糖代谢相关酶活性的相关性分析Table 2 Correlation coefficients between sucrose content and related enzyme activities of melon fruits
注:*、**分别表示在0.05和0.01水平差异显著。
Note:*,**indicate significant difference at 0.05 and 0.01 level,respectively.
在甜瓜果实发育过程中,葡萄糖和果糖含量变化不大且非常接近,研究结果表明,授粉后15 d开始,甜瓜果实内葡萄糖/果糖比值在1左右,其中2个蔗糖积累型甜瓜品种葡萄糖/果糖比值随着果实的成熟略有下降趋势,但越瓜品种H227果实发育过程中比值基本无变化。在蔗糖积累型甜瓜品种中,蔗糖积累存在一个明显的转折点,此转折点不仅表现在蔗糖含量的显著增加,而且也体现在蔗糖/单糖(葡萄糖+果糖)比值的变化。果实发育期较短的B154的蔗糖积累转折点发生在授粉后20~25 d,而果实发育期较长的X228的转折点发生在授粉后30 d左右。类似的结果在不同品种的研究中也有报道[5,28-30],如Villanueva等[30]发现厚皮甜瓜品种Piel de Sapo和Rochet果实蔗糖积累的转折点出现在授粉后26~35 d。
本研究结果表明,蔗糖积累型品种在授粉后15~20 d(X228)、15~25 d(B154)果实AI活性较高,之后下降,与前人的报道一致[5,12,30]。AI通过水解蔗糖为葡萄糖和果糖,以保持细胞的渗透压[5],并为果实的快速生长提供作为碳源的己糖[12, 30],所以在果实发育初期,AI活性较高;此外,研究表明AI活性降低是蔗糖积累的必备条件[16]。本研究结果表明,甜瓜果实蔗糖含量的上升与SPS活力的上升相伴随,类似的结果前人也有报道[9, 21-22, 29]。SPS催化F-6-P成为6-磷酸蔗糖(sucrose-6-phosphate,S-6-P),这是一个可逆反应,但S-6-P通常会被与SPS以复合体形式存在于植物体内的磷酸蔗糖磷酸化酶(phosphoric acid sucrose phosphatase,SPP)迅速降解成蔗糖和磷酸根离子,因此催化产生蔗糖的反应实际上是一个不可逆过程[31]。
本研究所涉及的3个不同类型的甜瓜品系中,对果实蔗糖积累起决定作用的酶存在明显差异,越瓜品系H227的SS、AI、NI活性与普通甜瓜品系B154、哈密瓜品系X228无明显差异,蔗糖较低主要是由极低的SPS活性所致;而同为蔗糖积累型的B154与X228在果实成熟期蔗糖含量存在较大的差异,与SPS、AI活性差异关系密切,果实发育后期SPS活性的下降及仍维持相对较高的AI活性是B154果实蔗糖含量相对较低的主要原因,持续增加的SPS活性及较低的AI活性导致X228果实具有较高的蔗糖含量。但蔗糖积累能力不同的甜瓜品种具有相似的AI活性,而SPS活性存在明显差异[23],这与本研究结果不完全一致,其原因可能是本研究采用了不同蔗糖积累型(不同变种)的甜瓜,而Hubbard等[23]采用的均为厚皮甜瓜。
越瓜品种H227在商品成熟时果实的主要糖组分是葡萄糖和果糖,几乎无蔗糖积累,其爽口清甜的口味深受我国东南沿海地区消费者的喜爱。随着生活水平及健康意识的提高,人们对甜瓜需求也更加趋向于多样化,消费者不再追求单一高甜型的甜瓜品质,松脆、清甜的低糖型甜瓜品种(越瓜)在市场也有较大的发展潜力。通过分析不同甜瓜变种果实发育期间糖代谢的差异,了解不同类型甜瓜在品质育种上的利用价值,为甜瓜果实品质调控和品质育种提供了理论依据。
4 结论
本研究结果表明,甜瓜果实中SPS、AI活性是决定甜瓜果实蔗糖含量的关键酶,低糖型越瓜H227果实中非常低的蔗糖含量与果实中极低的SPS活性有关;普通甜瓜B154果实中相对较高的蔗糖含量取决于相对较高的SPS活性及相对较高的AI活性;高糖型哈密瓜X228积累的高蔗糖含量与较高的SPS活性及相对较低的AI活性有关。本研究结果进一步明确了不同蔗糖积累型甜瓜果实的糖代谢机理。为了更好地指导甜瓜生产及不同糖含量甜瓜品种选育,有必要从糖代谢酶的分子调控及遗传机理方面做进一步深入研究。

