体外模拟胃肠消化对不同热处理荷叶中酚类物质释放量及抗氧化活性的影响
王智能 王 允 吴光旭,2,* 吴庆华,2 苏东晓 李 利杨华林 陈 莎
(1 长江大学生命科学学院,湖北 荆州 434020;2 长江大学荆楚特色食品研发中心,湖北 荆州 434020;3 广州大学化学化工学院,广东 广州 510610)
莲(Nelumbonucifera)睡莲科莲属,是一种常见的多年生水生草本植物,主要分布于东亚和印度[1-2]。荷叶是莲的叶,是重要的药食两用资源[3]。传统医学典籍记载荷叶具有清暑化湿、生发清阳和凉血止血的功能[3-4]。现代医学研究报道,荷叶还具有抗氧化[5]、降脂减肥[6]、抗人类免疫缺陷病毒[7]、抗癌[8]、抑菌[9]和治疗心血管疾病[10]等多种功效,保健用途广泛,已成为近年来中药和保健食品的研究热点。研究表明,荷叶富含芦丁、花青素、槲皮素、单宁和紫云英甘等酚类物质[11-14],以及生物碱、木脂素等生物活性物质,具有良好的生物活性和生理功能[15]。然因其采收季节性强,仅有少部分被用于医疗和食品等行业,其余自然凋零于池塘中或被收集焚烧而未被利用,不仅造成资源浪费,还污染环境[16]。因此,提取荷叶中的酚类物质对于促进人体健康和解决资源浪费问题具有重大意义。
目前,植物中的酚类物质主要通过乙醇、丙酮和乙酸乙酯等有机溶剂进行提取[17],如荔枝果肉中的游离酚可选用70%乙醇溶液(料液比 1∶3,w/v)进行提取,而结合酚可采用酸水解法和碱水解法进行提取[18-19]。植物酚类物质可作为膳食多酚的来源,通过口服方式进入人体,到达胃和肠道中进行转化。体外模拟胃肠消化是通过调节pH值,添加酶和无机盐来模拟人体胃肠道环境,进一步反映食物及食物中酚类物质在人体胃肠道中的代谢情况。研究表明,胃肠道中的消化酶、pH值和无机盐均会影响食物及酚类物质在人体胃肠道中的吸收与释放[20-21]。Su等[22]发现模拟胃液和肠液消化处理均提高了荷叶的总酚释放量,且模拟肠液消化对于不同生长阶段荷叶中总黄酮的释放量还具有促进作用。此外,食物的不同加工方式也会影响其活性成分的释放[23-25]。郑慧等[26]发现蜂花粉多酚溶出量随粉碎粒径的减小而增加,粉碎可提高溶出多酚在肠液消化过程中的保留率。目前关于荷叶中酚类物质的研究主要以新鲜荷叶为原料进行探究,对于经热加工处理的荷叶,通过模拟胃肠消化来探究荷叶中酚类物质的释放及其抗氧化活性的影响未见报道。
本研究采用体外模拟胃肠消化法探究不同热处理后的荷叶中总酚和总黄酮释放量的变化,以及其铁离子还原能力(ferric ion reducing antioxidant power,FRAP)和ABTS自由基清除能力,以期为荷叶的开发利用提供技术支撑和理论依据。
1 材料与方法
1.1 主要材料与试剂
新鲜、无污染的荷叶于2017年8月中旬采集于湖北荆州。
胃蛋白酶、胰蛋白酶、芦丁和没食子酸均购自美国Sigma公司;二硫代苏糖醇(DL-Dithiothreitol,TPTZ)、2,2’-联氮-双-乙基苯并噻唑-6-磺酸[2,2’-azino-bis(3-ethylbenzothiazoline-6)-sulfonic acid, ABTS]、水溶性维生素E(Trolox)、福林酚试剂和硫酸亚铁(GR)均购自山东西亚化学工业有限公司;其他试剂均为分析纯,购自天津市大茂化学试剂厂。
1.2 主要仪器与设备
FW100高速万能粉碎机,天津恒瑞科教仪器有限公司;GZX-9420 MBE鼓风干燥箱,上海博讯实业有限公司;FA1104电子天平,上海天平仪器厂;KQ100DE超声波清洗机,宁波新芝生物科技股份有限公司;BR-2000涡旋振荡器,上海伯乐生命医学产品有限公司;5430R高速冷冻离心机,美国Eppendorf公司;DSHZ-300A水浴恒温振荡器,苏州培英实验设备有限公司;PB-10型pH计,德国Sartorius公司;UV-2100紫外可见分光光度计,日本岛津公司。
1.3 试验方法
1.3.1 荷叶前处理试验 荷叶生长过程分为立叶期、营养生长期、成熟期和衰亡期,荷叶直径大小可以代表其不同生长期,6、7、8月份荷叶的直径分别为10~20、30~40、50~60 cm[27],6、7月份为营养生长期,8月份为成熟期。挑选新鲜、外观较好,直径分别为15±3、34±3、56±4 cm的荷叶进行处理。真空微波处理:采用 50Hz 微波2 min,依次记作V15组、V34组、V56组;湿热蒸汽处理:采用100℃沸水的水蒸汽熏蒸 5 min,依次记作H15组、H34组、H56组;煮沸处理:采用100℃沸水煮沸5 min,依次记作B15组、B34组、B56组。处理后将所有荷叶样品参考刘慧娟等[16]和Su等[22]的方法60℃热风干燥至荷叶样品中水分含量为4.5%~5.0%。将上述干燥后的荷叶样品分别粉碎,过60目筛,样品粉末于-18℃冰箱中保存备用。
1.3.2 荷叶体外消化处理试验
1.3.2.1 去离子水提取 称取2.00 g 1.3.1中各处理组荷叶粉末,分别按照1∶15(质量体积比)的比例加入去离子水,振荡混匀后于37℃条件下恒温振荡(120 r·min-1)2 h,然后5 000 r·min-1离心10 min,收集上清液,并于-20℃冰箱中保存备用,以此作为对照。
1.3.2.2 模拟胃液消化处理 参考Fu等[28]的方法并略作修改。体外模拟胃消化液的制备:准确称取2.0 g NaCl和3.2 g胃蛋白酶,加入预先用900 mL去离子水和7.0 mL浓盐酸充分混合好的溶液中,通过磁力搅拌器使其充分溶解,再用6 mol·L-1HCl调节pH值至1.2,最后将溶液转移并定容至1 000 mL,充分摇匀后静置过夜,即为体外模拟胃消化液。
消化处理:称取2.0 g 1.3.1中各处理组荷叶粉末,按照1∶15 g·mL-1的比例加入过夜静置的模拟胃消化液,振荡混匀后于37℃条件下恒温振荡(120 r·min-1)2 h,然后5 000 r·min-1离心10 min,收集上清液,并于-20℃冰箱中保存备用。
1.3.2.3 模拟肠液消化处理 参考Fu等[28]的方法并略作修改。体外模拟肠消化液的制备:准确称取6.8 g KH2PO4于烧杯中,加入250 mL去离子水,并通过磁力搅拌使其充分溶解,再加入190 mL 0.2 mol·L-1NaOH溶液和400 mL去离子水,充分混匀后加入10.0 g胰酶,待胰酶充分溶解后用NaOH溶液或HCl溶液调节溶液pH值至7.5±0.1,最后用去离子水定容至1 000 mL,充分摇匀,即得体外模拟肠消化液。
消化处理:称取2.0 g 1.3.1中各处理组荷叶粉末,按照1∶15 g·mL-1的比例加入模拟肠消化液,振荡混匀后于37℃条件下恒温振荡(120 r·min-1)2 h,然后5 000 r·min-1离心10 min,收集上清液,并于-20℃冰箱中保存备用。
1.3.3 荷叶总酚释放量测定 参照文献[29]的方法并略作修改。吸取250 μL模拟消化处理或对照样品上清液,加入1.0 mL去离子水和250 μL福林酚试剂,混匀后静置6 min,再加入2.5 mL Na2CO3溶液(质量体积比为70 g· L-1)和2 mL去离子水,振荡混匀后室温条件下暗室反应 90 min,测定其在760 nm波长处的吸光度值。总酚释放量以没食子酸为标准,按照每克样品中没食子酸释放量当量(gallic acid equivalent,GAE)表示,单位为mg·g-1。
1.3.4 荷叶总黄酮释放量测定 参照文献[29]的方法并略作修改。取3.0 mL去离子水,加入600 μL模拟消化处理或去离子水提取上清液和180 μL 50 g·L-1NaNO2溶液,混匀静置6 min后加入360 μL 100 g·L-1AlCl3·6H2O溶液,反应5 min后再加入1.2 mL 1 mol·L-1NaOH溶液,用去离子水补至6.0 mL,测定其在510 nm波长处的吸光度值。总黄酮释放量以芦丁为标准品,每克样品中所含芦丁质量当量(rutin equivalents,RE)表示,单位为 mg·g-1。
1.3.5 荷叶FRAP抗氧化能力测定 参考Thaipong等[30]的方法。准确吸取0.6 mL样液,加入5.4 mL FRAP工作液后充分摇匀,避光保存30 min,测定其在593 nm波长处的吸光度值。以硫酸亚铁作为标准品绘制标准曲线,计算各样品的FRAP抗氧化能力值,单位为 μmol FeE·g-1。
1.3.6 ABTS自由基清除能力的测定 参考Thaipong等[30]的方法。准确吸取1.2 mL模拟消化处理或去离子水提取上清液,加入4.8 mL ABTS工作液,振荡混匀后静置6 min,测定其在734 nm波长处的吸光度值。以Trolox为标准品绘制ABTS自由基清除率标准曲线,计算样品ABTS抗氧化能力值,单位为mmol TE·g-1。
1.4 数据分析
所有试验均平行测定3次,结果以平均值±标准差(M±SD)表示。采用SPSS 24.0软件进行单因素方差分析,并以SNK检验比较各组间显著性差异,显著性水平P=0.05。
2 结果与分析
2.1 模拟体外消化对不同热处理的荷叶总酚释放量的影响
由图1可知,相同消化方式不同热处理下,V56组荷叶中总酚释放量最高,其次是V34组,B15组最低;相同热处理不同消化方式下,与去离子水组(DW)相比,模拟肠液消化处理(SIF)能增加不同热处理组荷叶总酚的释放量,模拟胃液消化处理(SGF)增加真空微波处理组荷叶的总酚释放量和降低煮沸处理组荷叶中总酚释放量,而对湿热蒸汽热处理组荷叶中总酚释放量影响较小。此外,直径最大的荷叶(V56组、H56组、B56组)总酚释放量最高,直径最小的荷叶(V15组、H15组、B15组)总酚释放量最低。综上可知,真空微波处理组对荷叶中总酚释放量的提高效果最好,荷叶直径越大,其酚类释放量越高,模拟肠液消化处理能增加总酚释放量。

注:不同小写字母表示相同消化处理下不同样品间差异显著(P<0.05)。下同。Note:Different lowercase letters indicate significantly difference within the same treatment group at 0.05 level. The same as following.图1 模拟体外消化对不同热处理的荷叶中总酚释放量的影响Fig.1 Effects of simulated in vitro digestion on total phenolics release in lotus leaves with different heat treatment
2.2 模拟体外消化对不同热处理的荷叶总黄酮释放量的影响
由图2可知,在荷叶直径相等和消升方式相同的情况下,不同热处理中,真空微波组(V56组、V34组和V15组)荷叶总黄酮释放量高于湿热蒸汽组(H56组、H34组和H15组)和煮沸处理组(B56组、B34组和B15组),其中,V56组荷叶总黄酮释放量最高,B15组最低;在相同热处理不同消化方式下,与DW组相比,模拟胃液消化使真空微波、湿热蒸汽和煮沸处理组中荷叶的总黄酮含量降低,而模拟肠液消化则提高其总黄酮的释放量。在不同热处理相同消化方式下,真空微波处理组中的总黄酮释放量显著高于湿热蒸汽和煮沸处理组,此外,直径较大的荷叶(V56组、H56组、B56组)总黄酮释放量最高,直径最小的荷叶(V15组、H15组、B15组)总酚释放量最低。综上,真空微波处理较其他热处理方式的提取效果好,荷叶总黄酮释放量随着荷叶直径增大而增加;与去离子水组(DW)相比,模拟胃液消化处理(SGF)会降低不同热处理组荷叶中总黄酮的释放量,而模拟肠液消化处理(SIF)会增加荷叶总黄酮释放量。

图2 模拟体外消化对不同热处理的荷叶中总黄酮释放量的影响Fig.2 Effects of simulated in vitro digestion on total flavonoids release in lotus leaves with different heat treatment
2.3 模拟体外消化对不同热处理的荷叶FRAP抗氧化能力的影响
由图3可知,相同消化方式不同热处理下,真空微波组荷叶的FRAP值显著高于湿热蒸汽处理组和煮沸处理组。DW和SIF中V56组荷叶的FRAP抗氧化能力最强;SGF中V56组和H56组均高于其他热处理组,但二者无显著差异;在DW、SGF和SIF中,湿热蒸汽处理组和煮沸处理组荷叶FRAP抗氧化能力由强到弱依次分别为H56>H34>H15和B56>B34>B15,这与其总酚含量测定结果一致。相同热处理不同消化方式下,湿热蒸汽处理组中H56的FRAP抗氧化能力在模拟胃液消化中增强,并与真空微波V56相比无显著性差异。此外,荷叶的抗氧化能力随荷叶直径的增大而增强,其中直径较大的荷叶(V56组、H56组、B56组)FRAP抗氧化能力较高,直径最小的荷叶(V15组、H15组、B15组)FRAP抗氧化能力较低。综上表明,不同热处理方式对荷叶的FRAP抗氧化能力有显著影响,其中真空微波处理效果最好;此外,模拟胃液消化对于湿热蒸汽组中荷叶的抗氧化能力影响最大,对于真空微波和煮沸处理组中荷叶的FRAP抗氧化能力影响较小,模拟肠液消化则对于真空微波、湿热蒸汽和煮沸处理组中荷叶FRAP抗氧化能力的影响均较小。
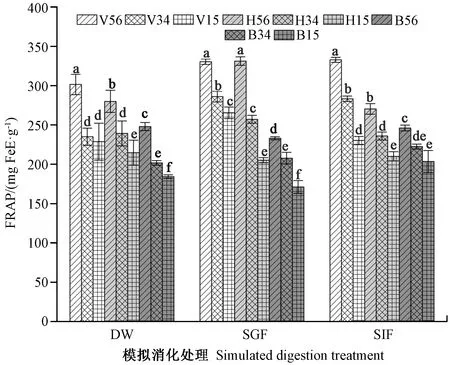
图3 模拟体外消化对不同处理的荷叶FRAP抗氧化能力的影响Fig.3 Effects of simulated in vitro digestion on the antioxidant capacities of FRAP in lotus leaves with different heat treatment
2.4 模拟体外消化对不同热处理的荷叶ABTS抗氧化能力的影响
由图4可知,相同消化方式不同热处理下,DW、SGF和SIF中V56组的ABTS值显著高于其他热处理组,这与其总酚含量测定结果相一致。DW、SGF和SIF组中湿热蒸汽处理和煮沸处理的荷叶ABTS抗氧化能力由强到弱依次分别为H56>H34>H15和B56>B34>B15,这与FRAP测定结果相一致。相同热处理不同消化方式下,SIF中真空微波组、湿热蒸汽组和煮沸组荷叶的ABTS抗氧化能力均强于DW和SGF。此外,荷叶直径越大其抗氧化值越高,其中,直径为56 cm的荷叶的ABTS抗氧化能力最强,这与其总酚和FRAP抗氧化能力测定结果相一致。综上表明,热处理对荷叶的抗氧化能力具有显著影响,其中真空微波处理能显著提高荷叶的抗氧化能力。模拟肠液消化对于真空微波、湿热蒸汽和煮沸处理组中荷叶的抗氧化能力具有积极影响,能显著提高荷叶的抗氧化能力,而模拟胃液消化则对于真空微波处理组中荷叶的抗氧化能力有较大影响,显著降低其抗氧化能力,但抗氧化活性仍高于湿热蒸汽和煮沸处理组。

图4 模拟体外消化对不同热处理的荷叶ABTS抗氧化能力的影响Fig.4 Effects of simulated in vitro digestion on the antioxidant capacities of ABTS in lotus leaves with different heat treatment
3 讨论
植物中的酚类化合物是植物体内的次生代谢产物,具有多元酚羟基结构,这类化合物的稳定性会受光、热、氧气及pH值等多种因素的影响, 这些因素使其活性物质损失,导致其营养价值降低[31]。新鲜果蔬可通过直接晒干、烤干、热风干燥和微波干燥等多种加工方式进行脱水干燥,但不同加工方式会影响其活性物质的释放量。研究表明,热处理可能会增大细胞间的孔隙[32-33],促进值物中酚类物质的溶出和释放,此外,热处理还能使植物细胞壁破裂,改变其萃取性,使得酚类化合物更容易释放[34]。总酚含量的增加还可归因于高温使多酚氧化酶失活,酶催化活性被破坏,酚类化合物无法聚合,阻止酚类化合物参与褐变反应[35]。本研究通过分析不同热处理荷叶中酚类释放量及抗氧化活性的影响来选择荷叶干制的最优方法,结果显示,真空微波处理的荷叶干燥效果最好,荷叶直径越长,荷叶总酚和总黄酮释放量越高,V56组荷叶中总酚、总黄酮释放量均高于其他处理组。
食物在体内消化吸收和代谢过程比较复杂,其酚类物质释放量和组成会发生较大变化,直接影响其生物活性[36]。食品中既含有游离酚,也含有结合酚[19]。游离酚可能在热处理过程中发生聚合或降解,而结合酚可能在消化过程中被释放出来。研究表明,胃肠环境对酚类物质释放有较大的影响, 山楂通过胃肠消化后其总酚含量会显著增高[37]。本试验结果表明,与对照组相比,模拟胃液消化处理降低了荷叶中总黄酮释放量,但增加了总酚释放量,而模拟肠液消化显著增加了荷叶中总酚和总黄酮释放量,这可能是由于黄酮类物质与蛋白质结合形成了类黄酮-蛋白酶复合物,从而影响其释放[38]。
抗氧化活性是体系中所有抗氧化物质共同发挥作用的结果,胃肠环境的变化可能影响抗氧化物质的结构和相互作用。有研究报道FRAP和ABTS抗氧化活性与酚类物质含量呈正相关[39]。本研究中,荷叶富含酚类物质,且具有较好的FRAP铁离子还原能力和ABTS自由基清除能力等抗氧化活性。热处理方式不仅影响荷叶中总酚及总黄酮释放量,对荷叶的FRAP抗氧化能力及ABTS抗氧化能力也有一定影响。其中微波真空处理效果最好,荷叶直径越大其FRAP抗氧化能力及ABTS抗氧化能力越高,这与热处理方式对荷叶中总酚、总黄酮释放量影响规律一致。
4 结论
热处理方式和消化方式均会影响不同生长期荷叶总酚和总黄酮释放量及其FRAP、ABTS抗氧化活性。相同处理条件下,直径越大,其酚类含量释放量越高,抗氧化活性越强。此外,相同消化方式不同热处理下,真空微波处理组中荷叶的酚类含量和抗氧化活性与湿热蒸汽和煮沸处理组相比均较高。在相同热处理不同消化方式下,模拟肠液消化能显著提高真空微波、湿热蒸汽和煮沸处理组中荷叶酚类含量和抗氧化活性,且真空微波处理组中荷叶的酚类释放量与其抗氧化活性在模拟胃液和肠液消化中均高于湿热蒸汽和煮沸处理组。综上所述,真空微波V56组显著提高了荷叶中酚类物质的释放量以及其抗氧化活性。因此热处理对于荷叶中酚类物质的释放及其抗氧化活性的提高具有积极影响,这为今后荷叶食品的开发与利用提供了理论基础。

