氮元素对三角褐指藻岩藻黄素和油脂合成关键酶基因表达与代谢合成的影响
陈若莹 徐润洁 龚一富 刘 芳 付 旭 章 丽王何瑜 石 慧
(1宁波大学海洋学院,浙江 宁波 315832;2宁波大学食品与药学学院,浙江 宁波 315832;3 宁波大学法学院,浙江 宁波 315211)
岩藻黄素(fucoxanthin)是一种脂溶性类胡萝卜素,因其具有抗炎、抗高血压、抗肿瘤等功效,被广泛应用于食品、医药、美容等领域[1-3]。 目前已有关于岩藻黄素的研究报道,如Heo 等[4]和Zeng 等[5]研究发现,岩藻黄素可有效降低因波长280 ~320 nm 的紫外B(UV-B)诱导造成的动物细胞损伤和凋亡。 Lin 等[6]研究发现岩藻黄素可防止淀粉样蛋白寡聚体诱导(amyliod β-protein oligomer-induced)神经元氧化及损失,表明岩藻黄素对阿尔茨海默症可能有一定的疗效。Terasaki 等[7]研究发现,岩藻黄素能降低结肠病变的发生率,且对细胞癌变有一定的预防作用。 由此可见,岩藻黄素在医学、药学等领域发展前景良好,但由于岩藻黄素在微藻中含量较低,且提取效率较低,导致其价格十分昂贵[8],因此提高岩藻黄素在微藻中的含量具有重要意义。
三角褐指藻(Phaeodactylum tricornutum)为硅藻门单细胞微藻,具有生长周期短、适应性强、光合效率较高、细胞内能合成多种生物活性成分(岩藻黄素、脂类物质和多糖等)等特性,在药物开发方面具有广阔的应用前景。 三角褐指藻的高光合效率主要依赖于其富含色素及其蛋白复合物岩藻黄素-叶绿素蛋白复合体(fucoxanthin chlorophyll proteins,FCP)。 FCPb 是FCP中的一个大亚基,为寡聚体多肽和色素的复合物,参与组成三角褐指藻光反应系统中重要的捕光天线蛋白,发挥光捕捉和光保护的作用,且具有上调光合作用的功能[9]。 此外,研究表明三角褐指藻通过光合作用可使其细胞内积累的油脂(lipid)含量达30%,生物柴油含量远高于油料作物(8 ~24 倍),因此三角褐指藻是制备生物柴油的优质原料,可作为未来能源的替代品[10-11]。 而在合成脂质途径中,脂肪酸去饱和酶(fatty acid desaturase,FADS)是一种将脂肪酸链上的C-C 单键催化去饱和为C=C 双键的关键酶。 微藻中富含的脂肪酸去饱和酶多为酰基-酰基载体蛋白去饱和酶(acyl-ACP desaturase,FAB2),其所在支路就是催化硬脂酰-ACP 脱饱和形成油酰-ACP[12],最后合成十六碳六烯酸。 作为一种极具开发潜力的优质经济硅藻资源,三角褐指藻的基因组已于2008年测序完成[13],目前大多数研究只单方面关注变量条件下三角褐指藻岩藻黄素或者油脂的变化以解决资源短缺的现状,未尝试结合岩藻黄素与油脂含量作出直接的解释。
大量研究表明,氮元素对调控微藻植物生长、代谢合成具有关键作用[12-14]。 如Yang 等[15]研究发现,缺氮4 h 处理后,莱茵衣藻(Chlamydomonas reinhardtii)中脂质积累量明显增加,且在叶绿体周围富集。 郑彩云等[16]研究表明,随着NaNO3添加浓度(0.4 ~1.2 g·L-1)的增加,紫球藻(Porphyridium cruentum)的叶绿素a 与藻胆蛋白的积累量均相对较高。 但目前关于氮元素对三角褐指藻岩藻黄素、油脂的积累量影响的研究尚未见报道。
本研究以三角褐指藻为试验材料,研究不同氮浓度处理对三角褐指藻中油脂、岩藻黄素代谢合成的影响,以期为探究三角褐指藻次生代谢产物的积累特性提供一定的理论参考。
1 材料与方法
1.1 试验材料
三角褐指藻由宁波大学海洋学院微藻室提供。 天然海水过滤高压灭菌后,采用改良f/2 培养基[17];培养条件为光照强度60 μmol·m-2·s-1,培养温度20℃,光周期12 h 光照/12 h 黑暗。 氮浓度分别为896、448、112、28 和0 μmol·L-1,以氮浓度为896 μmol·L-1为对照(CK),每处理均设3 次生物学重复。
1.2 方法
1.2.1 三角褐指藻生长曲线测定 取生长至对数期的三角褐指藻5 mL,倍数比稀释后用UV-5200 型紫外分光光度计(上海元析仪器有限公司)测定三角褐指藻在680 nm 波长处的吸光值(A680),同时用血球计数法[18]计算各组中三角褐指藻的细胞密度。 氮限制培养三角褐指藻后,每隔24 h 进行生长曲线的测定。每次分别取1 mL 在氮限制下培养的藻液,用UV-5200 型紫外分光光度计测定其在680 nm 波长处的吸光值(A680),并计算藻体密度,建立氮限制处理下的三角褐指藻的生长曲线。
1.2.2 三角褐指藻岩藻黄素的提取及含量测定 采用有机溶剂提取法[19],在三角褐指藻生长进入平台期后进行岩藻黄素的提取及含量测定,每组设3 次生物学重复。 准确量取80 mL 三角褐指藻,5 000 r·min-1、4℃条件下离心10 min,弃上清,冷冻干燥2 d,称重,研磨成粉约0.1 g。 加入无水乙醇,藻粉∶无水乙醇=1 ∶40(g·mL-1),60℃避光浸提2 次,每次1 h。 浸提后5 000 r·min-1离心10 min,取上清液,利用紫外分光光度计在445 nm 波长(OD445)处测定吸光度。 按照公式计算岩藻黄素含量:

式中,A445为岩藻黄素提取液在445 nm 处的吸光度值;N 为稀释倍数;Ⅴ为粗提取液体积,mL;为岩藻黄素浓度为1 g·L-1时,光径为1 cm 时的光吸收值,即1 600;M 为样品质量,g。
1.2.3 三角褐指藻油脂含量测定 在三角褐指藻生长进入平台期后进行油脂含量测定,设3 次生物学重复。 采用尼罗红染色法[20]:取2.5 mL 藻液,加入26 μL 二甲基亚砜,微波处理40 s,加入78 μL 尼罗红(50 μg·mL-1),在40℃下水浴5 min,利用spectra max 190酶标仪(上海美谷分子仪器有限公司)测定其荧光强度,其中激发波长为480 nm,发射波长为500 ~750 nm,根据在570 nm 下的荧光强度(尼罗红的自发荧光强度)确定油脂的相对含量。 三角褐指藻油脂含量用其油脂相对含量表示。
1.2.4 三角褐指藻叶绿素a 含量测定 取10 mL 混合均匀的藻液,在4℃、4 000 r·min-1条件下离心10 min,弃上清,用双蒸水冲洗沉淀2 次,加入10 mL 无水乙醇,黑暗处理24 h,利用紫外分光光度计测定提取液在A665、A750、A652处的吸光值。 按照公式计算提取液中的叶绿素a 含量:

1.2.5 三角褐指藻总RNA 的提取 采用氮限制的f/2培养基培养处于对数期的三角褐指藻,培养24 h,取50 mL 藻液,在4℃、5 000 r·min-1条件下离心10 min 后收集沉淀,然后按照Plant RNA Kit 试剂盒(北京OMEGA 有限公司) 说明书提取三角褐指藻总RNA,-20℃保存备用。
1.2.6 三角褐指藻代谢通路FCPb基因和FAB2 基因表达分析 三角褐指藻代谢通路采用Primer Premier 5.0软件设计定量引物序列,FCPb-F( 5′-ATGAAGTTTACCGTGTTTGCCT-3′)、FCPb-R( 5′-TAACACCTGGGAGGATGTTGACTC-3′)、FAB2-F ( 5′-CATCAAGGAAGTCCGTGCCA-3′)、FAB2-R ( 5′-CGGGTTGAATCCGTTCGTAA-3′)、β-action-F( 5′-AGACCATTATGAAGTGAGAT-3′)、β-action-R( 5′-ACCCTCCAATCCAAACAG-3′)引物由上海生工生物工程有限公司合成;按照Takara Prime Script RT reagent Kit 试剂盒(TakaRa,日本)说明书对氮限制培养下的三角褐指藻RNA 进行反转录,并使用Takara Prime Ex TaqTMⅡ试剂盒(TakaRa,日本)对反转录得到的cDNA进行荧光定量PCR。 PCR 反应体系为20 μL,包括SYBR 10 μL、上游引物0.8 μL、下游引物0.8 μL、超纯水6.4 μL、模板2 μL。 在Mastercycler ep realplex 实时荧光定量PCR 仪(Eppendorf,德国)进行扩增,反应程序:94℃预变性3 min;94℃变性30 s,53℃退火40 s,72℃延伸20 s,共40 个循环;72℃延伸10 min。 以β-action作为内参基因,采用2-△△CT法[21]计算基因相对表达量。
1.3 数据分析
采用Mircosoft Excel 2007 对数据进行统计并作图,采用SPSS21.0 进行单因素方差分析。
2 结果与分析
2.1 氮元素对三角褐指藻细胞生长的影响
通过测定三角褐指藻在生长过程中藻细胞密度与吸光值之间关系,得出关系式:Y=127.21X-5.309,R2=0.991 2,(Y为细胞密度,单位为105cells·mL-1;X为对应的吸光值)。 根据测定的吸光度值可得到相应的细胞密度。 由图1可知,第1 ~第7 天,随着培养时间的延长,三角褐指藻细胞密度逐渐增加,细胞生长处于上升期,第7 天时,各处理的三角褐指藻细胞密度均达到最大值。
比较不同氮浓度处理下第7 天三角褐指藻的生物量,结果表明,随着氮限制的增强,三角褐指藻的细胞密度呈逐渐下降的趋势,且各处理均极显著低于CK;在氮浓度为0 μmol·L-1时,三角褐指藻的生长受到严重抑制,与CK 相比藻细胞密度极显著下降了47.9%(图2)。 表明氮限制对三角褐指藻的生长具有抑制作用。
2.2 氮元素对三角褐指藻岩藻黄素含量的影响
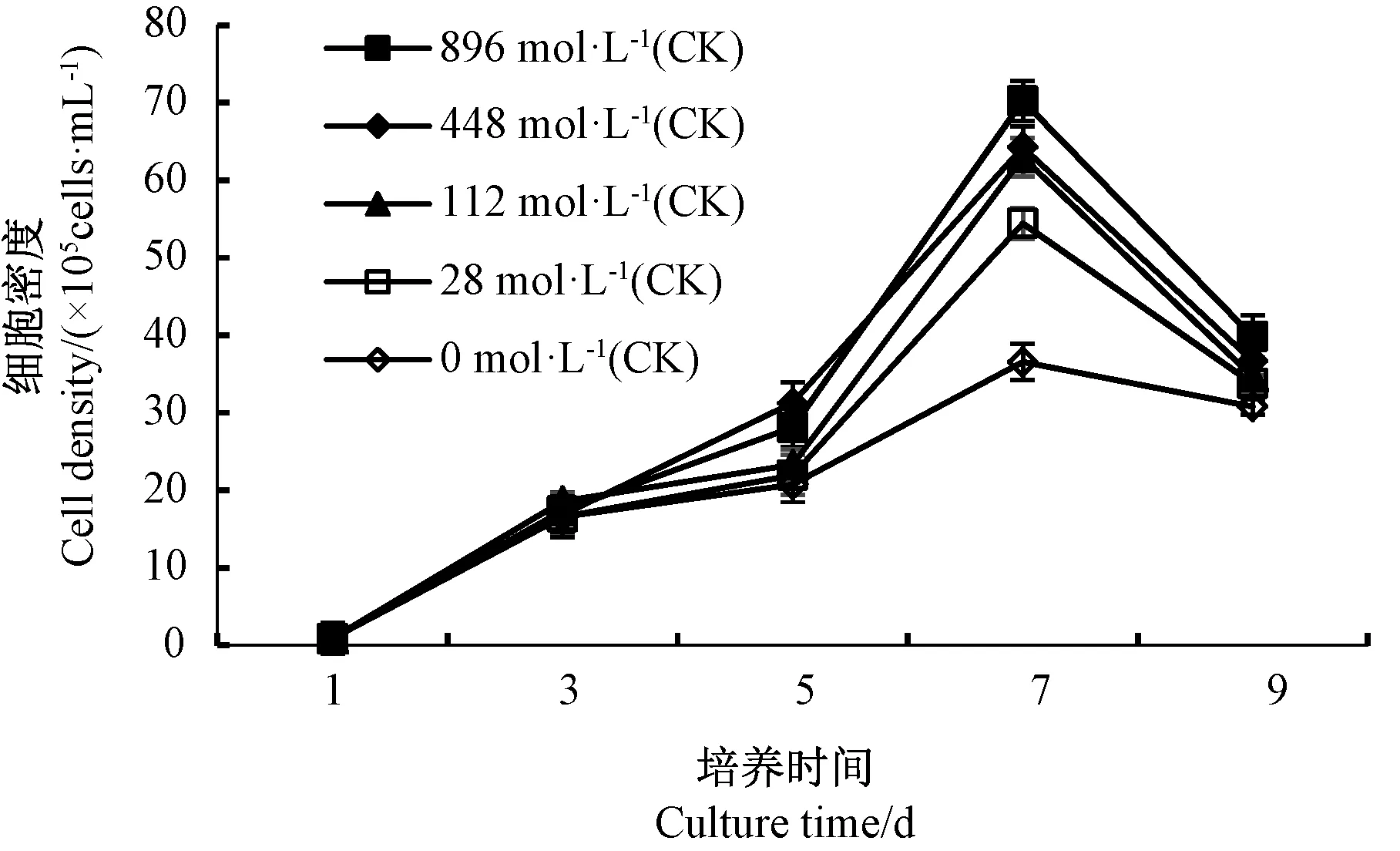
图1 不同氮浓度对三角褐指藻细胞生长的影响Fig.1 Effects of different nitrogen concentration on the cell growth of P.tricornutum

图2 不同氮浓度对三角褐指藻细胞密度的影响(7 d)Fig.2 Effects of different nitrogen concentration on the cell density of P.tricornutum(7 d)
由图3可知,随着氮浓度的降低,各处理岩藻黄素含量呈先下降后上升的趋势,且各处理的岩藻黄素含量与CK 相比均极显著降低,氮浓度为112 μmol·L-1时,三角褐指藻岩藻黄素含量最低,为 0.084 mg·g-1DW,较CK(0.731 mg·g-1DW)降低了88.5%;而在氮浓度为28、0 μmol·L-1时,岩藻黄素含量有所上升,分别为0.139 和0.147 mg·g-1DW,但较CK 降低了81.0%和79.9%。 表明低氮浓度对岩藻黄素的合成有一定限制作用,且不同低氮浓度将导致岩藻黄素合成的限制出现波动变化。
2.3 氮元素对三角褐指藻油脂含量的影响
由图4可知,随着氮浓度的下降,三角褐指藻的油脂相对含量呈先上升后下降的趋势,且各处理的油脂相对含量均极显著高于CK,氮浓度为112 μmol·L-1时,三角褐指藻相对油脂含量最高,为2.76,较CK(1.17)提高了1.36 倍,表明低氮浓度能极显著促进脂类物质的合成。

图3 不同氮浓度对三角褐指藻岩藻黄素含量的影响Fig.3 Effects of different nitrogen concentration on the fucoxanthin content in P.tricornutum

图4 不同氮浓度对三角褐指藻油脂相对含量的影响Fig.4 Effects of different nitrogen concentration on the relative content of lipid in P.tricornutum
2.4 氮限制条件下三角褐指藻岩藻黄素与油脂含量的相关性分析
由图5可知,三角褐指藻岩藻黄素含量与油脂相对含量显著相关(P<0.05)(R2=0.998 8),当岩藻黄素的积累量因氮浓度不同出现下降(0.147、0.139、0.084 mg·g-1DW)时,油脂的积累量呈曲线上升,与岩藻黄素积累量对应的相对含量分别为1.583、1.613、2.759;而当岩藻黄素的积累量(0.365、 0.731 mg·g-1DW)上升时,油脂相对含量呈下降趋势。
2.5 氮元素对三角褐指藻叶绿素a 含量的影响
由图6可知,氮限制对三角褐指藻叶绿素a 含量合成有抑制作用。 氮限制处理组叶绿素a 含量均极显著低于CK,且随着氮限制的增强,叶绿素a 含量呈先下降后上升的趋势,与岩藻黄素含量的变化趋势一致,表明氮限制影响光合作用。
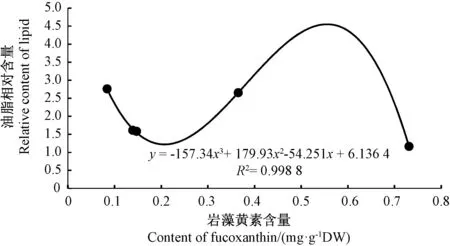
图5 岩藻黄素含量与油脂相对含量的相关性分析Fig.5 Correlation analysis of content of fucoxanthin and relative content of lipid

图6 不同氮浓度对三角褐指藻叶绿素a含量的影响Fig.6 Effects of different nitrogen concentration on content of chlorophyll a in P.tricornutum
2.6 氮元素对三角褐指藻岩藻黄素和油脂合成相关基因表达的影响
采用荧光定量PCR 技术研究氮限制下三角褐指藻岩藻黄素生物合成途径相关基因(FCPb)和油脂生物合成途径相关基因(FAB2)的表达水平,结果表明,氮限制处理的三角褐指藻中FCPb的表达量均极显著低于CK(图7-A),表明氮限制极显著下调了三角褐指藻岩藻黄素生物合成途径相关基因FCPb,其中氮浓度为28 μmol·L-1时三角褐指藻中FCPb的表达量最低,为CK 的0.22 倍;而氮限制处理组的三角褐指藻中FAB2 的表达量均明显高于CK(图7-B),表明氮限制上调了三角褐指藻油脂生物合成途径相关基因FAB2的表达,且氮浓度为448、28 μmol·L-1时的FAB2 表达量均极显著高于CK,其中氮浓度为448 μmol·L-1时,FAB2 的表达量最高,为CK 的13.2 倍。

图7 不同氮浓度对三角褐指藻FCPb(A)基因和FAB2(B)基因表达的影响Fig.7 Effects of different nitrogen concentration on the relative expression of genes of FCPb(A)and FAB2(B)in P.tricornutum
3 讨论
氮是植物生长必需的大量元素,其供应量影响细胞的生理作用,决定藻细胞的生长速度和各种生物成分如脂类、色素、萜类、糖类等物质的含量和组成[17]。如李涛等[22]发现在氮浓度为3.5 mmol·L-1时,产油绿球藻的分裂生长受到抑制;Lundgren 等[23]研究发现,氮缺乏时,小定鞭金藻死亡率提高。 本研究也发现,在氮限制的条件下,低氮浓度对三角褐指藻的生长具有一定的抑制作用,完全缺氮条件下的藻细胞密度明显低于正常条件,比正常条件(氮浓度为896 μmol·L-1)降低了49.7%,其原因可能是,细胞缺少主要的营养来源,导致细胞的生长率、代谢率降低,即表现为细胞数降低和细胞周期变长。
岩藻黄素属于硅藻次生代谢产物中的萜类物质,是一种参与光合作用、辅助采光色素的类胡萝卜素[24]。 杨莹等[25]以不同浓度的蛋白胨作氮源培养蛹虫草发现,一定浓度范围蛹虫草体内类胡萝卜素含量随着氮浓度增加而增加,蛋白胨浓度为1%时类胡萝卜素含量最高,表明氮浓度影响类胡萝卜素的合成。郭丽丽等[26]研究发现萜类物质甲羟戊酸途径中的第一个限速酶3-羟基-3-甲基戊二酰CoA 还原酶(3-hydroxy-3-methylglutaryl-Co A reductase,HMGR)基因的表达量随着氮浓度的增加呈先升高后降低的趋势,从而导致人参皂苷含量出现相同的变化,即在氮浓度为20.0 mg·L-1时表达量最高。 本研究中,岩藻黄素含量随着氮限制增强,整体极显著下降,表明低氮浓度抑制次生代谢途径中岩藻黄素的合成,这与前人研究一致。
研究表明,缺氮会加速多种蛋白的降解,有利于氨基酸的重新利用,提高脂肪酸合成途径相关酶的表达[27]。 Breuer 等[28]研究发现氮饥饿对9 株微藻甘油三酰基积累有促进作用。 此外,还有研究表明,面临氮利用率降低时,微藻细胞可能会吞噬细胞周围的胞外物质,如碎片或者细菌等其他生物体,以获得额外的氮元素,从而增加脂质含量的积累[29-30]。 本研究也发现,氮限制条件下,油脂积累量增加,同时脂肪酸去饱和酶基因FAB2 表达上调。
Nomura 等[31]发现褐藻中的总脂肪酸含量随温度和光照变化波动较大,但在春冬季节,总脂含量有所提高,且岩藻黄素、 n-3 多不饱和脂肪酸( n-3 polyunsaturated fatty acids,n-3 PUFAs) 和岩藻甾醇(fucosterol)含量最高。 而吴琼芳[32]研究表明,氮浓度为4.5 和3.6 mmol·L-1时,衣藻的油脂在短时间内迅速累积,最高可达0.093 1 g·L-1·d-1,而类胡萝卜素、叶绿素a 以及叶绿素b 含量均呈快速上升后缓慢下降最终趋于平稳的趋势。 由此可见,氮胁迫下类胡萝卜素含量与油脂积累量的变化趋势在短时间内一致,随后趋势相反。 Matsumoto 等[33]采用测试油乳化剂对小鼠进行十二指肠灌注研究,发现岩藻黄素和岩藻黄质醇(2 mg)在小鼠体内抑制了脂肪酶活性,4 h 内降低了肠道对近50%的甘油三酯的吸收量。 Tsukui 等[34]研究指出,岩藻黄素可使小鼠体内的不饱和脂肪酸代谢途径发生改变,使去饱和脂肪酸如二十二碳六烯酸、花生四烯酸等在体内的含量增加。 表明岩藻黄素影响了动物体内油脂的正常代谢,导致油脂物质发生不同方向的转化。 同时,本研究也发现低氮胁迫使三角褐指藻中岩藻黄素含量下降到最低,极显著低于对照,而油脂含量却较对照提高了1.36 倍。 推测在微藻脂质与岩藻黄素代谢合成途径中,岩藻黄素与油脂之间可能存在一定的相互作用,但准确的结论还有待进一步研究。
李小梅等[35]研究发现氮、磷限制会导致三角褐指藻细胞中叶绿素a 含量明显下降,但对叶绿素c 含量没有明显影响,本研究也发现,在氮限制条件下,叶绿素a 含量出现不同程度的下降。 研究表明,在氮限制条件下,叶绿素a/b 的比例无明显变化,同时,总叶绿素的合成速率降低,细胞叶绿素积累量大幅度下降,其主要原因是氮限制下细胞为保护结构和功能,迫使叶绿素a 等合成下降,降低光捕获[36]。 叶绿素a 含量与岩藻黄素的增减趋势一致,当植物受到超过最大光合效率的光强照射时,植物细胞内天线系统(类胡萝卜素与叶绿素形成的聚光复合物)遭到淬灭,发生非化学损伤[37]。 Zhang 等[38]研究氮限制下的小球藻发现,氮胁迫藻中光系统受到损伤,抑制光合作用的正常进行;Longworth 等[39]利用iTRAQ 技术直接测得氮胁迫下三角褐指藻中叶绿体-岩藻黄素蛋白a/c(FCP)、ATP 合酶、PSI、PSII 和细胞色素c 等光合电子传递系统蛋白合成数量下降,同时采光蛋白光合及二磷酸核酮糖羧化酶的相对丰度均降低。 因此,结合本研究结果,可推测氮胁迫造成了三角褐指藻中光合途径光系统损伤,这种损伤可能直接影响关键蛋白FCP 的合成,导致FCP 复合体合成下降,同时FCP 复合体主要组成成分——岩藻黄素与叶绿素a 含量也随之发生同趋势下降。
郭雪洁[12]研究发现在低温和盐胁迫下,随着温度的降低和盐浓度的增加,衣藻中FAB2 的表达量有一定程度的升高;同时Tasseva 等[40]也证实甘蓝油菜中FAB2 基因在低温条件下表达上调,导致FAB2 蛋白含量增加; Gundermann 等[41]发现高光照强度条件(140 μE·m-2·s-1)培养藻细胞,能提高藻的光合作用,同时三聚体FCPa 和寡聚体FCPb 中岩藻黄素的含量均有所增加,即光照有利于FCP 复合物中岩藻黄素的合成;徐才哲等[9]研究证实Fcpb基因的表达产物复合体中富含岩藻黄素,能调控微藻的光合功能。 上述研究表明温度、盐分等环境胁迫可提高FAB2 的表达调控,从而促进脂类物质在植物体内的合成。 本研究发现在低氮浓度下脂类物质和岩藻黄素合成从基因水平上受到氮胁迫调控,氮浓度可能介导了细胞膜或者细胞内信息的传递,导致细胞核中基因表达发生改变,从而影响代谢通路物质的变化以应对外界环境的刺激。
4 结论
本研究结果表明,低氮浓度抑制了三角褐指藻的生长;在一定范围的低氮浓度下,三角褐指藻的岩藻黄素含量极显著下降,而油脂含量极显著升高,岩藻黄素含量与油脂含量之间存在显著的相关性,且岩藻黄含量的降低与其复合体基因FCPb表达下调一致,油脂含量的升高与其关键酶基因FAB2 表达上调一致。 通过氮元素调控岩藻黄素合成基因与油脂合成基因的表达,可选取适宜的氮浓度促进岩藻黄素生产和油脂积累。 本研究结果为岩藻黄素和油脂合成的研究提供了一定的理论依据。

