全脑缺血再灌注诱导大鼠海马CA1区Trx巯基去亚硝基化机制的研究
杨红宁,吕兰欣,颜晓庆,韩 东,胡书群,许 铁
一氧化氮(nitric oxide, NO)是一种脂溶性、可扩散的、小分子气体信号分子,同时也是一种弱自由基,在调节生理和病理生理活动中起重要作用[1-3]。早期研究表明NO对细胞内生物活动的调节主要通过NO/cGMP途径,即NO诱导cGMP的产生,进而调节蛋白激酶G的活性,影响生物体的活动[4-5]。近来文献表明NO通过蛋白质巯基亚硝基化/去亚硝基化的机制来发挥作用,蛋白质巯基亚硝基化/去亚硝基化作为一种可逆性蛋白质翻译后修饰、调节不同的信号转导通路,进而影响许多细胞的功能[1,6]。
脑缺血再灌注损伤的发病机制假说包括钙超载、谷氨酸兴奋毒性及氧自由基学说。谷氨酸受体分为代谢型谷氨酸受体(metabotropic glutamate receptors, mGluRs)和离子型谷氨酸受体(ionotropic glutamate receptors, iGluRs)。iGluRs根据其所首选的配体不同可分为NMDA受体、AMPA受体和KA受体[7-8]。脑缺血再灌注损伤中,神经细胞内的nNOS活性增强,产生大量的NO,能够对神经细胞产生损伤作用[9-11]。
Trx(thioredoxin)在正常生理状态下其本身是亚硝基化的,全脑缺血再灌注后Trx巯基发生去亚硝基化[12-14]。本研究主要采用大鼠全脑缺血再灌注不同的时间来探讨全脑缺血再灌注诱导Trx巯基去亚硝基化的最佳复灌时间,以及外源性NO供体GSNO(S-nitrosoglutathione)和SNP(sodium nitroprusside)在全脑缺血再灌注后Trx的去亚硝基化机制中的作用,并用焦油紫染色进一步验证外源性NO供体GSNO和SNP是否能对全脑缺血再灌注导致的神经元损伤有保护作用。现报道如下。
1 材料和方法
1.1 试剂与器材试剂:GSNO购自Sigma公司,SNP购自徐州市中心医院,Trx抗体购自Santa Cruz公司,其他试剂为国产分析纯。器材:电动匀浆器购自美国Glas-Col公司,全波长酶标仪购自美国Molecular Device公司,蛋白电泳及电转移装置购自美国Bio-Rad公司,图像处理仪购自美国Gene公司,大鼠脑立体定位仪购自美国STOLTING公司。
1.2 实验动物购自徐州医科大学实验动物中心的雄性成年无特定病原体(specific pathogen free,SPF)级SD大鼠,体质量250~300 g,随机分为假手术组(Sham组)、全脑缺血再灌注组(I/R组)、腹腔注射组(SNP组)、侧脑室注射(GSNO组)及溶剂对照组(生理盐水组腹腔注射/侧脑室注射),每组各6只。
1.3 实验方法
1.3.1 模型及样品制备采用四动脉结扎法制备大鼠全脑缺血再灌注模型,以20%水合氯醛(300~350 mg·kg-1)腹腔注射麻醉后,分离双侧颈总动脉,电凝椎动脉。手术第2天动物于清醒状态下结扎双侧颈总动脉,全脑缺血15 min。假手术组只进行颅部手术的皮肤切口,然后缝合。GSNO组(每千克体质量动物0.1 mg,药物溶于生理盐水,于缺血前20 min侧脑室注射),SNP组(SNP溶解于生理盐水中,以5 mg·kg-1的剂量分别于缺血前30 min、缺血后40 min和130 min腹腔注射给药,即每两次给药之间相隔90 min)。溶剂对照组注射等量溶剂生理盐水。全脑缺血复灌注后,断头取脑,分离双侧海马CA1区,加匀浆缓冲液后匀浆离心取上清液,用BCA微量法测定蛋白浓度。
1.3.2 蛋白巯基亚硝基化测定用生物素转化法(Biotin-Swich method)[11]测定蛋白亚硝基化:用HEN液(250 mmol·L-1HEPES-NaOH,pH 7.7,1 mmol·L-1EDTA,0.1 mmol·L-1neocuproine)匀浆,1 000 g 4 ℃离心10 min,取上清;测蛋白,计算蛋白浓度,转变为统一浓度0.8 mg·mL-1,每次取0.8 mg分装蛋白,用HEN液补充至1 mL;向分装的蛋白中加10% CHAPS至终浓度为0.4%,再加4倍体积Blocking buffer,置于50 ℃ 20 min,不断摇匀;加2倍体积丙酮放入-20 ℃,20 min到30 min后2 000 g 4 ℃离心10 min,弃上清;加HENS液(250 mmol·L-1HEPES,pH 7.7,1 mmol·L-1EDTA,0.1 mmol·L-1neocuproine,1% SDS) 0.1 mL·mg-1重悬,转入EP管中,加Biotin-HPTP(4 mmol·L-1),即labeling solution,体积为重悬液的1/3,再加Ascorbate solution,体积为重悬液的1/5,25℃水浴1 h;加2倍体积的冰丙酮放入-20 ℃ 20 min,2 000 g 4 ℃离心10 min,弃上清;加HENS液,0.1 mL·mg-1,重悬,加2倍体积的中和液(20 mM HEPES-NaOH,pH 7.7,100 mmol·L-1NaCl,1 mmol·L-1EDTA,0.5% TritonX-100),再加15 μl·mg-1Steptavidin-Agarose,冷库旋转混匀1 h;每管加0.5~0.6 mL(600 mM NaCl)中和液洗5次,800 g×1 min,4 ℃离心;用洗脱液(20 mmol·L-1HEPES-NaOH,pH 7.7,100 mmol·L-1NaCl,1 mmol·L-1EDTA和100 mmol·L-12-巯基乙醇)加4×sample buffer,混匀煮沸5 min,冷却待用。
1.3.3 免疫印迹等量蛋白样品经10% SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,以湿转法电转移至NC膜上。转移后的NC膜经3% BSA封闭后加入不同的稀释好的一抗,4 ℃过夜。洗膜后加入相应的二抗(羊抗兔IgG-AP 或羊抗鼠IgG-AP或驴抗羊IgG-AP),37 ℃反应2 h。洗膜。曝光法显色,结果以图像处理仪(Gene Company)分析处理,并以LabWorks软件分析处理,各条带的吸光值(O.D值)以同一张膜上假手术组的倍数表示。
1.3.4 焦油紫染色大鼠腹腔注射水合氯醛麻醉,4%的多聚甲醛快速灌注后,大鼠断头取脑。4%多聚甲醛固定,常规包埋与切片。按焦油紫染色说明书染色,中性树脂封片。在高倍镜下观察海马CA1区神经元,有清楚的细胞核,胞体着色良好的计为成活神经元,成活神经元密度以1 mm长度内成活锥体神经元的数量表示。
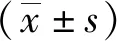
2 结果
2.1 复灌6 h Trx巯基去亚硝基化程度最高全脑缺血后复灌注不同时间组相比,Trx巯基亚硝基化水平在复灌6 h时最低(P<0.05),见图1。证明大鼠全脑缺血再灌注诱导Trx去亚硝基化的最佳复灌时间为6 h。
①与其他组相比差异有统计学意义(P<0.05)。图1 Trx去亚硝基化水平电泳图
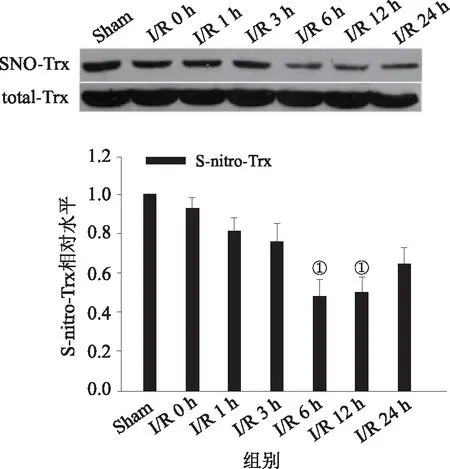
2.2 GSNO、SNP抑制Trx巯基去亚硝基化与I/R组相比GSNO组和SNP组Trx的亚硝基化水平明显增高(P<0.05),见图2A、B。证明外源性NO供体能够抑制全脑缺血再灌注导致的Trx去亚硝基化。
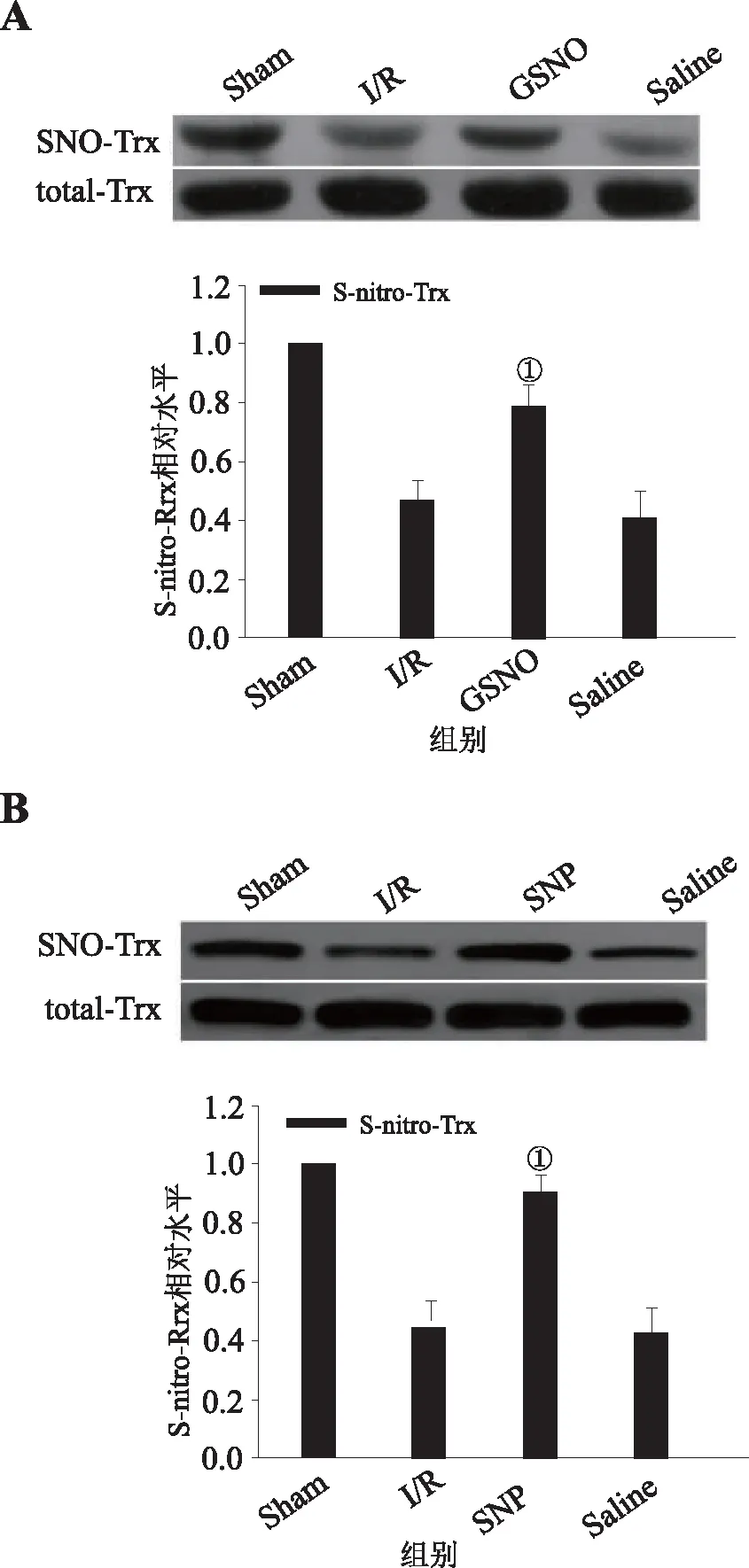
2.3 GSNO和SNP组海马神经元迟发性死亡情况用焦油紫染色来检测脑缺血再灌注刺激后锥体细胞的存活情况。在Sham组,正常的锥体细胞显示出圆形淡着色的细胞核(图3 a, f),而在I/R组,死细胞呈现出固缩的细胞核,呈皱缩浓密的不规则状(图3 b, g)。与I/R组相比,GSNO组(图3 c, h),SNP组(图3 d, i)神经元锥体细胞的死亡明显减少,差异有统计学意义,而溶剂对照组(图3 e, j)则与I/R组相比无统计学意义,见图4。说明GSNO,SNP能够减少CA1区神经元损伤,对神经元有保护作用。
①与I/R组相比差异有统计学意义(P<0.05)。A:GSNO组;B:SNP组图2 Trx去亚硝基化水平电泳图
3 讨论
蛋白质巯基亚硝基化和去亚硝基化,是蛋白质功能动态调控中的一种重要翻译后修饰,在调节生理和病理情况下的蛋白酶活性中起着重要的作用,能够调节不同的信号转导通路进而影响许多细胞的功能[6]。蛋白质半胱氨酸巯基被NO修饰发生亚硝基化,是信号转导中一种常见的机制[15-17]。蛋白质的亚硝基化/去亚硝基化可以影响到蛋白的活性、稳定性。酶原的降解、酶的活性位点的暴露、功能蛋白活性位点的修饰都可以与亚硝基化修饰有关[18-20]。Trx是一种重要的具有蛋白还原酶活性的抗氧化蛋白,五半胱氨酸残基在32、35、62、69、73位,是一种抗凋亡蛋白,因为它能够抑制凋亡体前蛋白[8]。Trx的氧化还原调控和抗凋亡功能依赖69位半胱氨酸的S-亚硝基化。Trx在正常的生理状态下是亚硝基化的,Trx能够清除活性氧和维持其自身的氧化还原调控功能,有助于抗凋亡,而全脑缺血再灌注诱导Trx发生去亚硝基化对神经元造成了损伤[21]。本研究采用大鼠四动脉结扎法造模,从本研究中可以看出,全脑缺血再灌注后Trx发生巯基去亚硝基化,并且在复灌6 h时Trx的去亚硝基化程度最高。
图3 各组缺血再灌注后锥体细胞存活情况
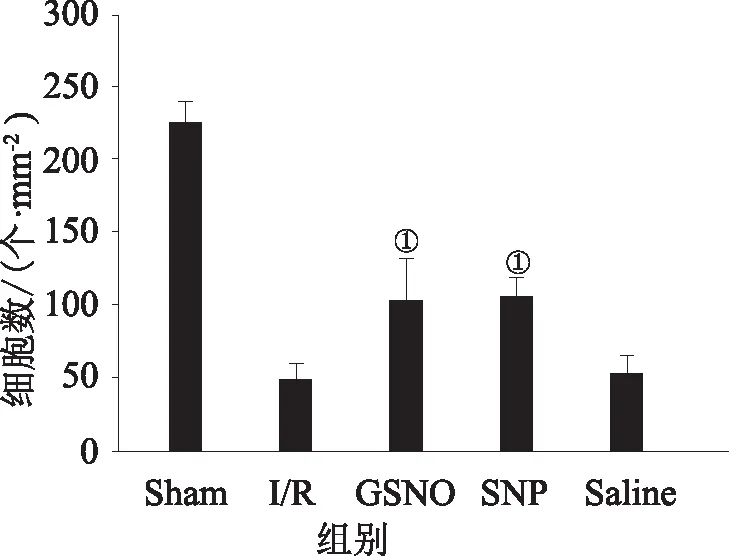
①与I/R组相比差异有统计学意义(P<0.05)。图4 各组缺血再灌注后细胞存活情况比较
越来越多的数据表明,NO能够调节蛋白质巯基的亚硝基化修饰,即在电子受体的存在下可以与蛋白质巯基发生反应,形成巯基—亚硝基化蛋白(SNO蛋白)。因此,本研究中给予了NO供体GSNO和SNP,来研究外源性NO供体是否能够抑制全脑缺血诱导的Trx去亚硝基化,对细胞有保护作用。本研究结果显示,全脑缺血再灌注后Trx发生明显的去亚硝基化,而外源性NO供体GSNO和SNP能够减弱这种变化,通过焦油紫染色进一步证实外源性NO供体能够抑制Trx去亚硝基化,对脑缺血损伤的神经元具有保护作用。
本研究初步揭示了Trx去亚硝基化影响神经元损伤的机制,为后续研究Trx去亚硝基化对神经元损伤的下游神经通路提供了基础,也为研究卒中疾病的作用机制提供了新的理论基础。

