沉默STAT1对肠道病毒71型感染THP-1细胞的初步探讨
李园园,史伟峰,江 涛,许德英
肠道病毒71型(enterovirus 71,EV71)是引起手足口病最主要的病原体之一,除引起手足口病外,还能导致严重的中枢神经系统并发症,已居丙类传染病的首位,且呈上升趋势,死亡率高。我国研制的首批EV71疫苗已于2016年上市,为控制暴发和流行提供了有效手段[1]。然而,针对EV71的治疗仍以对症治疗为主,目前尚无理想有效的抗病毒药物。蛋白酪氨酸激酶和信号转导与转录激活因子(janus kinase/signal transducers and activators of transcription,JAK/STAT)信号通路是机体固有免疫反应的必要条件,与病毒性疾病的发生密切相关[2-5]。已有报道,EV71感染人横纹肌肉瘤细胞(rhabdomyosarcoma,RD)和THP-1细胞,JAK/STAT信号通路的反应不同[6]。本研究拟在分析EV71感染THP-1细胞后,STAT1、ISGs的表达及沉默STAT1对ISGs转录、EV71/VP1复制的影响,探讨STAT1在EV71感染中的作用和相关机制,为EV71的治疗寻找新的靶点提供依据。现报道如下。
1 材料与方法
1.1 材料人单核巨噬细胞(THP-1)和293T细胞由中国科学院上海生命科学研究院细胞资源中心提供。STAT1、p-STAT1(signalway antibody);HRP标记的二抗(Santa Cruz公司);GAPDH和相应HRP标记的二抗(ProteinTech公司);β-action、Anti-Enterovirus 71 VP1 antibody和相应HRP标记的二抗(Abcam公司); Trizol试剂(Invitrogen公司),逆转录和实时荧光定量PCR试剂盒(TaKaRa公司);ABI7500实时荧光定量PCR仪(美国ABI公司)。
1.2 方法
1.2.1 细胞培养THP-1细胞用含10%FBS的RPMI-1640培养基为基础培养基,于37 ℃5% CO2培养箱中培养,THP-1细胞密度达到5×106时采用半定量换液或离心换液传代培养,细胞密度不能超过1×107。293T细胞以含10%FBS的DMEM培养基为基础培养液,每2~3 d传代1次,传代时弃掉培养基,用0.25%胰酶消化细胞,于37 ℃5% CO2培养箱中培养,取对数生长期的细胞进行试验。
1.2.2 shRNA慢病毒的包装、浓缩与病毒滴度测定293T细胞密度约70%~80%时采用磷酸钙法包装慢病毒,转染前4 h对细胞进行换液,辅助质粒pSpAX2 3.2 μg 、PMD-2G 1.8 μg和包装质粒shSTAT1 5 μg加入超纯水至450 μL,混合均匀。将CaCl250 μL加入至含有质粒的离心管中。将质粒—CaCl2混合物加入至含有500 μL 2×HBS的离心管中,混匀后缓慢滴入培养皿中,转染后16 h换液,48 h、72 h后收获上清液,12 000 r·min-1离心5 min,用0.45 μm滤膜过滤,去掉细胞碎片沉渣。为了提高慢病毒的滴度,采用4 ℃超速离心机20 000 r·min-1离心90 min将慢病毒浓缩。采用流式细胞仪法测定病毒滴度,利用载体共表达的绿色荧光蛋白表达(GFP)在流式仪上进行分析,计算表达荧光细胞的比例。病毒滴度的计算公式为:TU/mL=细胞数(以铺时计,1×105)×荧光表达比例×103/慢病毒的体积(μL)。按照使用量分装至EP管中置于-80 ℃保存。
1.2.3 重组shRNA慢病毒转染THP-1细胞接种处于生长对数期的THP-1细胞到12孔细胞培养板,每孔1 mL细胞密度为2×105·mL-1。设对照组和干扰组。根据细胞数量和制备的空载体病毒及干扰载体病毒滴度,以不同感染复数感染THP-1细胞,同时加入8 μg·mL-1的多聚凝胺(polybrene),同时感染4个复孔。感染24 h后离心换液,将4个复孔的细胞至6孔板内,每孔加入1 mL RPMI1640+10%FBS培养基,置37 ℃5%CO2继续培养。感染后72 h,提取总RNA和蛋白。
1.2.4 qRT-PCR采用TRizol法裂解细胞并提取总RNA。按照逆转录试剂盒(TaKaRa)说明书将RNA逆转录成cDNA,用于荧光定量PCR。相关引物序列见表1。独立重复试验3次,每次每个样本每个基因作3个复孔,采用经典的2-ΔCt计算相对表达量,ΔCt =(Ct目的基因-Ct内参基因)实验-(Ct目的基因-Ct内参基因)对照。

表1 引物序列
1.2.5 western blot收集对照组(0 h)和各实验组2、4、8、12、16和24 h的细胞,0 h未感染EV71,实验组EV71(MOI=5)感染细胞2、4、8、12、16和24 h,离心收集细胞,加入含PMSF的IP细胞裂解液,冰上裂解40 min,12 000 r·min-1,离心5 min,收集上清,采用BCA法测定总蛋白浓度。以每孔40 μg的蛋白量加样至10% SDS-PAGE凝胶电泳分离蛋白质,再将胶中的蛋白通过电转移槽转印至PVDF膜上。经含5%脱脂奶粉的TBST缓冲液室温封闭2 h,1∶1 000稀释加入一抗,4 ℃孵育过夜。TBST振荡洗膜后加入HRP标记的二抗,室温孵育1 h。TBST洗膜后采用ECL发光液进行化学发光反应,暗室曝光,显影。
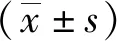
2 结果
2.1 EV71激活IFN-β和ISGs的转录EV71(MOI=1和MOI=5)感染THP-1细胞后8 h、24 h,细胞内IFN-β mRNA的表达量均上调,与对照组(未感染EV71)相比,差异有统计学意义(P<0.05)(图1A和图1B)。与对照组(未感染EV71)相比,EV71感染8 h时,MXA、OAS1、ISG56这3种ISGs mRNA的相对表达量分别上调了约11.6、11.2和17.3倍,且这种上调具有统计学意义(P<0.05);EV71感染24 h时,MXA、OAS1、ISG56这3种ISGs的表达量与8 h相比分别下降了4.4、4.6和9倍,具有统计学意义(P<0.05),而当EV71以MOI=5感染细胞8 h时,ISG15的表达量明显上调(P<0.05)(图1C和图1D)。
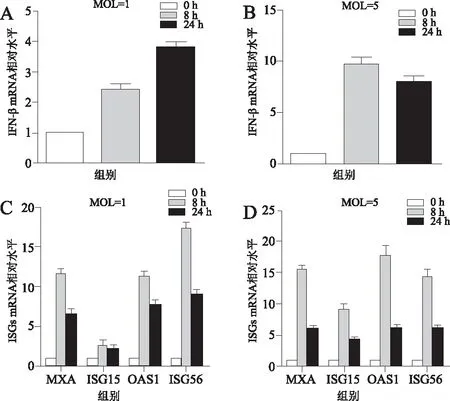
图1 EV71激活IFN-β和ISGs的转录
2.2 EV71感染促进STAT1的磷酸化EV71(MOI=5)感染 THP-1细胞,随着病毒感染时间的延长(2、4、8、12、16和24 h),STAT1和p-STAT1的表达量呈依次增加趋势,具有时间依赖性,与未感染EV71组相比,STAT1和p-STAT1的蛋白水平均明显提高,见图2。
2.3 特异性靶向STAT1的shRNA对THP-1细胞中STAT1蛋白表达的抑制作用采用特异性靶向STAT1的shRNA包装慢病毒,感染THP-1细胞,48 h后,提取细胞总蛋白,Western blot印迹检测STAT1蛋白水平。结果显示:与对照组相比, shSTAT1-256能显著抑制STAT1蛋白表达水平,见图3。因此选取shSTAT1-256用于后续实验。
2.4 沉默STAT1基因对ISGs及EV71/VP1表达的影响慢病毒感染THP-1细胞并加入8 μg·mL-1的polybrene,增加干扰效率,得到THP-1-shRNA-STAT1和THP-1-shRNA-CON077细胞系,72 h后,Western blot结果显示:与对照组相比,shRNA-STAT1感染的THP-1细胞组STAT1蛋白水平明显降低(图4A)。慢病毒shRNA-STAT1感染的THP-1细胞,经EV71感染24 h时,与对照组相比,STAT1、p-STAT1和VP1的蛋白表达量下降(图4B),MXA、OAS1、ISG56的mRNA表达量均下调(P<0.05),VP1mRNA的表达量也下调(图4C)。
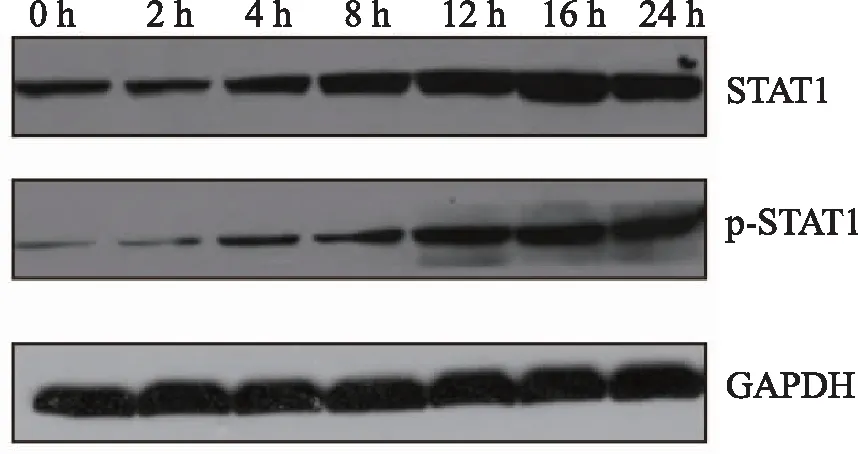
图2 EV71感染激活了STAT1的磷酸化
图3 2种shRNA对STAT1蛋白干扰效率的影响
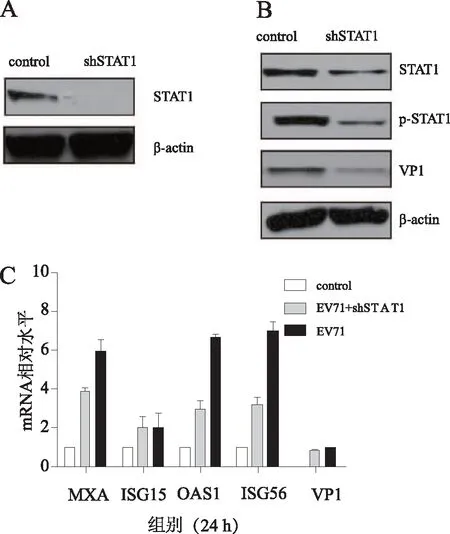
A:shRNA-STAT1感染后;B:经EV71感染24 h后;C:EV71感染24 h后mRNA表达。图4 沉默STAT1基因对ISGs及EV71/VP1表达的影响
3 讨论
手足口病感染具有全球性,我国每年均有发生,发病率约为37.01/10万~205.06/10万,死亡率约为6.46/10万~51.00/10万,严重危害儿童健康,但是其致病机制仍在进一步研究。在病原微生物感染早期,固有免疫反应通过识别人类清道夫受体和P-选择素糖蛋白配体-1等,激活一系列信号通路,对病毒的抑制和清除发挥重要作用[8]。
STAT1是STAT家族中最早发现的成员,具有广泛的生物学作用,抑制肿瘤生长、促进肿瘤细胞的凋亡、参与固有免疫反应等。病毒感染机体时,促进STAT1的活化发挥抗病毒作用,已有报道新城疫病毒的V蛋白、埃博拉病毒的VP24蛋白作用于STAT1磷酸化修饰在干扰素信号通路中发挥作用[9],而STAT1乙酰化、泛素化、甲基化等不同修饰影响干扰素抑制乙肝病毒复制的作用[10]。研究发现戊型肝炎病毒(hepatitis E virus,HEV)的氨基末端区域可以抑制STAT1的转录和磷酸化调控干扰素反应[11],而有体外实验表明,STAT1缺乏时细胞不能应答IFN-α和IFN-β的刺激,对病原微生物极其敏感。THP-1细胞是人体的单核巨噬细胞,具有免疫效应,在STAT-1缺乏的THP-1内,对EV71感染的机制还不明确,本研究采用慢病毒介导的shRNA干扰技术,沉默THP-1细胞的STAT1,探讨EV71感染沉默STAT1的THP-1细胞,干扰素刺激基因的变化及对病毒复制的影响。
采用EV71(MOI=1和MOI=5)感染THP-1细胞,PCR结果(图1)显示ISGs和IFN-β的表达量上调,Western blot结果(图2)表明STAT1和STAT1磷酸化水平上调,这些结果提示EV71促使THP-1细胞内STAT1入核,激活ISGs和IFN-β的表达,与报道的EV71感染的vero细胞内IFN-β产生被抑制不同,不同的细胞对EV71感染反应不同[2]。由于THP-1细胞是悬浮细胞,传统的RNAi技术干扰效率低,因此本研究设计shRNA-STAT1,磷酸钙法包装慢病毒,经超速离心法浓缩后,流式细胞仪测定慢病毒滴度。慢病毒感染THP-1细胞24 h后,与对照组相比,STAT1表达下调(图3A)。EV71感染24 h后,STAT1、p-STAT1、VP1和ISGs mRNA表达量下降(图3B、图3C)。本研究表明干扰THP-1细胞内STAT1, EV71感染抑制STAT1的入核、转录,且STAT1缺乏使EV71复制降低,这与已报道的STAT1缺乏,对EV71的易感性增加不同[12],猜测原因可能为THP-1细胞是免疫细胞有关,也有可能其他分子、信号通路参与其中,此信号通路并不是抑制EV71感染的最有效通路。研究表明AKT/IRF3信号通路产生的Ⅰ型干扰素及抗病毒基因成为水性口炎病毒、新城疫病毒和单纯疱疹病毒等病毒性疾病的潜在治疗角色[3],许多信号通路被报道参与抑制EV71的复制如:RLR信号通路中USP4蛋白的泛素化[13]、p38MA PK信号通路[14]、NF-KB信号通路[15]、TOLL样受体3等[16]。而JAK/STAT信号通路在EV71感染中的具体详细分子机制、信号通路有待进一步研究。
EV71病毒基因的变异性使手足口病的防控形势更加严峻,应用RNAi技术阻断STAT1入核,有望为EV71的治疗提供新的途径。

