CYP2C19基因多态性与PCI术后氯吡格雷治疗患者血小板功能、炎性指标及病情转归的相关性
吴铮,李文铮,王长华,程姝娟, 柳景华
经皮冠状动脉介入(PCI)是治疗冠心病的有效手段,能够改善患者的临床症状,但部分患者于PCI术后血小板仍可聚集出现再栓塞,进而影响病情的远期转归。氯吡格雷联合阿司匹林是PCI术后常规的抗血小板治疗方式,能够抑制血小板聚集、降低血栓形成的风险[1]。尽管如此,仍有部分患者在PCI术后接受抗血小板药物治疗后继续出现血小板聚集,严重者形成支架内血栓。近年来关于抗血小板药物的研究认为,氯吡格雷进入体内后不直接发挥抗血小板作用,而是需要通过CYP2C19基因编码的细胞色素P450将该药物代谢为有抗血小板活性的形式,进而发挥抑制血小板聚集的作用。在该过程中,CYP2C19基因的多态性直接影响了编码产物的催化功能,进而导致氯吡格雷抗血小板效应发生改变[2-3]。为了明确CYP2C19基因多态性对氯吡格雷抗血小板治疗效果的影响,本研究具体分析了CYP2C19基因多态性与PCI术后患者氯吡格雷治疗血小板功能、炎性反应及病情转归的相关性,报道如下。
1 资料与方法
1.1 临床资料 选择2017年1—4月首都医科大学附属北京安贞医院心内科接受PCI及术后氯吡格雷、阿司匹林抗血小板治疗的冠心病患者204例作为研究对象,根据CYP2C19基因多态性分为野生型患者93例、杂合突变型患者57例、纯合突变型患者54例。3型患者一般资料比较差异无统计学意义(P>0.05),具有可比性,见表1。本研究经医院伦理委员会审批通过,全部患者均知情同意并签署知情同意书。
1.2 选择标准 纳入标准:(1)符合不稳定型心绞痛诊断标准;(2)自愿接受PCI手术;(3)术后给予氯吡格雷300 mg和阿司匹林300 mg负荷剂量治疗。排除标准:(1)既往有急性心肌梗死发作病史的患者;(2)PCI术前血小板计数异常的患者;(3)使用噻氯匹定、沙格雷酯等影响血小板功能的药物;(4)存在应用阿司匹林、氯吡格雷禁忌证的患者。
1.3 观察指标与方法
1.3.1 CYP2C19基因多态性评价: PCI术前采集患者空腹肘静脉血3 ml,采用基因组DNA提取试剂盒分离血液样本中的基因组DNA,设计CYP2C19基因*2(rs4244285)的引物(上游引物5'-CATCTTTGATTCTCTTGT-3',下游引物5'-CCAATCATTTAGCTTCAC-3')及*3(rs4986893)的引物(上游引物5'-TGAATCACAAATACGCAA-3',下游引物5'-ATATTCATTTCCTGTGCA-3'),对基因组DNA进行PCR扩增后取PCR产物,在1.5%琼脂糖凝胶内进行电泳,根据电泳结果判断CYP2C19基因多态性:CYP2C19*1/*1为野生型,CYP2C19*1/*2和CYP2C19*1/*3为杂合突变型,CYP2C19*2/*2、CYP2C19*2/*3、CYP2C19*3/*3为纯合突变型。
1.3.2 血小板功能指标及炎性指标检测:PCI手术前采集患者肘静脉血5 ml备用,检测以下指标。(1)血小板功能指标,采用流式细胞法测定CD62P、CD63、PAC-1的水平,采用血栓弹力图仪测定血栓形成速度(A)、最大振幅(MA)、凝血反应时间(R)、血细胞凝集块形成时间(K)。(2)炎性指标,采用上海西唐公司的酶联免疫吸附法测定C反应蛋白(CRP)、CD40配体(CD40L)、可溶性细胞间黏附分子1(sICAM1)、白细胞介素-8(IL-8)的含量,货号分别为F00451、F00410、F01050、F01340。

表1 3型患者一般资料比较 [例(%)]
1.3.3 血小板聚集率及氯吡格雷抵抗评估: PCI术后给予患者阿司匹林300 mg和氯吡格雷300 mg负荷24 h,采集患者肘静脉血3 ml,离心提取富血小板血浆、再离心提取贫血小板血浆,用贫血小板血浆调整富血小板血浆的血小板浓度至 200×109/L,采用血小板功能分析仪测定血小板聚集率后计算血小板抑制率;氯吡格雷治疗后血小板聚集率下降不足10%定义为氯吡格雷抵抗。
1.3.4 观测、记录严重心脏事件: PCI术后对患者进行为期1年的随访,严重心脏事件为随访终点,严重心脏事件的定义为心血管病死亡、急性心肌梗死、支架内血栓形成、预期外的支架植入术。
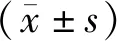
2 结 果
2.1 3型患者血小板功能指标比较 治疗30 d后, CD62P、CD63、PAC-1、A、MA水平比较,纯合突变型患者>杂合突变型>野生型患者,而R、K水平比较,纯合突变型<杂合突变型<野生型患者(P<0.01),见表2。
2.2 3型患者炎性指标比较 治疗30 d后,CRP、CD40L、sICAM1、IL-8水平比较,纯合突变型>杂合突变型>野生型患者(P<0.01),见表3。
2.3 3型患者病情转归比较 阿司匹林300 mg和氯吡格雷300 mg负荷24 h后,血小板抑制率比较,纯合突变型<杂合突变型<野生型患者,而氯吡格雷抵抗率、严重心脏事件发生率(治疗1年内)比较,纯合突变型>杂合突变型>野生型患者(P均<0.05),见表4。
3 讨 论
阿司匹林及氯吡格雷抗血小板治疗是PCI术后重要的辅助治疗方式,通过抑制血小板聚集来预防支架内血栓形成、降低远期心血管事件的发生风险。氯吡格雷的抗血小板活性通过阻碍血小板P2Y12受体下游信号通路的活化来发挥,该药物本身是无活性的前体,在体内通过P450氧化酶系统代谢后产生具有抗血小板活性的产物[4];当P450氧化酶系统的功能发生紊乱时,氯吡格雷的抗血小板活性会受到影响[5]。CYP2C19基因的编码产物是P450氧化酶系统的重要组成部分,在氯吡格雷的代谢过程中起到关键作用[6]。近年来越来越多的研究发现,CYP2C19基因的*2等位基因及*3等位基因存在多态性,表现为等位基因的突变或缺失;*2等位基因的突变会影响转录蛋白的剪切活性,*3等位基因的突变会降低蛋白转录的活性[7-8]。CYP2C19*2和*3等位基因发生突变后,编码产物活性的变化会直接影响氯吡格雷的抗血小板功能。

表2 3型患者血小板功能指标比较

表3 3型患者炎性指标比较

表4 3型患者病情转归比较
本研究在PCI术后使用阿司匹林300 mg和氯吡格雷300 mg负荷剂量进行抗血小板治疗,通过分析血小板聚集率来评估血小板抑制率及氯吡格雷抵抗率,存在CYP2C19*2和*3等位基因突变患者的血小板抑制率低于未发生突变的野生型患者,氯吡格雷抵抗率则高于未发生突变的野生型患者,且发生纯合突变患者血小板抑制率、氯吡格雷抵抗率的改变较杂合突变型更为明显。这一结果提示CYP2C19*2和*3等位基因的突变会影响氯吡格雷的抗血小板活性,且纯合突变的影响较杂合突变更为显著,药物的抗血小板活性受影响后会促进PCI术后发生血小板聚集,进而增加心血管事件的发生风险。本研究进一步对PCI术后1年内严重心脏事件的随访发现,CYP2C19 基因突变患者的严重心脏事件发生率高于野生型患者,且纯合突变患者的严重心脏事件发生率高于杂合突变患者。这一随访结果与血小板抑制率的变化结果吻合,CYP2C19 基因突变后血小板抑制率降低并且远期严重心脏事件的发生率增高。
在血小板发生活化和聚集的过程中,血小板表面和血小板内的多种信号分子发生激活[9-10],而氯吡格雷通过拮抗血小板P2Y12受体下游信号通路能够使相应信号分子的激活受阻。CD62P和PAC-1是血小板表面的特异性标志物,CD63是血小板内的信号转导分子,在血小板的活化过程中起到关键作用[11-12]。本研究对上述血小板活化指标的分析发现,CYP2C19 基因突变患者的CD62P、CD63、PAC-1水平均明显高于野生型患者,且纯合突变患者的CD62P、CD63、PAC-1水平均明显高于杂合突变患者。血小板在多种信号分子的作用下发生活化后,血栓形成能力增强,在血栓弹力图中表现为R和K的缩短、A和MA的增大[13-14]。进一步通过分析血栓弹力图参数来反映血小板功能,CYP2C19 基因突变患者的R和K水平均明显低于野生型患者、A及MA水平明显高于野生型患者,且纯合突变患者的R和K水平均明显低于杂合突变患者、A及MA水平明显高于杂合突变患者。以上血小板活化指标和血栓弹力图参数的结果表明,CYP2C19 基因突变后血小板的聚集功能增强且纯合突变对血小板聚集功能的增强作用高于杂合突变。
血小板活化过程不仅涉及自身信号分子的激活,还与体内炎性反应激活过程中炎性因子的作用有关, 炎性因子能够促进血小板聚集形成血栓、增强血小板的活化状态[15]。CRP是肝细胞合成的炎性标志物,属于急性时相蛋白,炎性反应过程中促炎因子能够刺激肝细胞内CRP的合成,分泌进入血液循环的CRP能够增强炎性反应的程度;CD40L是炎性细胞表面受体CD40的配体,两者结合后能够促进炎性细胞的迁移、浸润并参与炎性反应的级联激活[16];sICAM1和IL-8分别是具有黏附活性和趋化活性的细胞因子,能够促进炎性细胞的黏附、趋化运动,有利于炎性反应的级联放大[17-18]。本研究对上述炎性反应指标的分析发现,CYP2C19 基因突变患者的CRP、CD40L、sICAM1、IL-8水平均明显高于野生型患者,且纯合突变患者的CRP、CD40L、sICAM1、IL-8水平均明显高于杂合突变患者。这一结果表明CYP2C19 基因突变后炎性反应的激活程度加剧,且纯合突变对炎性反应的激活作用强于杂合突变。
综上所述,CYP2C19基因*2和*3等位基因突变能够加重血小板抵抗、促进血小板聚集、激活炎性反应。
利益冲突:无
作者贡献声明
吴铮、程姝娟:设计研究方案,实施研究过程,论文撰写;李文铮:分析试验数据,论文审核;王长华、柳景华:临床信息采集,资料搜集整理,进行统计学分析

