胃旁路手术对阿尔茨海默病模型小鼠认知功能的影响
李禹兵,高凌,罗登,叶迎春,周芬
阿尔茨海默病(AD),俗称老年性痴呆或认知功能障碍,是老年人常见的中枢神经系统疾病,占所有痴呆患者的60%~70%[1]。AD的主要病理特点是脑内Tau蛋白过度磷酸化及淀粉样β(Aβ)沉积[2]。近年来,肠道菌群—肠—脑轴的研究越来越多,证据显示肠道菌群、肠道和脑这三者是相互影响的。肠—脑轴紊乱与AD、帕金森病(PD)、抑郁、焦虑、肠综合征、炎性肠病及多发性疾病(MS)有关。Bravo等[3]发现,喂养益生菌的小鼠表现出更少的焦虑样和抑郁行为;另有研究发现,与特异性无病原体(SPF)小鼠比较,无菌(GF)小鼠在空间记忆和工作记忆方面表现出缺陷[4]。因此,肠道微生物组分的调节可作为AD的潜在治疗靶点。目前,改变肠道菌群的方式很多,包括抗生素的干预、益生菌和粪便移植等,但效果不一。胃旁路手术(Roux-en-Y gastric bypass surgery,RYGB)也是其中的方式之一,研究表明胃旁路手术可导致胃肠道系统中的主要解剖重排,手术后发现肠道菌群结构极大改变,其中拟杆菌的比例增加,变形菌和厚壁菌的比例下降[5]。故推测胃旁路手术可通过改善肠道菌群结构,经肠道菌群—肠—脑轴途径,进而改善大脑的认知功能,但目前尚缺乏依据。因此,现以APP/PS1/Tau三转基因痴呆小鼠为AD模型,予以胃旁路手术干预,通过Morris 水迷宫实验和Western-blot方法检测海马组织P-Tau(Ser396)和P-Tau(Thr231)蛋白的表达来研究胃旁路手术对APP/PS1/Tau三转基因痴呆小鼠认知功能的影响,报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物:清洁级 APP/PS1/Tau三转基因小鼠4只,购自美国杰克逊实验室(The Jackson Laboratory),在武汉大学人民医院动物实验中心SPF 级环境喂养繁殖。繁殖40只后采用随机数字表法分为AD模型组和AD胃旁路手术组;C57BL/6N正常小鼠(北京维通利华公司) 20只,亦分为WT正常对照组(normal)和WT正常胃旁路手术 (RYGB) 组,总计4组,每组纳入6只小鼠,小鼠均为雄性,6月龄。
1.1.2 试剂:肠内营养粉剂(雅培公司),异氟烷(鲁南贝特制药有限公司),DNA提取试剂盒[(宝日医生物技术(北京)公司],APP引物(赛维尔生物公司),Tau 引物(赛维尔生物公司),PS1引物(武汉金开瑞生物工程公司), GoldView Ⅰ型核酸染色剂(北京索莱宝科技有限公司),P-Tau (Ser396) 一抗、P-Tau(Thr231)一抗及内参GAPDH一抗(碧云天生物技术有限公司),RIPA总蛋白裂解液(武汉阿斯本生物技术有限公司),ECL化学发光检测试剂盒(AS1059,武汉阿斯本生物技术有限公司)。
1.1.3 仪器设备:手术显微镜(PICO,卡尔蔡司管理有限公司),动物麻醉呼吸机(ABL-2,上海玉研科学仪器公司),显微外科手术器械(上海医疗器械厂), Morris 水迷宫系统(smart3.0,深圳市瑞沃德生命科技有限公司),PCR扩增仪(基因扩增仪TC-XP,杭州博日科技公司), 4 ℃ 高速离心机 (TGL-16c,上海安亭科学仪器厂),凝胶成像系统(734BR0262,美国伯乐公司),扫描仪(LiDE110,佳能公司),酶标仪(DR-200Bs,济南星晖生物科技有限公司)。
1.2 实验方法 2018年2月—2019年3月在武汉大学人民医院中心实验室及动物实验中心进行实验。
1.2.1 APP/PS1/Tau三转基因模型小鼠(AD模型小鼠)的基因鉴定:确认购买的APP/PS1/Tau三转基因小鼠繁殖的子代小鼠是否稳定遗传即造模是否成功,提高数据的可靠性。考虑到手术的存活率,所以手术后再鉴定小鼠的基因型。取三转基因小鼠尾巴0.4 cm,用DNA 提取试剂盒提取DNA,用PCR 扩增仪同时扩增产物大小分别为 377 bp的 APP 基因、227 bp 的PS1基因和254 bp的Tau基因。APP 基因的引物序列:上游 5'- AGGACTGACCACTCGACCAG -3',下 游 5'- CGGGGGTCTAGTTCTGCAT -3'。PS1基因的引物序列:上游5'- TGAAGGGTGGAGCCAAAAG-3' ,下 游 5'- AGTCTTCTGGGTGGCAGTGAT -3'。Tau基因的引物序列:上游5'- TGAACCAGGATGGCTGAG -3' ,下 游 5'- TTGTCATCGCTTCCAGTCC -3'。PCR 反应条件:预变性94℃(变性94 ℃ 30 s ,退火58 ℃ 30 s,延伸72 ℃ 30 s,35 个循环)2 min,终止延伸72℃ 2 min,4 ℃ 保存。PCR完成后予以 1%琼脂糖凝胶电泳,电压100 V,时间 45 min。经 PCR 扩增,鉴定出 12只 APP/PS1/Tau三转基因小鼠(AD模型组和AD胃旁路手术组,各6只)。
1.2.2 胃旁路手术(RYGB)方法:小鼠术前流质饮食(肠内营养粉剂和水混合物)3 d。手术开始时,经2%异氟烷+2%氧气持续麻醉,固定,腹壁经剃毛后,用75%酒精消毒皮肤,做腹部正中约4 cm的纵向切口,打开腹腔,暴露空肠和胃,将距离十二指肠悬韧带2 cm处的空肠切断,然后在距离空肠造口位置远端6 cm处的空肠侧做纵向切口,用10-0缝合线以连续缝合法将近端空肠与已做纵向切口行端—侧吻合术,然后再用10-0缝合线以连续缝合法将远端空肠与胃袋进行端—端吻合术。在胃与空肠的吻合口旁,用医用钛夹夹紧胃体,阻断胃内容物的通过,相当于胃大部分切除。最后关闭腹壁时,肌肉层和皮肤均用5-0缝合线以连续缝合法缝合封闭腹腔。手术过程中暴露胃和肠道使用无菌湿润纱布进行保护,同时在无菌和恒温条件下进行手术(见图1)。术后继续流质饮食7 d后改为正常饮食,此手术方法小鼠的存活率可达90%以上。

图1 胃旁路手术方式
1.3 观察指标与方法
1.3.1 小鼠的认知功能测定:Morris 水迷宫检测各组小鼠的认知功能。胃旁路手术2个月后,各组小鼠进行水迷宫实验。Morris 水迷宫有4个象限,是半径为60 cm的水池,平台的半径为4.5 cm,把平台放在第2象限,用奶粉把水池内的水溶解为白色,不透明,水平面超过平台约 1.5 cm,池中水温保持 20~ 23 ℃。开始实验前,把各组小鼠预先放在水迷宫实验室内1 d,让其熟悉和适应环境。然后开始正式为期6 d的实验,前5 d行定位航行实验,第6天行空间探索实验,即第 1 ~ 5 天各组小鼠行定位航行实验(逃避潜伏期试验),每天每只小鼠分别从 4 个象限依次放入,即共训练4次,每次间隔时间为20 min,每次训练时间1 min,Smart软件自动计算小鼠 60 s内到达平台所需要的时间,即逃避潜伏期,假如 60 s 时未到达平台,则逃避潜伏期按60 s计算,然后把它放到平台上,强行停留 10 s,让其记忆水迷宫的空间位置,擦干后放回笼。假如60 s内到达平台,且在平台停留>10 s,则按到达的时间计算,否则按60 s计算。每只小鼠每天的逃避潜伏期为每天4次训练的平均时间。第6天各组小鼠均进行空间探索实验(穿越平台次数试验):取出平台,将小鼠从远离平台的一个象限放入水中,Smart软件自动计算在 1 min 内每只小鼠穿越平台的次数。其软件还记录了每只小鼠在定位航行和空间探索实验中的活动轨迹图。采用GraphPad Prism 6.07绘图软件作图。
1.3.2 小鼠海马区P-Tau(Ser396)和P-Tau(Thr231)蛋白表达检测:采用Western-blot法检测各组小鼠左侧海马区P-Tau(Ser396)和P-Tau(Thr231)蛋白的表达。取每组6只小鼠左侧的海马组织90 mg加入RIPA裂解液1 ml,研磨后静置30 min,4℃、1 200 r/min离心16 min,取上清液;按1∶4的比例加5xSDS-PAGE 的蛋白上样缓冲液,95~100 ℃水浴9 min,彻底使蛋白变性。SDS-PAGE电泳1.5~2.0 h,转膜1.5 h,洗3次膜,每次约10 min,用5%脱脂奶粉封闭1 h。然后分别加入对应的一抗摇动于4℃冰箱过夜。次日于室温加入二抗孵育1 h,洗4次膜,每次10 min,滴加ECL混合溶液于膜蛋白正面,于暗室里曝光、显影和定影;最后扫描胶片,AlphaEase FC软件分析目的蛋白的灰度值。以各目的蛋白与GAPDH蛋白的比值表示该蛋白的相对表达量。
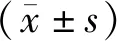
2 结 果
2.1 APP/PS1/Tau三转基因小鼠的基因鉴定 AD模型组和AD胃旁路手术组的小鼠均携带APP、PS1及Tau 3种基因,即为APP/PS1/Tau三转基因小鼠,造模成功。见图2~4。
注:A.AD模型组;B.AD胃旁路手术组

注:A.AD模型组;B.AD胃旁路手术组

注:A.AD模型组;B.AD胃旁路手术组
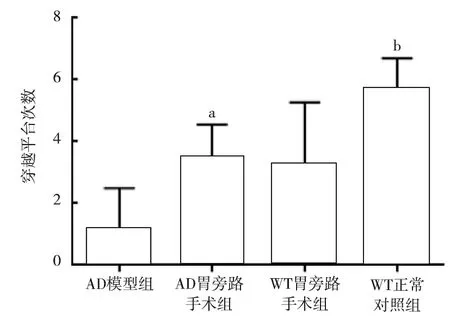
2.2 各组小鼠逃避潜伏期比较 与WT正常对照组比较,AD模型组逃避潜伏期延长(P<0.01),说明AD模型成功;与 AD模型组比较,AD胃旁路手术组逃避潜伏期缩短(P<0.01),而与WT正常对照组比较,AD胃旁路手术组逃避潜伏期延长(P<0.05),说明AD胃旁路手术组认知功能有明显改善,但弱于WT正常对照组;与WT胃旁路手术组比较,AD胃旁路手术组逃避潜伏期变化不大,差异无统计学意义(P>0.05);与WT正常对照组比较,WT胃旁路手术组逃避潜伏期延长(P<0.05),而与AD模型组比较,WT胃旁路手术组逃避潜伏期缩短(P<0.01),说明胃旁路手术对正常小鼠的认知功能有损害作用,但严重程度弱于AD模型组,见表1。相对于其余3组,AD模型组小鼠趋向于沿着墙壁游走,远离平台,说明逃避危险的能力或探索能力较差,见图5。
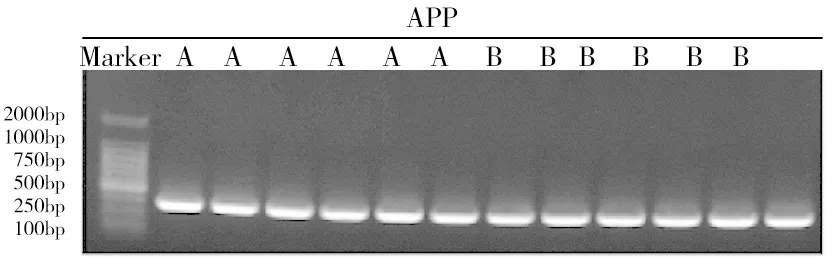
2.3 各组小鼠穿越平台次数比较 与AD模型组(1.17±1.33)次/min比较,AD胃旁路手术组穿越平台(3.50±1.05)次/min 增加(t=3.376,P=0.007);与AD胃旁路手术组比较, WT正常对照组(5.67±1.03)次/min增加(t=3.606,P=0.005),WT胃旁路手术组(3.22±2.05)次/min变化不大(t=0.304,P=0.766);与WT正常对照组比较,WT胃旁路手术组穿越平台次数减少(t=2.682P=0.019),见图6、7。
注:与AD模型组比较,aP<0.05;与WT胃旁路手术组比较,bP<0.05

表1 各组小鼠定位航行实验逃避潜伏期的比较
注:与WT正常对照组比较,aP<0.01;与AD模型组比较,bP均<0.01

图5 各组小鼠的定位航行实验活动轨迹图
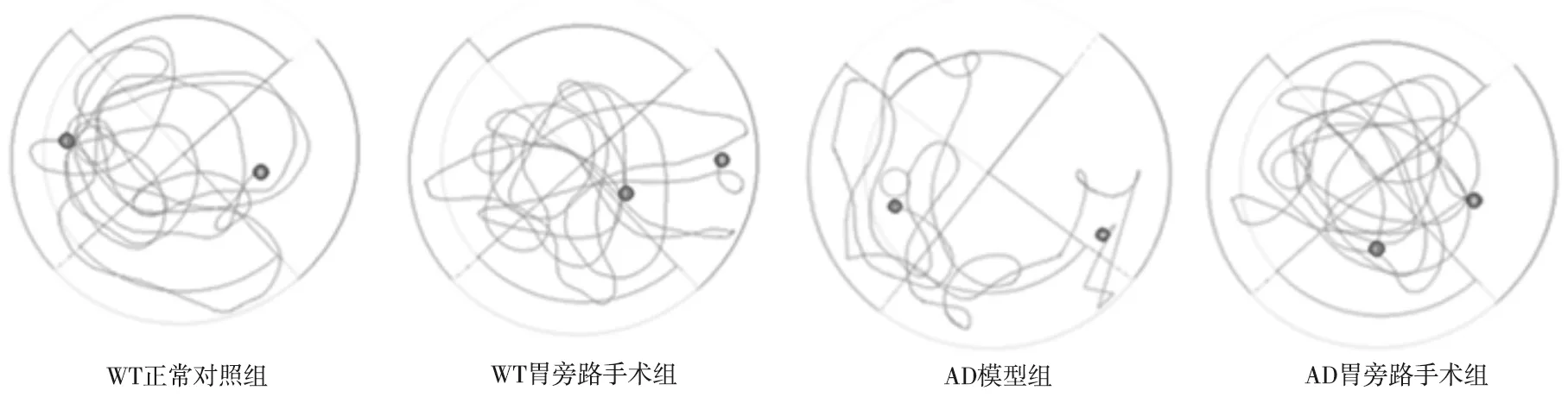
图7 各组小鼠的空间探索实验活动轨迹图
2.4 各组小鼠Tau蛋白磷酸化水平的比较 与WT正常对照组比较,AD模型组、AD胃旁路手术组和WT胃旁路手术组 Tau蛋白磷酸化水平均升高;与 AD模型组比较,AD胃旁路手术组和WT胃旁路手术组Tau蛋白磷酸化水平均明显降低(F=5.748,P=0.000 )。 与AD胃旁路手术组比较,WT胃旁路手术组Tau蛋白磷酸化水平差异无统计学意义(t=0.051,P=0.964),见图8、9。
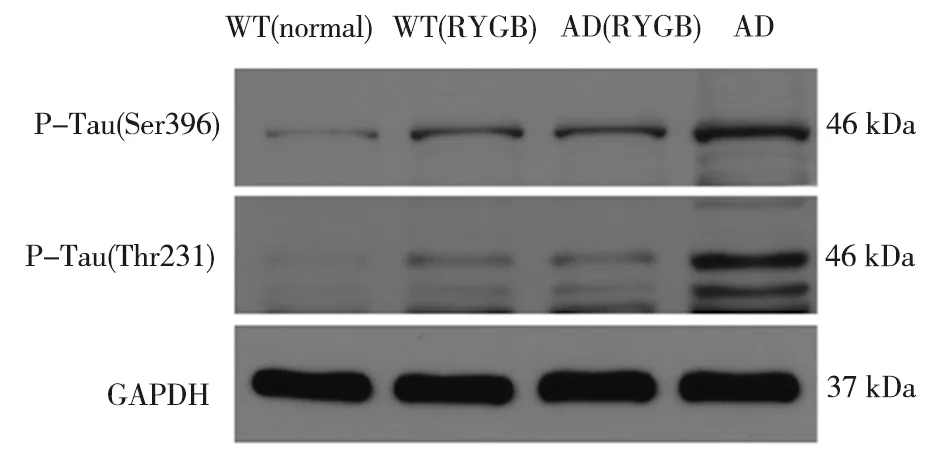
图8 Western-blot 检测各组P-Tau(Ser396)和P-Tau(Thr231)蛋白表达量
3 讨 论
阿尔茨海默病(AD)是世界上引起老年性痴呆的主要原因,是一种慢性、易发性疾病,以认知功能缺陷和进行性记忆丧失为特征的慢性神经退行性疾病。老年人(>65岁)AD患病率10%~30%,发病率1%~3%[1]。近年来,由于社会生活条件的不断提高,肥胖和糖尿病的发病率也逐渐升高,研究发现 T2DM患痴呆症的风险增加1.5~2.5倍[6-7],阿尔茨海默病不仅极大影响患者的生活质量,同时带来极大社会和家庭经济负担。目前批准用于AD的药物只是改善患者的症状,而不改变疾病的进展,阻滞这种疾病发展的临床试验几乎都以失败告终。因此,需要重新思考对AD的治疗策略,而胃旁路手术或许可以作为治疗AD的新方法。其主要作用机制:胃旁路手术通过调节肠道菌群,释放多种脑肠肽,通过血脑屏障,对大脑认知功能产生影响,即肠道菌群—肠—脑轴理论,而脑肠肽在其中起着中介作用。
中枢神经系统(CNS)与胃肠道密切相关,肠脑之间的通信是双向的,大脑和肠道可以通过多种途径连接起来,包括肠道菌群的代谢产物、免疫、内分泌和神经通路等[8]。最近的研究表明,肠道菌群的紊乱可以影响正常的大脑功能,导致焦虑、抑郁和认知功能障碍[9]。当特定无病原体(SPF)Swiss小鼠的微生物被转移到无菌BALB/c小鼠的身体时,无菌BALB/c小鼠的探索行为增加;然而,当特定无病原体(SPF) BALB/c小鼠的微生物转移到无菌Swiss小鼠体内时,无菌Swiss小鼠的探索行为明显低于正常Swiss小鼠[10]。另外,研究表明粪便移植(FMT)不仅可以改善阿尔茨海默病小鼠的认知功能,还可以延缓衰老和降低脑组织 Aβ 沉积,这与改善肠道菌群紊乱有关[11]。
研究表明胃旁路手术后肠道菌群结构发生极大改变,而肠道菌群的改变可影响各种脑肠肽的分泌,如GLP-1。另外,胃旁路手术后,餐后胃排空增加,营养物质更快地输送到远端肠道,刺激肠道内分泌细胞释放胆囊收缩素(CCK),胰高血糖素样肽-1(GLP-1)、生长激素释放肽(ghrelin)和胃肠激素肽(PYY)等脑肠肽[12-13]。大量的研究表明学习和记忆功能与脑肠肽关系密切,如胆囊收缩素对认知功能具有改善效果,并且其激动剂可改善大鼠的认知功能,其拮抗剂则效果相反[14]。GLP-1受体(GLP-1R)在中枢神经系统中广泛表达。研究发现GLP-1R 基因敲除小鼠表现出空间学习和记忆受损[15]。临床前试验已证明GLP-1具有显著的神经保护作用,包括抑制细胞凋亡,促进神经元增殖和分化,能改善学习和记忆功能。另外,研究还发现ghrelin抑制神经细胞凋亡,对情绪具有调节作用、并能改善抑郁动物的行为和阿尔茨海默病动物模型的认知功能[16-17]。因此,胃旁路手术可能通过调节肠道菌群—肠—脑轴功能改善阿尔茨海默病小鼠的认知功能。相对于单一的脑肠肽改善认知功能的效果,如GLP-1激动剂,胃旁路手术产生的多种脑肠肽的协同作用,对认知功能障碍的治疗效果可能要更为显著。

注:与WT正常对照组比较,aP<0.05,与AD胃旁路手术组比较,bP<0.05
根据上述理论依据,本研究对APP/PS1/Tau三转基因小鼠(AD模型小鼠)进行胃旁路手术,希望可以通过这种方式改善AD模型小鼠的肠道菌群结构,分泌多种脑肠肽,进而通过脑—肠轴影响AD模型小鼠的认知功能。Morris水迷宫实验显示APP/PS1/Tau三转基因小鼠逃避潜伏期明显延长且穿越平台次数明显减少,相对于AD模型组,AD胃旁路手术组小鼠的逃避潜伏期明显缩短,穿越平台次数明显增加,表明其认知功能极大提高。研究已表明认知功能的改善与Tau蛋白磷酸化水平降低密切相关,上述Western-blot 检测结果显示,AD模型胃旁路手术组小鼠Tau蛋白磷酸化水平较AD模型组明显降低,表明胃旁路手术能改善AD模型小鼠的认知功能。通过上述肠道菌群—肠—脑轴理论分析,推测脑肠肽可能通过相关受体通路降低海马Tau蛋白磷酸化水平,而胃旁路手术可引起多种脑肠肽的分泌,从而间接降低海马Tau蛋白磷酸化水平,改善AD模型小鼠的认知功能。但与WT正常对照组比较,WT胃旁路手术组的认知功能却下降,这可能与胃旁路手术破坏正常的肠道菌群结构引起脑肠肽分泌减少有关,说明胃旁路手术对胃肠道可能存在双重作用,具体机制暂不清楚,需进一步研究。
综上所述,对APP/PS1/Tau三转基因小鼠(AD模型小鼠)进行胃旁路手术能改善其认知功能,其作用机制可能是胃旁路手术通过改善肠道菌群紊乱,进而释放多种脑肠肽,通过脑—肠轴调节Tau蛋白磷酸化水平以改善阿尔茨海默病小鼠的认知功能。
利益冲突:无
作者贡献声明
李禹兵:课题设计,设计研究方案,实施研究过程,进行统计学分析,论文撰写,论文修改;高凌:提出研究思路,论文审核;罗登:论文修改;叶迎春:分析试验数据;周芬:资料搜集整理

