施加硒代蛋氨酸和亚硒酸钠对韭菜总硒及硒形态的影响
张俊杰,郭志强,王娟娟,魏学红,2*
(1.山西大学 大型科学仪器中心,山西 太原 030006;2.山西大学 化学化工学院,山西 太原 030006)
0 引言
硒元素作为人体必需的痕量矿物质,对人类健康极其重要。是人体硒蛋白的重要结构组成和酶活性发挥的部分,具有催化活性甲状腺激素产生、抗氧化、抗癌及抗HIV病毒等免疫功效[1-3]。硒需要从外界膳食获取,常规成人摄入量为40~300 μg/d,用以满足人体酶代谢或者预防癌症发生[4]。植物是主要的硒源之一[5-6],利用微生物可以提高植物营养与质量[7],通过植物育种、基因工程,或者施加硒肥,也可以提高植物硒的富集量[8]。国内市面上出现了各种富硒农产品及含硒保健品,以达到硒的补充摄入。由于硒元素为低含量营养,高含量有毒的元素,因此对硒含量的监测控制也显得尤为重要。
硒元素测定方法众多,主要包括分子荧光法、氢化物发生-原子荧光光谱法、原子吸收光谱法、电感耦合等离子体-原子发射光谱法、电化学分析法和电感耦合等离子体质谱法(Inductive coupled plasma mass spectrometry,ICP-MS)等。其中,ICP-MS技术具有灵敏度高[9],样品前处理方便快捷等优点,在准确测量生物、食品、环境、地质等样品中的硒元素含量[10-12]、同位素组成及其各种形态方面表现出色,且有着广泛的应用前景[13]。环境保护部规定土壤和沉积物中硒的测定采用微波消解-原子荧光法[14]。新颁布的食品中的硒测定的食品安全国家标准,在保留了氢化物原子荧光光谱法和荧光分光光度法的基础上,增加了ICP-MS法[15]。
韭菜本身营养丰富,是一种富硒能力较强的蔬菜[16],低浓度硒的添加能明显改善韭菜的品质[17],是较为理想的富硒植物。已有研究人员对韭菜施加蚯蚓转化的有机硒肥[18],或者硒矿粉、亚硒酸钠[19]和硒酸钠无机硒肥以达到富硒目的[20]的报道。本文以有机形态的硒代蛋氨酸及无机形态的亚硒酸钠,对韭菜进行富硒化的培养,对硒元素的富集效果进行研究,以期达到富硒韭菜中硒富集的评价及探索硒在韭菜中的存在形态,并预估硒的富集途径。
1 实验部分
1.1 仪器
NexION 350X电感耦合等离子体质谱仪(PerkinElmer,美国)、恒温加热消解仪(上海博通化学科技有限公司,中国)、Multiwave PRO微波消解仪(Anton Paar,意大利)、Ex2250ZH电子天平(奥豪斯仪器,中国常州)、DHG-9070干燥箱(一恒科学仪器有限公司,中国上海)、Flexar高效液相色谱仪(High performance liquid chromatography,HPLC)(PerkinElmer,美国)、Hamilton PRP-X100阴离子交换柱(4 mm×250 mm,10 μm)(汉密尔顿,美国)、雷磁pH计和KQ-250DB超声仪(舒美,中国昆山)。
1.2 试剂和标准品
浓硝酸(质量分数65%-68%,优级纯)(国药集团化学试剂有限公司,中国上海)、1 000 μg/mL硒元素标准溶液(国家有色金属及材料研究中心,中国)、超纯水(电阻率≥18.2 MΩ·cm)(采用EASY15 Heal Force超纯水系统(力康发展有限公司,香港)制备)、甲醇、磷酸氢二铵、甲酸、硒酸盐(Selenate,Se(Ⅵ)标准溶液,亚硒酸盐(Selenite,Se(Ⅳ)标准溶液,硒代胱氨酸(selenocystine,Se-Cys)标准溶液和硒代蛋氨酸(selenomethionine,Se-Met)标准溶液。
1.3 样品处理
1.3.1 富硒韭菜样品信息
田间试验在山东省淄博市博山区上瓦泉村有机富硒蔬菜园区进行,该园区土壤及温湿度情况如文献中所述[13]。于2015年1月13日第一次施硒肥,2015年1月22日第二次施硒肥,2015年1月29日收割。样品分组、施肥种类及施加浓度如表1所示。
1.3.2 韭菜中总硒的提取
新鲜的韭菜样品,液氮冷冻干燥,用研钵研碎。称取约2.5 g(精确至 0.000 1 g)至聚四氟乙烯消解管中,加入6 mL浓硝酸,按照表2中设定的程序进行消解。完成后,待消解液冷却至低于60℃,将消解液转入10 mL容量瓶中,用少量水洗涤消解罐3次,洗液合并于容量瓶中,用水稀释至刻度,混匀。样品空白除样品加入步骤,其余操作均与样品相同。以体积分数2% HNO3作为溶剂空白。稀释10倍进行测定。
1.3.3 土壤中总硒的提取
从韭菜种植田地中随机设置8个取样点,采集土壤样品。将土壤置于阴凉干燥处自然风干后用研钵研磨,弃碎石及渣子,过100目筛。称取约0.5g(精确至 0.0001 g)土壤样品至聚四氟乙烯烧杯中,加入6 mL浓硝酸和2 mL氢氟酸,电热板加热预消解后,再按照表2中的程序进行微波消解。完成后赶酸至1~2 mL,将消解液转入10 mL容量瓶中,用少量水洗涤消解罐3次,洗液合并于容量瓶中,用水稀释至刻度,混匀。样品空白除样品加入步骤,其余操作均与样品相同。以2% HNO3作为溶剂空白。
1.3.4 韭菜样品硒形态的提取
将韭菜样品液氮冻干,研钵粉碎,称取2.0 g(精确至 0.000 1 g),加入1∶1(V∶V)的甲醇/水溶液8 mL,超声30 min,对韭菜中的硒代谢物进行提取,完成后离心,过滤。
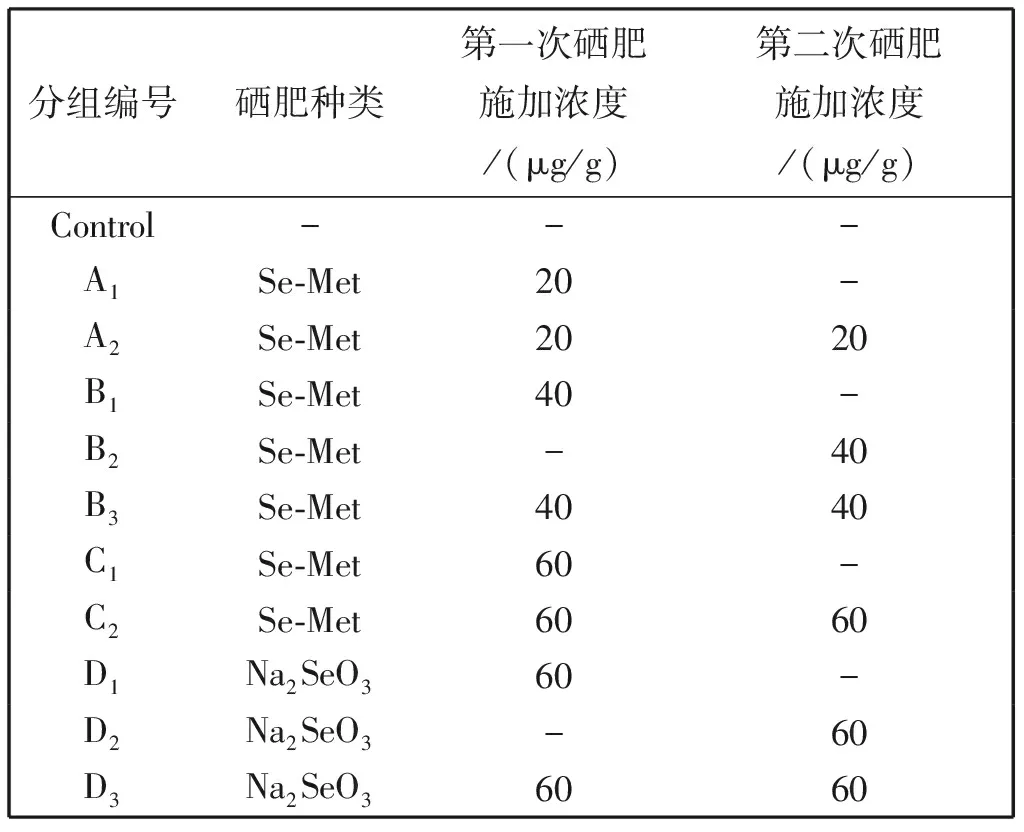
表1 韭菜的富硒化培养
1.4 测定条件
ICP-MS参数为功率1 600 W,等离子体气体流速18 L/min,辅助气流速1.2 L/min,载气流速0.97 L/min,雾化器为Meinhard型,样品锥和截取锥为镍锥,雾室和中心管为石英材质,驻留时间为50 ms,总硒和形态测定,分别选择同位素82Se和78Se。仪器调谐时应达到的技术指标,包括灵敏度指标9Be:>2000cps,115In:>40000cps,238U:>30000cps;背景值:Bkgd 220≤1 cps,氧化物比例(156CeO+/140Ce+):≤2.5%,双电荷离子比例(70Ce2+/140Ce+):≤3.0%,质量数和分辨率指标以元素Li、Mg、In和U元素10%峰高处峰宽为准,在0.65~0.80 amu范围。其他参数如矩管位置、载气流量、四级杆偏转电压、检测器电压和双检测器电压,均使用相应的调谐液进行校准,直至符合要求。所有测试均在标准模式(standard,STD)下进行,且删除硒元素校准方程。
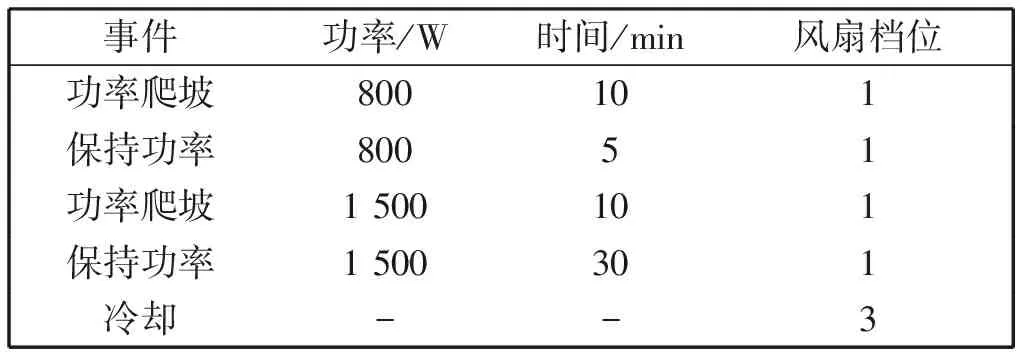
表2 微波消解步骤
硒形态测定采用60 mmol的磷酸氢二铵为流动相,用甲酸调节pH至6.0,液相色谱流速1 mL/min,进样量50 μL。
1.5 数据处理
1.5.1 总硒含量的测定
以标准溶液待测元素分析峰响应值为纵坐标,浓度为横坐标,绘制标准曲线,计算回归方程。利用供试品中待测元素的峰响应值,根据标准曲线,计算得出相应的浓度,计算样品中硒元素的含量。每个样品测定时均取3次读数的均值。
1.5.2 有机硒含量测定
根据各个硒代谢物的色谱峰面积,对应其系列浓度,制作标准曲线,利用样品中硒代谢物色谱峰面积值,从标准曲线中计算得出相应的浓度。
2 结果与讨论
2.1 富硒韭菜中总硒的测定
精密量取硒标准溶液(1 000 μg/mL)10 μL,用2%硝酸溶液,定容至10 mL,成为硒浓度为1 μg/mL的单独标准中间溶液。分别取硒标准溶液中间液(1 μg/mL)5、10、50、100和500 μL,先后加入10 mL容量瓶中,用2 %硝酸溶液定容,得到含硒标准溶液0.5、1、5、10和50 ng/mL的混合标准溶液。线性曲线y=195x+42.2,线性相关系数达到0.999 9以上,可用于富硒韭菜中总硒的测定。
韭菜叶子经烘干杀青,微波消解后进行ICP-MS分析,以锗元素为内标,在STD模式下,进行方法验证。以11次空白测定值的3倍标准偏差计算检出限。平行制备6份样品,分别测定后,计算其相对标准偏差,得出重复性。同一样品连续进样6次,测定相对标准偏差,得出精密度。回收率实验设置低、中、高3个不同浓度,每个浓度设置6个重复(n=6)进行。表征结果见表3。该方法的检出限可达到0.03 ng/mL;测定重复性和精密度分别为4.17%和1.52%;低、中和高浓度的加标回收率在80.6%-102.9%之间,该方法可达到硒元素含量的稳定、准确和高灵敏测定。
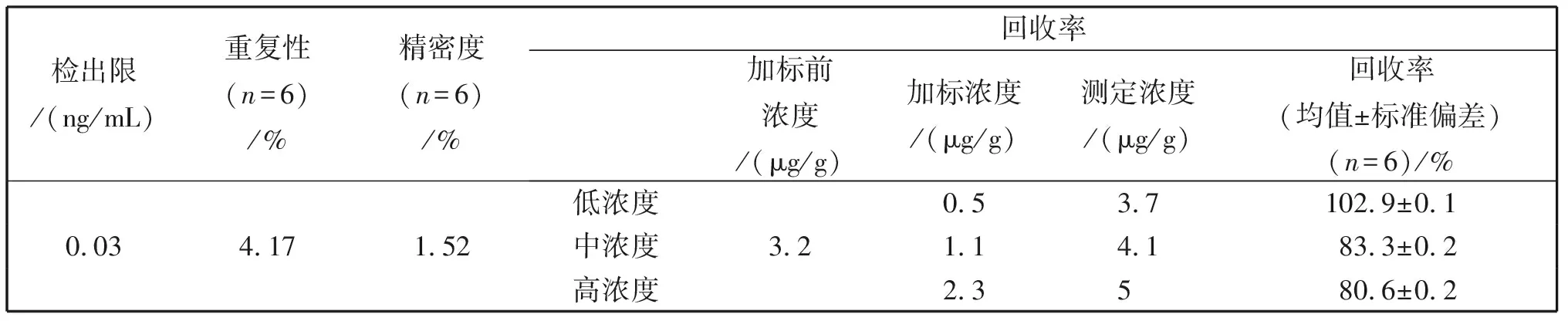
表3 ICP-MS测定总硒方法验证
2.2 种植地土壤中总硒的测定
由于土壤基质复杂,为获得准确的测定结果,使用土壤试验样本,以标准模式的标准加入法得出的测定结果为参考值,比较了不同模式下,对土壤硒测定结果的准确性。结果表明,在标准模式下,采用82Se作为测定同位素,不用校准方程,结果最准确;另外,碰撞模式采用78Se,反应模式采用80Se,也可得出相对正确的结果,而其他同位素的测定结果距离准确值相差很大,不可取。而采用仪器默认方法,即标准模式下,测定82Se,使用校准方程,以消除氪元素对82Se的干扰,得出的结果有误,因此,实际测试样品时,需要根据样品基质的实际情况,合理地使用校准方程。本试验土壤中硒浓度全部采用标准模式不加校准方程测定82Se得出。取硒标准溶液10.0 ng/mL,系列稀释成含硒标准溶液0.156、0.625、2.50、5.00、10.0 ng/mL的混合标准溶液,用2%硝酸溶液定容。线性相关系数达到0.999 8,得出土壤样品总硒含量为0.36±0.080 μg/g,此种植地土壤中硒含量较高,主要是施加硒肥导致的结果,利于韭菜植株通过土壤吸收硒元素。
2.3 韭菜中硒形态的测定
收集的硒形态四种标准物质,包括硒酸钠、亚硒酸钠、硒代半胱氨酸及硒代蛋氨酸标准溶液,经过阴离子交换柱分离,HPLC-ICP-MS分析,15 min之内可在色谱上达到良好的分离。这四种硒形态的混合标准溶液系列稀释成5、10、50、100和1 000 ng/mL的浓度的系列标准溶液,线性相关系数均在0.997 3以上(表4)。四种硒系形态标准品及韭菜中相应形态的HPLC-ICP-MS色谱图如图1所示。对韭菜硒形态进行提取分析,得出韭菜中主要含有亚硒酸盐形态,不存在其他三种硒形态 (图1)。
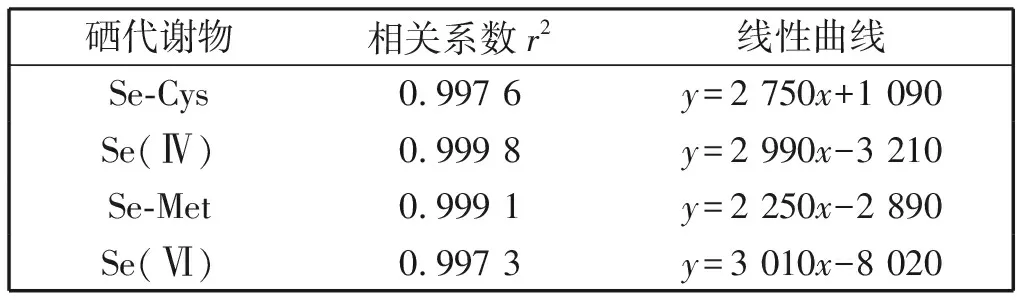
表4 四种硒形态的线性结果
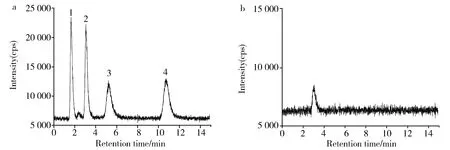
(a) Standards of selenium metabolites with 100 ng/mL concentration(1,Se-Cys,2,Se(Ⅳ), 3,Se-Met,4,Se(Ⅵ));(b) extract of Chinese chivesFig.1 Chromatography of selenium species using HPLC-ICP-MS(a)100 ng/mL浓度的标准品溶液;(b)韭菜样品提取液图1 硒形态的HPLC-ICP-MS色谱图
2.4 韭菜硒富集效果评价
为得到韭菜中的硒富集效果及其硒存在形态,对韭菜总硒及小分子硒形态、韭菜种植地土壤中的总硒分别进行了测定,以得出硒富集的效果及途径。富硒韭菜总硒及小分子硒形态的测定结果如表5所示。
施加硒肥后,韭菜硒含量与对照组相比明显升高,且升高程度与硒肥种类、施肥时间与施肥次数均有关系。两种硒肥,若收割前两周只施一次,不论浓度大小,硒含量无明显的差别(A1、B1、C1、D1)。只施一次肥的情况下,收割前一周施肥,比收割前两周施肥,硒元素浓度要高(B1vs B2、D1vs D2)。对于Se-Met,施加20 μg/g的浓度,施一次跟施两次之间差别不大,浓度升高至40 μg/g和60 μg/g,施两次肥硒比施一次硒含量有明显的升高(A、B、C组分别比较);对于Na2SeO3,硒含量跟施肥时间,施肥次数均有关,收割前一周施比前两周施,硒含量高,施两次肥比施一次硒含量高(D组比较)。同等剂量60 μg/g的Se-Met和Na2SeO3,施一次硒含量无差别,施两次, 施Na2SeO3比Se-Met硒含量高(C1vs.D1,C2vs.D3)。
随着韭菜中总硒浓度的升高,亚硒酸盐的浓度值一直保持稳定,亚硒酸盐在总硒中所占比例有下降趋势(表5),推测施加硒肥的实验组,硒以其他的形态进行了富集,如流向硒蛋白及硒多糖的合成方向。
3 结论
使用微波消解-ICP-MS,对韭菜和土壤样品总硒浓度的测定模式及方法进行验证,得到了韭菜及土壤中总硒测定的可靠方法,对样品中的总硒进行了准确测定,进一步使用HPLC-ICP-MS,对韭菜中的硒形态进行了分析,达到了富硒化培育韭菜的硒富集效果的评价。施加不同浓度的有机或者无机硒肥,均能达到韭菜一定程度的硒富集效果。富集效果跟施肥的种类、施肥时间、施肥次数及施肥浓度均有关。无机形态亚硒酸钠的富集效果优于有机形态的硒代蛋氨酸,收割前一周施肥优于收割前两周,施肥两次优于施肥一次,高浓度施肥优于低浓度。富硒组的亚硒酸盐含量基本未变,且亚硒酸钠占总硒比例逐渐减小,推测硒富集可能流向其他硒形态,如硒多糖或者硒蛋白化合物的合成方向。在缺硒性质的韭菜种植地土壤中检测到了硒元素,猜测所施硒肥已有部分进入到土壤中,韭菜植株可从土壤间接吸收硒元素,完成硒富集。
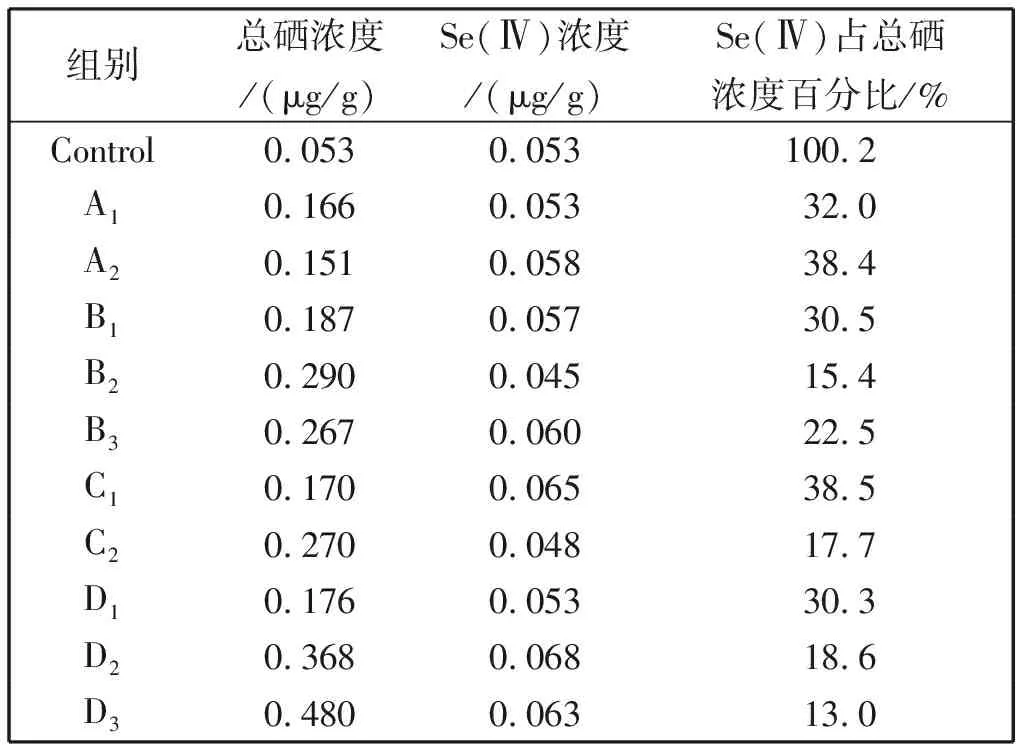
表5 韭菜总硒及小分子硒形态分布

