从克罗恩病患者肠黏膜分离出的1株黏附侵袭性大肠杆菌对IL-10基因敲除结肠炎小鼠的影响
曹 卉, 熊枝繁
华中科技大学同济医学院附属梨园医院消化内科,湖北 武汉 430077
目前对于炎症性肠病(inflammatory bowel disease, IBD)的发病机制仍知之甚少。但是,有研究表明,克罗恩病(Crohn’s disease, CD)发病机制涉及肠微生物、机体免疫系统、遗传、环境因素之间的相互作用[1]。IBD的动物模型中基因工程改造的模型是白细胞介素10缺陷(IL-10 KO)的小鼠,其表现类似于人类CD[2]。IL-10是一种在肠道中维持免疫稳态的关键细胞因子,可以抑制调节性T 细胞发挥作用[3]。同时,在IL-10 KO 模型中,结肠炎发展依赖于环境中的微生物。在无菌或严格的SPF 条件下IL-10 KO小鼠不会发生结肠炎[4]。黏附侵袭性大肠杆菌 (adherent-invasive Escherichia coli, AIEC)在IBD的发病中起一定作用,特别是在CD的发病中。AIEC在CD患者肠黏膜的检出率明显升高(51.9%),而健康对照组是16.7%[5-6],提示AIEC参与了CD的发病。且AIEC与其他来自肠道的致病性大肠杆菌菌株不同,因为它们不含有毒力基因[7]。 AIEC具有以下特点:(1)可以黏附并侵入Caco-2或Int-407肠上皮细胞表面;不含已知致病基因;(3)能在吞噬细胞内存活并繁殖[5, 8-9]。 AIEC侵入肠上皮细胞和巨噬细胞,并能在细胞内复制,分泌TNF-α而不会诱导感染的巨噬细胞死亡[10]。
本实验选择病理学特征与人类CD十分相似的IL-10 KO小鼠作为IBD模型,用从CD患者肠黏膜分离出的一株AIEC给小鼠进行灌胃, 观察小鼠肠道炎症水平的变化。
1 材料与方法
1.1 材料纯合型IL-10 KO小鼠(C57)及对照组(wild type, WT)小鼠(C57)均购自武汉大学动物实验中心。实验小鼠饲养于SPF条件下,给予灭菌的标准饮食,小鼠随意饮食。AIEC是从1例CD患者肠黏膜标本上分离出。分离方法是按照 Darfeuille-Michaud等的方法,对从患者肠黏膜上分离出的大肠杆菌进行侵袭力鉴定、黏附性鉴定、细菌吞噬细胞内存活鉴定和毒力基因的鉴定,确定其为AIEC[5]。以甘油保存法,甘油和液体培养基1∶1混合,-80 ℃保存。大肠杆菌的标准菌株K-12购自拜耳公司。菌株培养使用麦康凯培养基和LB培养基。培养条件为37 ℃、体积分数为5%的CO2。 其活菌数达1×1012CFU/L。
1.2 方法
1.2.1 实验干预:将15只6~8周龄、20 g左右IL-10 KO雄性小鼠每组5只,随机分成3组:对照组(KO+PBS)、普通大肠杆菌组(KO+K-12)、AIEC组(KO+AIEC)。将15只6~8周龄、20 g左右的WT雄性小鼠每组5只,随机分成3组:对照组(WT+PBS)、普通大肠杆菌组(WT+K-12)、AIEC组(WT+AIEC)。分离的AIEC细菌和K-12菌株在LB培养基37 ℃震荡过夜,第2天离心机4 000×g离心15 min,弃去上清液,细菌悬浮在0.5%(w/v)蒸馏水配制的羧甲基纤维素(CMC)中,浓度为1×1012CFU/L。分别用PBS灌胃(每只0.5 ml/d),普通大肠杆菌K-12菌株灌胃(每只0.5 ml/d,1×109CFU/L),用AIEC菌株灌胃(每只0.5 ml/d,1×109CFU/L)。每天上午灌胃1次,灌胃期间小鼠自由饮食,每天更换1次垫料和饮水,连续灌胃2周。连续4周每天记录小鼠的体质量变化。每天采集小鼠的粪便观察且用潜血试剂盒测小鼠粪便潜血情况。
1.2.2 病理检查:实验结束后处死小鼠,快速取少量结肠组织, 清洗后切成小块(1 mm×1 mm)置入甲醛中固定,脱水、浸透、包埋聚合、切取结肠组织, 甲醛固定24 h, 石蜡包埋,4 μm切片,苏木素-伊红(HE)染色后由2位病理医师按照盲法作组织学评分,在显微镜下观察并按Carvalho采用的评分标准作组织学评分,即总分由2部分组成:炎症细胞浸润(0~3分)、上皮细胞损伤(0~3分)(见表1)。根据小鼠体质量下降(0~4分)、粪便性状(0~4分)、便血情况(0~4分)评价结肠损伤,确定肠炎活动指数(DAI)(见表2)[11]。

表1 肠道炎症的病理评分Tab 1 Pathological score of intestinal inflammation

表2 肠炎活动度评分(DAI评分)Tab 2 Activity score of enteritis (DAI score)
1.2.3 RT-PCR检测末端结肠IL-12、TNF-α和INF-γ mRNA的表达:采用鼠GAPDH作参照,GAPDH、IL-12、TNF-α和INF-γ引物设计参照文献和GenBank,确定的序列由武汉擎科生工公司合成,所用引物核苷酸分别为:GAPDH:5′-ACTCCACTCACGGCAAATTC-3′,5′-TCTCCATGGTGGTGAAGACA-3′;IL-12:5′-GAGAAGACATCTACCGAAGTCCAATG-3′,5′-GGAACACATGCCC-
ACTTGCT-3′;TNF-α:5′-CCACGTCGTAGCAAACCACCAA-3′,5′-TTTGAGATCCATGCCGTTGGCCA-3′;IFN-γ:5′-CGCTACACACTGCATCTTGG-3′,5′-GCTTTCAATGA
CTGTGCCGT-3′。
用TRIzol(Invitrogen公司)抽提总RNA后去除基因组DNA。在37 ℃下30 min,20~50单位不含RNA酶的DNA酶I(Roche Diagnostics公司),用2步反转录酶聚合酶链反应(RT-PCR)试剂盒获得cDNA。用SYBR green的Taq预拌Mix(Sigma公司)和定量循环仪(Life公司)进行 RT-PCR。
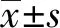
2 结果
2.1 各组小鼠体质量的变化IL-10 KO组小鼠出现不同程度的变化,KO+AIEC组的小鼠体质量下降明显(P<0.05);KO+K-12组的小鼠体质量无下降趋势(P>0.05);KO+PBS组的小鼠体质量有增加趋势(P>0.05)。而WT各组小鼠体质量均呈上升趋势,其中WT+K-12组的小鼠体质量明显上升(P<0.05)(见图1)。

图1 各组小鼠体质量的变化 A:IL-10 KO组小鼠; B:WT组小鼠Fig 1 Weight changes in each group A: IL-10 KO group; B: WT group
2.2 病理切片的炎症评分IL-10 KO小鼠给予AIEC灌胃后,大量炎症细胞(包括中性粒细胞和淋巴细胞)浸润达黏膜固有层和黏膜肌层,可见淋巴组织增生并有淋巴滤泡形成,有些部位出现糜烂和溃疡,黏膜下层增厚、水肿。其病理炎症评分与其他各组比较,差异有统计学意义(P<0.05)(见图2~3)。
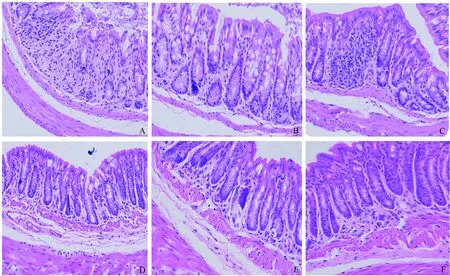
图2 各组小鼠的病理切片结果(200×) A:KO+AIEC组;B:KO+K-12组;C:KO+PBS组;D:WT+AIEC组;E:WT+K-12组;F:WT+PBS组Fig 2 Pathological section results of mice in each group (200×) A: KO+AIEC mice; B: KO+K-12 mice; C: KO+PBS mice; D: WT+AIEC mice; E: WT+K-12 mice; F: WT+PBS mice
2.3 各组小鼠的炎症评分KO+AIEC组与KO+PBS组、KO+K-12组比较,KO+AIEC组小鼠出现不同程度的便血、腹泻,炎症评分加重(P<0.05)。WT小鼠的各组炎症评分差异无统计学意义(P>0.05,见图4)。
2.4 各组TNF-α、INF-γ和IL-12 mRNA转录水平对比KO+AIEC组的TNF-α、INF-γ和IL-12 mRNA转录水平显著升高,与KO+PBS组、KO+K-12组比较,差异有统计学意义(P<0.01)。WT小鼠的各组TNF-α、INF-γ和IL-12 mRNA转录水平相比,差异无统计学意义(P>0.05,见图5)。

图3 IL-10 KO各组小鼠和WT各组小鼠的病理评分Fig 3 Pathological score of IL-10 KO mice and WT mice
3 讨论
IL-10是人类最重要的抗炎细胞因子之一。它由单核细胞、巨噬细胞、树突细胞等多种细胞分泌。IL-10可以抑制多种促炎细胞因子的分泌,如TNF-α、IL-1、IL-6和IL-12,且能调节巨噬细胞的分化和增殖,使巨噬细胞失活,抑制Th1分泌IL-2和IFN-γ等细胞因子[12],用IL-10 基因敲除小鼠模型在体内证实了IL-10在维持宿主免疫中起着核心作用。IL-10 KO小鼠在常规条件下发生强烈的炎症反应,且易发展为慢性小肠结肠炎,这种炎症可以通过给予IL-10制剂来预防[13]。但给已发生结肠炎的小鼠用IL-10治疗无效[14]。IL-10缺陷小鼠是由KÜHN等[15]于1993年将小鼠的IL-10基因靶向突变后的小鼠。该小鼠断奶后会发生自发性肠炎。这种自发性肠炎可以通过重组IL-10基因处理逆转。IL-10 KO小鼠的肠道不连续和透壁炎性病变的特点与IBD类似,因此,IL-10 KO小鼠是一个很好的研究IBD的动物研究模型[16]。IL-10 KO 小鼠在无细菌(GF)条件下不发生肠道炎症。但把它们放在无特定病原体环境(SPF)最早1周后就会发生肠道炎症。说明IL-10 KO小鼠结肠炎的发生依赖于环境中的微生物[17]。有研究发现,IBD患者的肠道中黏液相关的大肠杆菌菌株数量增加。其中,AIEC是一种可导致肠道炎症的病原体[18]。距从CD患者肠道中分离出第一株AIEC已有20多年,AIEC在CD中的致病机制仍是个谜[6]。在以往研究中,大肠杆菌UNC菌株已知可诱导IL-10 KO小鼠(129S6 /SvEv遗传背景)发生盲肠炎,小鼠从3周开始发生轻度盲肠炎,24周进展到中度炎症[19]。本研究证明,AIEC能使IL-10 KO小鼠肠炎加重。在本研究中,我们采用的IL-10 KO(C57BL/6遗传背景)小鼠肠道感染AIEC,4周后这些小鼠发生了轻度的肠道炎症,且肠道黏膜中巨噬细胞和T细胞相关的炎症因子如TNF-α、IFN-γ和IL-12均升高。近年临床和基础研究证实CD是一种由Th1/17介导的炎症,IFN-γ、IL-17、TNF-α等相关炎性因子的过量表达及效应性 T 细胞与调节性T 细胞的分化失衡是其免疫学上的重要特征[20]。AIEC的LF82和083:HI株诱导CD患者结肠组织中TNF-α、IFN-γ和IL-8表达增加。AIEC能刺激巨噬细胞分泌TNF-α等促炎因子,能引起感染的巨噬聚集及随后招募淋巴细胞。巨噬细胞和淋巴细胞分泌的TNF-α、IFN-γ又刺激表达癌胚抗原相关黏附分子6(carcinoembryonic antigen related adhesion molecules 6, CEACAM6)有利于AIEC在肠道黏膜的定植[21]。有研究用大肠杆菌处理IL-10 KO小鼠,小鼠的CD4+T细胞会分泌大量IFN-γ,该免疫反应发生在IL-10 KO小鼠的组织学炎症发生之前[19]。

注:与同时间点KO+K-12组和KO+PBS组比较,*P<0.05。图4 各组小鼠的炎症评分 A:IL-10 KO小鼠DAI评分;B:WT小鼠DAI评分

注:与KO+K-12组和KO+PBS组比较,*P<0.01。图5 结肠炎症因子TNF-α、IFN-γ和IL-12 mRNA水平
总之, AIEC能加重IL-10 KO小鼠结肠炎症,使其与巨噬细胞和T细胞相关的炎症因子TNF-α、IFN-γ和IL-12水平上调。 提示AIEC细菌感染是IBD发病的重要机制之一。

