腺病毒介导的肝脏X受体过表达在非酒精性脂肪性肝病中的机制研究
余 亮,江惠丽,刘豪杰
湖北省鄂州市中心医院消化内科,湖北 鄂州 436000
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)日益成为一个世界性的健康问题[1],但目前还无有效的药物治疗,因此研究NAFLD中脂代谢的重要调控因子成为攻克NAFLD的重要途径之一。其中,近年来肝脏X受体(liver X receptor, LXR)在肿瘤、代谢性疾病和炎症性疾病中得到了广泛的研究[2],但其在治疗NAFLD方面的生理和药理作用尚不明确。激活LXR具有调节胆固醇稳态、诱导抗炎作用和促进胰岛素灵敏性的作用[3-4],但LXR主要通过反式激活转录因子固醇调节元件结合蛋白1(sterol-regulatory element binding proteins, SREBP1) 促进脂质合成,进而导致肝脏脂质沉积和高甘油三酯(triglycerides,TG)血症的发生[5]。在NAFLD背景下抑制肝脏LXR转录活性可以有效缓解肝脂肪变性,但会增加潜在心血管疾病的风险,导致炎症和胰岛素抵抗的增加[6]。LXR在NAFLD治疗中的相互矛盾增加了靶向药物开发的难度。本研究利用过表达LXR基因,不仅检测脂质合成相关基因的表达,进一步检测脂质分解相关基因的表达,探究LXR在肝脏脂质分解方面的作用,解释LXR抑制剂临床应用中出现的心血管风险和胰岛素抵抗增加的原因,进而寻找LXR在NAFLD治疗中的调控因子,达到有效治疗NAFLD的目的。
1 材料与方法
1.1 材料过表达LXR腺病毒购自上海汉恒生物有限公司,细胞总RNA抽提试剂TRIzol购自Invitrogen公司;M-MLV反转录试剂盒购自Invitrogen公司;DMEM培养基和胎牛血清(FBS, Fetal Bovine Serum)购自GIBCO公司;Trypin、青链霉素(penicillin-streptomycin)和L-Glutamine均购自Invitrogen公司;细胞培养皿购自Corning 公司;转染试剂PEI(Polyethylenimine,linear)购自Polysciences公司。蛋白酶抑制剂、PVDF膜、 蛋白印迹化学发光试剂购自上海煊翎生物有限公司,SREBP1抗体、SCD1抗体、HSL抗体、ATGL抗体、Tubulin抗体均购自上海煊翎生物有限公司。过表达LXR腺病毒购自上海汉恒生物有限公司, 采用AdMax重组腺病毒系统过表达全长LXR共1 802 bp(转录本1)。
1.2 HepG2细胞的培养及病毒转染HepG2细胞培养在质量浓度为100 g/L的胎牛血清的DMEM培养液中,静置培养于保持37 ℃、体积分数为5% CO2的细胞培养箱。DMEM完全培养液中含有100 U/ml的青霉素及100 μg/ml的链霉素。细胞接种于12孔板,LXR过表达组用PEI转染LXR腺病毒,对照组用载体腺病毒作为对照,每孔2 μl病毒液。48 h后检测病毒的转染效率。由于细胞含有表达GFP元件,荧光显微镜拍照,检测细胞的状态以及转染效率。
1.3 qRT-PCR检测LXR腺病毒的过表达效率Trizol提取细胞的总RNA:具体步骤:Trizol室温裂解,异丙醇混匀RNA沉淀, 75%酒精(DEPC水配制)洗涤RNA沉淀,晾干残留乙醇,将沉淀通过60 ℃水浴溶于适量DEPC水中,检测RNA纯度及浓度;TaKaRa公司的RNase-free DNase I试剂盒处理以除去DNA污染,取2 μg RNA逆转录得到cDNA。使用Applied Biosystems公司的SYBR Green PCR system,以Tubulin为内参,进行基因的qRT-PCR检测,所使用的qRT-PCR引物合成于上海生工,具体引物序列:Mouse Lxr sense 5′-TACGCAGTCTGACTGCATCGAT-3′,antisense 5′-GGTCTAGTCATGCATTGCATG-3′;Mouse Tubulin sense 5′-AGTGTGACGTTGACATCCGTA-3′,antisense 5′-GCCAGAGCAGTAATCTCCTTCT-3′。
1.4 Western blotting检测腺病毒的过表达效率细胞用RIPA裂解后进行蛋白浓度测定,再用上样缓冲液制样。用10%的SDS-PAGE胶上样电泳后以300~400 mA恒流将蛋白电转到PVDF膜上,按照膜上的彩色蛋白Marker根据要检测蛋白大小切割出不同的膜条,用质量浓度为50 g/L脱脂奶粉封闭PVDF膜1 h。一抗LXR抗体(1∶1 000)、Tubulin抗体(1∶2 000)4 ℃过夜。二抗(1∶3 000)室温结合1~3 h,用显影液曝光显影。
1.5 检测细胞中的TG含量TG测定试剂盒购自南京建成生物有限公司, 利用GPO-PAP 酶法检测细胞中的TG含量,冰水浴条件下细胞在磷酸盐缓冲液中进行匀浆,超声破碎,取裂解好的液体2.5 μl加入250 μl GPO-PAP 酶液混匀,37 ℃孵育10 min,波长 510 nm,酶标仪测定各孔吸光度值。
1.6 小鼠的饲养和感染LXR过表达腺病毒雄性野生型C57BL/6小鼠购自上海斯莱克动物中心,饲养在SPF级动物房中,小鼠可任意进食及饮水,动物房保持温度(22±3)℃,湿度(35±5)%,12 h昼夜周期。所有实验均使用10周龄雄鼠。过表达组小鼠尾静脉注射LXR过表达腺病毒(1×1011),对照组小鼠尾静脉注射对照载体病毒(1×1011),每组6只小鼠,小鼠注射病毒后饲养3周,小鼠处死之前称量小鼠体质量,然后用戊巴比妥钠麻醉,肝脏组织块从小鼠中取出后称量肝脏重量,于直接用于液氮中短暂保存,-80 ℃冰箱贮存。
1.7 检测LXR过表达后小鼠肝脏TG含量肝脏TG测定同样利用GPO-PAP 酶法检测,冰水浴条件下肝脏在无水乙醇中进行匀浆,超声破碎,取裂解好的液体2.5 μl加入250 μl GPO-PAP 酶液混匀,37 ℃孵育 10 min,波长510 nm,酶标仪测定各孔吸光度值。
1.8 qRT-PCR检测LXR腺病毒的过表达后肝脏脂质代谢相关基因的表达Trizol提取肝脏的总RNA:具体步骤:肝脏组织研磨,Trizol室温裂解,异丙醇混匀RNA沉淀,75%酒精(DEPC水配制)洗涤RNA沉淀,晾干残留乙醇,将沉淀通过60 ℃水浴溶于适量DEPC水中,检测RNA纯度及浓度;TaKaRa公司的RNase-free DNase I试剂盒处理以除去DNA污染,取2 μg RNA做逆转录得到cDNA。使用Applied Biosystems公司的SYBR Green PCR system,以Tubulin为内参,进行基因的qRT-PCR检测,所使用的qRT-PCR引物合成购自上海生工,具体引物序列:Mouse Srebp1 sense 5′-TGGACTCGCTACGCATACCG-3′,antisense 5′-GTCCATGGGACCCTATTCATTCTGG-3′;Mouse Scd1 sense 5′-CTGAG-
TTCAAACCCCTTGCAG-3′,antisense 5′-GTCCATAACCCCTATCTATGTTCTGG-3′;Mouse Hsl sense 5′- CGAC-
TCCCAGGCTGTGTGA-3′, antisense 5′-GTTGAACAAC-
TGATCCGACCA-3′;Mouse Atgl sense 5′-AAGCATTACCGGCAACTTCGTTC-3′,antisense 5′- GGGCGAGTAAA-
CGTGGTGTCAAT-3′;Mouse Tubulin sense 5′-AGTGTGACGTTGACATCCGTA-3′, antisense 5′-GCCAGAGCA-
GTAATCTCCTTCT-3′。
1.9 Western blotting检测LXR腺病毒的过表达后肝脏脂质代谢相关蛋白的表达肝脏组织在RIPA裂解液中裂解,离心后取上清进行蛋白浓度测定,再用上样缓冲液制样。用10%的SDS-PAGE胶上样电泳后以300~400 mA恒流将蛋白电转到PVDF膜上,按照膜上的彩色蛋白Marker根据检测蛋白大小切割出不同的膜条,用质量浓度为50 g/L脱脂奶粉封闭PVDF膜1 h。一抗SREBP1抗体(1∶1 000)、一抗SCD1抗体(1∶1 000)、一抗ATGL抗体(1∶1 000)、一抗HSL抗体(1∶1 000)、Tubulin抗体(1∶2 000)4 ℃过夜。二抗(1∶3 000)室温结合1~3 h,用显影液曝光显影。
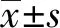
2 结果
2.1 检测LXR腺病毒的过表达效率qRT-PCR结果显示,LXR腺病毒转染的细胞中LXR mRNA水平显著升高,LXR过表达组LXR mRNA相对水平4.76±0.50,对照组LXR mRNA相对水平1.01±0.09,LXR过表达组LXR mRNA升高约4.69倍(P<0.001)(见图1)。Western blotting结果显示,LXR腺病毒转染的细胞中LXR蛋白水平显著升高,对照组LXR 蛋白相对水平0.97±0.04,LXR过表达组LXR 蛋白相对水平3.73±0.25,升高约3.82倍(P<0.001)(见图2A、2B),表明LXR腺病毒构建成功。病毒感染后的荧光表达,结果(见图3)显示,两组病毒均表达GFP元件,病毒具有较高的表达效率。

注:与对照组比较,***P<0.001。

注:与对照组比较,***P<0.001。

图3 HepG2细胞GFP荧光表达Fig 3 Fluorescence expression of GFP in HepG2 cells
2.2 细胞内TG含量检测结果LXR过表达后48 h HepG2细胞中TG含量显著增多,LXR过表达组HepG2细胞中TG含量(0.54±0.02)μg/g,对照组HepG2细胞中TG含量(0.25±0.008)μg/g(见图4),LXR过表达组较对照组增加2.16倍,差异有统计学意义(P<0.01)。表明LXR腺病毒转染的细胞TG累积增加。
2.3 小鼠体质量及肝脏重量检测结果雄性野生型C57BL/6小鼠尾静脉注射LXR过表达腺病毒3周后,小鼠体质量显著增加,LXR过表达组小鼠体质量(26.95±0.85)g,对照组小鼠体质量(22.6±1.53)g(见图5A),LXR过表达组较对照组增加1.19倍,差异有统计学意义(P=0.006)。小鼠肝脏组织重量过表达组和对照组差异较大,LXR过表达组小鼠肝脏重量(1.49±0.18)g,对照组小鼠肝脏重量(1.01±0.0.10)g(见图5B),LXR过表达组较对照组增加1.47倍,差异有统计学意义(P=0.008)。LXR过表达显著促进小鼠体质量增加和肝脏重量的增加。

注:与对照组比较,**P<0.01。

注:与对照组比较,**P<0.01。
2.4 小鼠肝脏TG含量检测结果雄性野生型C57BL/6小鼠尾静脉注射LXR过表达3周后,进一步检测了肝脏组织中的TG含量。检测结果显示,小鼠肝脏中LXR过表达3周后,小鼠肝脏中TG含量显著增多,LXR过表达组小鼠肝脏中TG含量(0.28±0.02)mg/g,对照组小鼠肝脏中TG含量(0.23±0.03)mg/g(见图6),LXR过表达组较对照组增加1.26倍,差异有统计学意义(P=0.019)。LXR过表达可以显著促进小鼠肝脏内中TG沉积。

注:与对照组比较,*P<0.05。
2.5 小鼠肝脏脂质合成相关基因表达情况为了进一步探究雄性野生型C57BL/6小鼠尾静脉注射LXR过表达3周后小鼠肝脏TG含量增加的原因,我们利用qRT-PCR和Western blotting方法检测小鼠肝脏中脂质合成相关基因的表达水平。RT-PCR结果显示,LXR过表达后小鼠肝脏脂肪合成基因Srebp1 mRNA(LXR过表达组3.2±0.46vs对照组1.01±0.09,P<0.001)和Scd1 mRNA(LXR过表达组3.07±0.49vs对照组1.05±0.22,P=0.0015),LXR过表达组水平显著升高,分别升高约3.15倍和2.9倍(见图7A、7B),Western blotting结果显示,LXR过表达后小鼠肝脏脂质合成调控蛋白Srebp1和Scd1蛋白水平显著升高(见图7C),表明LXR通过促进肝脏脂质合成促进TG的沉积。
2.6 小鼠肝脏脂质分解相关基因表达情况我们从脂质分解相方面进一步探究雄性野生型C57BL/6小鼠尾静脉注射LXR过表达3周后肝脏TG含量增加的原因,我们利用qRT-PCR和Western blotting检测小鼠肝脏中脂质分解相关基因的表达水平。qRT-PCR结果显示,LXR过表达后小鼠肝脏脂肪分解基因Atgl mRNA(LXR过表达组1.03±0.25vs对照组0.47±0.21,P=0.019)和Hsl mRNA(LXR过表达组1.02±0.16vs对照组0.57±0.15,P=0.012),LXR过表达组水平显著下调(见图8A、8B),Western blotting结果显示,LXR过表达后小鼠肝脏脂质合成调控蛋白Atgl和Hsl蛋白水平显著下调(见图8C),表明LXR通过抑制肝脏脂质分解间接促进脂质的沉积。

注:与对照组比较,**P<0.01,***P<0.001。

注:与对照组比较,*P<0.05。
3 讨论
LXR是一种核受体,在代谢紊乱、抗炎、免疫调节等方面发挥重要作用。研究发现,在肝脏疾病进展的不同阶段LXR表达不同[7],30%的正常人,50%单纯脂肪变性人群和97%的脂肪性肝炎人群发现有LXR表达升高,LXR高表达与肝脂肪变性的程度呈正相关,同时与肝脏的炎症、纤维化均相关[8]。在NAFLD患者的不同组织中,LXR表达水平存在差异,据报道LXR在肝脏和外周血单核细胞表达上调,在回肠表达下调[9-10]。有研究[6]表明,肠道LXR的激活通过转录后机制下调SR-B1来调节TG的吸收,从而减少乳糜微粒的产生。
现有研究表明,LXR可以刺激下游靶基因的表达,如甾醇调节元件结合蛋白1c (SREBP-1c)、脂肪酸合成酶(FASN)、硬脂酰辅酶A去饱和酶1 (SCD-1)、乙酰辅酶A羧化酶(ACC),促进肝脏脂质生成[11]。SR9238是肝脏LXR的选择性逆激动剂,能有效地将辅抑制因子招募到脂肪基因启动子区,减少肝脏脂质变性[12]。SR9238对LXR转录活性抑制,减少肝脏内脂质积累的同时胰岛素抵抗以及相关炎症增加[13-14]。本研究利用过表达LXR腺病毒,首先检测病毒的过表达效果,然后利用LXR腺病毒感染雄性野生型C57BL/6小鼠,3周后检测小鼠体质量、肝脏重量及肝脏TG的变化,同时利用qRT-PCR和Western blotting检测小鼠肝脏中脂质合成相关基因以及分解相关基因的表达水平,探究LXR在肝脏脂质分解方面的作用。
本研究从脂质合成和脂质分解两个方面探究LXR对肝脏脂质代谢的调控作用,发现LXR可以显著促进体外细胞中脂质累积,促进小鼠体质量增加、小鼠肝脏重量增加以及脂质累积。在分子机制方面,我们发现LXR不仅可以通过上调脂质合成基因Srebp1和Scd1的表达促进肝脏脂质沉积。还可以通过抑制肝脏脂质分解基因Atgl和Hsl间接促进肝脏脂质的沉积。这就进一步解释了LXR拮抗剂在临床上治疗NAFLD时,在减少患者脂肪肝变性的同时,可以诱导胰岛素抵抗以及炎症发生的原因。
激活或抑制LXR是否对NASH治疗有潜在益处的不确定性阻碍了LXR相关药物的发展[13]。目前LXR靶向合成小分子药物的临床安全性和有效性有待进一步验证。LXR受体拮抗剂已被重新应用到脂肪肝小鼠中抑制肝脏脂肪变性,但是 LXR在NAFLD患者的脂代谢中的重要作用不能使我们忽视其中伴随的心脑血管疾病风险[15-16],尤其是当LXR被抑制后,脂质分解水平升高,导致一系列的心血管和脑血管疾病以及胰岛素抵抗的潜在风险[4]。
天然提取物是从动植物体内或代谢产物中提取出来的,在探索新的结构化合物和药物发现中起着重要作用。一些天然提取物通过靶向LXR途径减轻NAFLD,具有良好的治疗前景[17]。NAFLD是全球范围内一个日益严重的健康问题,由于天然产物已被证明在改善NAFLD方面有效,筛选来自天然产物的LXR配体为NAFLD中LXR相关药物的开发提供了另一种方法。

