糖尿病合并冠心病患者颈动脉粥样硬化斑块钙化的影响因素及其与血清Nε-羧甲基赖氨酸水平的相关性
李天文
(江油市人民医院心血管内科,四川 江油621700)
颈动脉粥样硬化斑块是颈动脉变厚并失去弹性,部分内膜下脂质沉积,且伴有平滑肌和纤维基质成份的增殖而逐渐形成的,在糖尿病合并冠心病患者中较为常见。相关研究显示,颈动脉粥样硬化斑块钙化是发生心脑血管病的关键因素,严重威胁患者生命安全,且相对于单纯冠心病患者而言,合并糖尿病患者颈动脉粥样硬化斑块钙化发生率更高[1-2]。Nε-羧甲基赖氨酸(CML)是糖基化的终末产物,其与受体结合后会释放促炎因子,并加重氧化应激反应,加重血管粥样硬化[3],而当前关于CML和颈动脉粥样硬化斑块钙化相关性的临床研究极少。本研究旨在探讨血清CML水平与颈动脉粥样硬化斑块钙化的相关性,以期为临床进行相关干预提供依据。具体报道如下。
材料和方法
1 一般资料
将2016年4月至2018年3月我院收治的84例糖尿病合并冠心病患者作为研究对象,其中男45例,女39例,年龄41~78岁,平均年龄59.8±8.6岁。纳入标准:①冠心病诊断符合WHO临床命名标准化联合专题组报告《缺血性心脏病的命名及诊断标准》;②糖尿病符合世界卫生组织(WHO)糖尿病相关诊断标准;③年龄≥18岁。排除标准:①先天性心脏病;②合并恶性肿瘤;③合并血液系统疾病;④严重感染;⑤合并精神性疾病。本研究通过伦理委员会批准,受试者均签署知情同意书。
2 方法
2.1 资料收集 收集患者性别、年龄、体质指数(BMI)、吸烟史、饮酒史、糖尿病病程、冠心病病程、血压[收缩压(SBP)、舒张压(DBP)]、血糖[空腹血糖(FPG)、餐后2h血糖(2hPG)]、血脂[血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)]等资料。
2.2 血清CML检测 采集受检者清晨空腹静脉血5mL,离心分离血清,并于-80℃冰箱中保存,以酶联免疫吸附法(ELISA)检测血清CML水平,试剂盒由南京建成生物工程研究所提供。
2.3 颈部CT血管造影(CTA)检查 患者于采集静脉血检测血清CML当天行颈部CTA检查,采用西门子64排螺旋CT仪对患者进行颈部扫描,患者取仰卧位,扫描范围由主动脉弓至颈内动脉鞍上2 cm,扫描参数:管电压120 kV,管电流300 mA,准直器宽度64mm×0.6mm,螺距0.923mm,重建层厚1.0mm,矩阵512×512。静脉留置针自右肘正中静脉注射,以双筒高压注射器注射对比剂碘普罗胺,剂量80mL,速率5.0mL/s,再注射生理盐水40mL,速率4.5~5.0mL/s。将所获图像传入西门子工作站后处理,识别管壁钙化情况,评估范围为颈动脉分叉下方3cm内窦部与颈总动脉,颈动脉分叉上方1.5cm内颈内动脉与颈外动脉。将钙化面积为4个紧邻像素CT=130HU作为临界值,当CT>130HU时,判断为斑块钙化。所评估的血管段内斑块钙化≥1处即为钙化组,未发现钙化即为无钙化组。
3 统计学处理
数据采用SPSS20.0软件分析,计数资料使用百分率(%)表示,采用χ2检验;计量资料使用()表示,采用t检验;对有统计学意义的影响因素运用多元Logistic回归分析,以P<0.05为差异有统计学意义。
结 果
1 两组患者临床资料比较
检查结果显示,钙化组患者53例,无钙化组患者31例。两组患者临床资料比较显示,钙化组性别、吸烟史、饮酒史与无钙化组差异无统计学意义(P>0.05),年龄、BMI、糖尿病病程、冠心病病程、SBP、DBP、FPG、2hPG、HbAlc、TG、TC、LDL-C及CML水平均高于无钙化组,HDL-C水平低于无钙化组,差异均有统计学意义(P<0.05)。见表1。
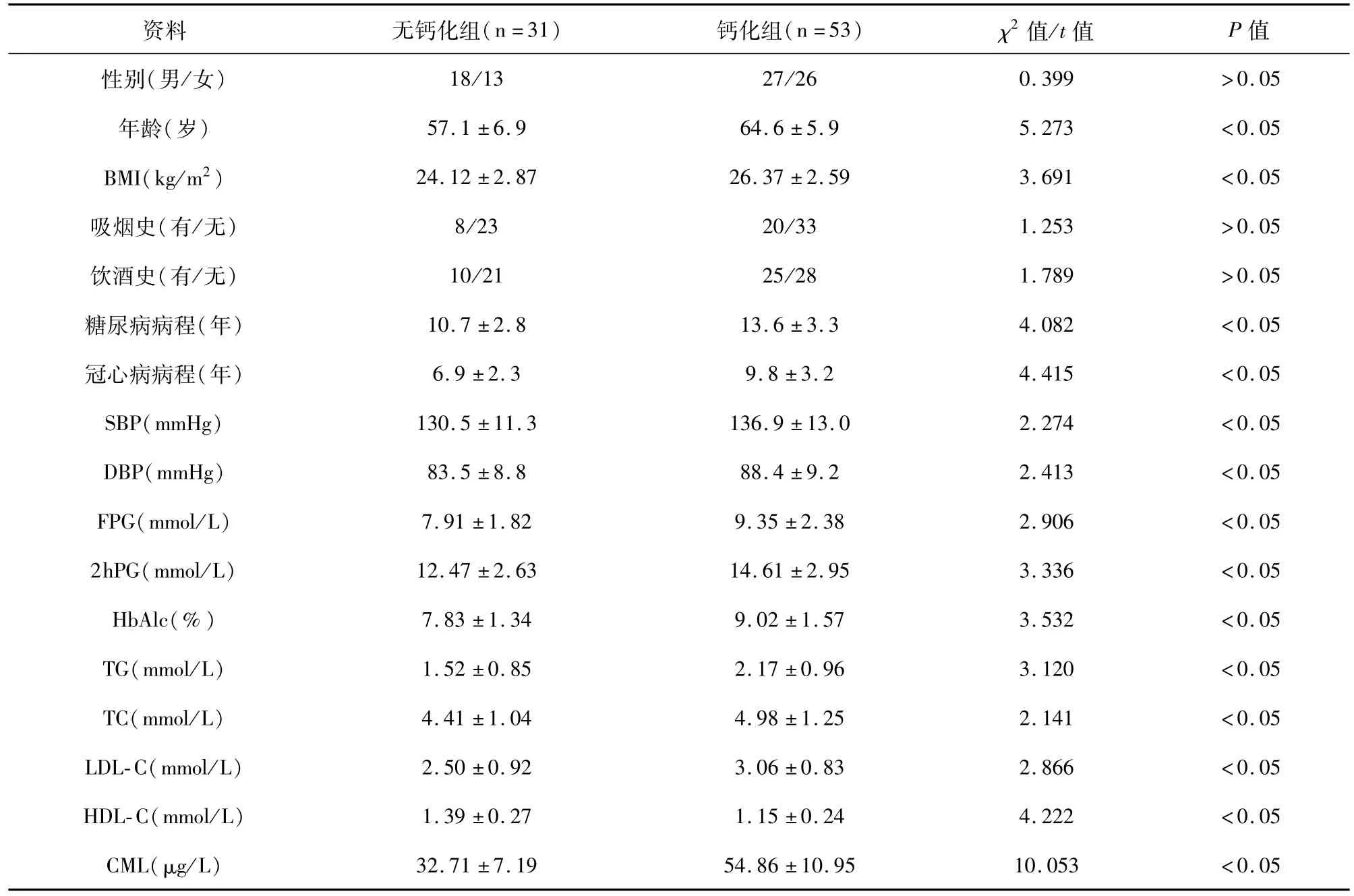
表1 两组患者临床资料比较
2 多因素Logistic回归分析
对临床资料比较具有统计学差异的影响因素进行Logistic回归分析,显示年龄、糖尿病病程、冠心病病程、血清CML水平均是颈动脉粥样硬化斑块钙化发生的独立危险因素。见表2。
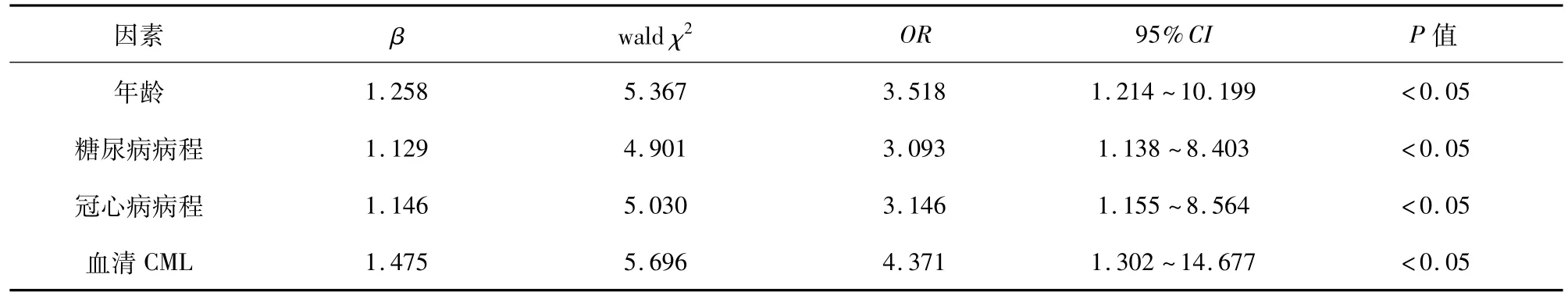
表2 多因素Logistic回归分析
讨 论
糖尿病合并冠心病发病率呈上升趋势,死亡率也越来越高,给患者家庭和社会带来较大负担[4-5]。颈动脉粥样硬化斑块形成和钙化是糖尿病患者发生动脉血管病变的重要评价指标,可评估心血管疾病转归效果[6]。CTA为斑块钙化主要评估方法,可有效辨别斑块钙化形成及组成成份[7],本次CTA检查结果显示颈动脉粥样硬化斑块钙化患者53例,无钙化患者31例,比例分别为63.1%、36.9%,说明糖尿病合并冠心病患者颈动脉粥样硬化斑块钙化发生率较高。
为探讨颈动脉粥样硬化斑块钙化影响因素,本次研究对钙化组与无钙化组患者临床资料进行比较,显示钙化组性别、吸烟史、饮酒史与无钙化组差异无统计学意义(P>0.05),年龄、BMI、糖尿病病程、冠心病病程、SBP、DBP、FPG、2hPG、HbAlc、TG、TC、LDL-C及CML水平均高于无钙化组(P<0.05),HDL-C水平低于无钙化组(P<0.05),表明年龄、BMI、糖尿病病程、冠心病病程、血压、血糖、血脂和血清CML水平可能促进颈动脉粥样硬化斑块钙化形成。季明等[8]的研究亦显示,患者年龄、糖尿病病程会增加颈动脉粥样硬化斑块钙化形成风险。STROBL等[9]研究也显示,年龄超过65岁者颈动脉硬化斑块钙化发生率较高。血压升高会降低血管内皮舒张因子反应性,升高血管内皮收缩因子,促进血管平滑肌和胶原纤维增生,使得血管内膜增厚。肥胖患者血脂水平相较于正常体重患者较高,血脂代谢异常,脂质易在动脉管壁沉积,导致血管壁增厚,管腔狭窄,不仅影响血流量,还会加重血管内皮损伤[10],促进动脉粥样硬化斑块形成。糖尿病患者高血糖会使血液黏性增加,血流速度减缓,复合糖类沉积,同时也会加重氧化应激反应,进而引起纤维组织增生,纤维蛋白溶解系统活性异常,致使血管平滑肌钙化[11],尤其是长期持续高水平血糖,会加重动脉壁糖基化终末产物堆积[12-13],而CML作为糖基化终末产物的重要代表,其水平也会异常升高。研究表明,CML与其受体结合后可通过相关蛋白酶,如蛋白激酶C、p38促分裂原激活蛋白激酶等,促进转录因子cbfa1表达,进而促进碱性磷酸酶(TNAP)活化,而TNAP可通过水解磷酸酯提供羟基磷灰石沉积所需的磷酸,羟基磷灰石沉积增加,颈动脉粥样硬化斑块钙化亦加重[14-15]。李丽华等[16]分析糖尿病患者血清CML与胫前动脉斑块内钙化关系,显示随着血清CML水平的升高,胫前动脉斑块内钙化发生风险也会增大。进一步进行多因素Logistic回归分析,结果显示年龄、糖尿病病程、冠心病病程、血清CML水平均是颈动脉粥样硬化斑块钙化发生的独立危险因素,表明年龄的增加、糖尿病和冠心病病程的延长、血清CML水平的升高均会增加颈动脉粥样硬化斑块钙化发生率。
综上所述,血清CML水平异常升高会促进糖尿病合并冠心病患者颈动脉粥样硬化斑块钙化的发生及发展,可将血清CML水平作为临床评估颈动脉粥样硬化斑块钙化的指标。

