除膻菌株的功能性分析
李秋桐,苏伟,母应春
(贵州大学酿酒与食品工程学院,贵州 贵阳 550025)
膻味是羊肉具有的一种不良风味,人们对羊肉的膻味进行了大量研究,发现这种特征风味物质主要来源于羊肉的脂肪组织[1]。8 个~10 个碳原子的不饱和脂肪酸对羊肉的风味影响很大,尤其是4-甲基辛酸和4-乙基辛酸是形成羊肉膻味的主要脂肪酸[2]。微生物除膻是一种较好的除膻方法,通过将菌株接种到羊肉中,微生物产生的脂肪酶与羊肉中的脂肪酸产生作用,对羊肉的风味起到改善作用,一定程度上降低了羊肉的膻味[3]。传统的方法中,采用添加橄榄油和指示剂的平板对脂肪酶产生菌进行分离筛选。通过对培养基进行改良,将橄榄油替换成羊油,将乳化后的羊油和荧光指示剂加入到筛选平板中,筛选出4 株能酶解羊油的霉菌,经鉴定分别为微孢根霉(Rhizopus microsporus),米根霉(Rhizopus oryzae),米曲霉(Aspergillus oryzae)和多枝横梗霉(Lichtheimia ramosa)。并通过液态发酵试验,发现这4 株霉菌对4-甲基辛酸和4-乙基辛酸均具有降解作用,可以用于羊肉除膻。
在菌种发酵的过程中,一些微生物会产生H2S、生物胺,赋予产品不好的感官品质[4-5]。H2S 是一种急性剧毒,吸入少量高浓度的H2S 即可使人于短时间内致命,即使是低浓度的H2S 也会对眼睛、呼吸系统及中枢神经造成影响[6]。人体摄入过量的生物胺会引起中毒,表现出头疼、心悸、呕吐、血压变化和呼吸紊乱等严重反应,除此之外尸胺、腐胺、精胺和亚精胺等与亚硝酸盐反应能产生致癌物质亚硝基胺[7]。发酵肉制品在制作过程中,大都会添加一定量的食盐和亚硝酸盐,起到调味和防腐的双重功效。当食盐及亚硝酸盐达到一定浓度时,会对微生物产生透胁迫及毒性作用,使微生物受到抑制甚至死亡[8]。因此筛选出的菌株应对盐类具有一定的耐受能力。
本试验对分离筛选出的4 株霉菌进行功能性分析,包括脂肪酶活性的测定、产H2S 测定试验、产生物胺测定试验和抑菌试验,并对其耐盐性、耐硝酸盐性及生长曲线进行测定,进一步筛选出合适的菌株进行拮抗试验和复配试验,为后续菌株应用于羊肉发酵提供理论基础。
1 材料与方法
1.1 材料与试剂
微孢根霉(Rhizopus microsporus)TZH1、米根霉(Rhizopus oryzae)TZH3、米曲霉 (Aspergillus oryzae)TZH4、多枝横梗霉(Lichtheimia ramosa)4QT3、大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus):贵州大学畜产品加工实验室。
NaOH、酚酞(分析纯):成都金山化学试剂有限公司;橄榄油(分析纯):国药集团化学试剂有限公司;Na2HPO4·12H2O、FeCl2(分析纯):天津市光复精细化工研究所;KH2PO4、溴甲酚紫(分析纯):天津市科密欧化学试剂开发中心;95%酒精(分析纯):天津市富宇精细化有限公司;NaCl(分析纯):天津市致远化学试剂有限公司;NaNO2(分析纯):天津市永大化学试剂有限公司;磷酸吡哆醛、硫胺素、赖氨酸、酪氨酸、精氨酸(分析纯):北京索莱宝科技有限公司;用于聚合酶链式反应(polymerase chain reaction,PCR)扩增的全套试剂和扩增引物:生工生物工程(上海)股份有限公司。
液体发酵培养基[9-10]:蛋白胨20.0 g、蔗糖5.0 g、(NH4)2SO41.0 g、MgSO40.5 g、K2HPO41.0 g、羊油 10.0 g(用2%聚乙烯醇乳化,羊油与聚乙烯醇按质量比1 ∶4、蒸馏水 1 000 mL,pH7.0,121 ℃灭菌 20 min。
马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)培养基:马铃薯浸粉5.0 g、葡萄糖20.0 g、琼脂15.0 g、氯霉素 0.1 g、蒸馏水 1 000 mL,pH7.0,121 ℃灭菌20 min。
马铃薯葡萄糖肉汤(potato dextrose both,PDB)培养基:马铃薯浸粉5.0 g、葡萄糖20.0 g、氯霉素0.1 g、蒸馏水 1 000 mL,pH7.0,121 ℃灭菌 20 min。
H2S 测定培养基:蛋白胨 10.0 g、牛肉膏 5.0 g、琼脂 20.0 g、NaCl 5.0 g、蒸馏水 1 000 mL,pH7.0,121 ℃灭菌20 min;FeCl2溶液:将FeCl2晶体先溶解在较浓盐酸中,然后再用蒸馏水稀释,再加入少量铁粉;在琼脂凝固前,将等量的FeCl2溶液在无菌条件下注入试管中,待其冷却凝固即可接种菌株。
生物胺测定培养基[11]:蛋白胨10.0 g、牛肉膏5.0 g、K2HPO42.0 g、CaCO30.1 g,蒸馏水 1 000 mL,pH7.0,121 ℃灭菌20 min;无菌条件下加入硫胺素0.01 g、磷酸吡哆醛0.05 mg、溴甲酚紫0.05 g。
耐盐测试培养基:蛋白胨10.0 g、牛肉膏5.0 g、NaCl 80.0 g、蒸馏水 1 000 mL,pH7.0,121 ℃灭菌 20 min。
耐亚硝酸盐测试培养基:蛋白胨10.0 g、牛肉膏5.0 g、NaNO2150.0 mg、蒸馏水 1 000 mL,pH7.0,121 ℃灭菌20 min。
1.2 仪器与设备
YXQ-LS-100SII 立式压力蒸汽灭菌器:上海博讯实业有限公司医疗设备厂;电热恒温培养箱(DPH-420):天津天泰仪器有限公司;电子天平(FA2004N):上海青海仪器有限公司;全温摇瓶柜(HYG-A):苏州培英实验设备有限公司;超声波细胞粉碎机(BILON88-II):上海比郎仪器制造有限公司;离心机(TGL20M):长沙边佳森仪器设备有限公司;恒温水浴箱(DK-98-II):天津泰斯特仪器有限公司;紫外可见光光度计(756S):上海棱光技术有限公司。
1.3 方法
1.3.1 种子液的制备
无菌条件下,分别将TZH1、TZH3、TZH4 和4QT3这4 株霉菌接种于配制好的PDB 培养基中,30 ℃下培养72 h,制成4 株霉菌的种子菌液。
1.3.2 脂肪酶活力的测定
将菌株的种子菌液接种到液体发酵培养基中,接种量为5%,30 ℃下180 r/min 培养72 h。培养完毕后,取发酵液于4 ℃,8 000 r/min 离心15 min,上清液即为粗酶液,用于测定脂肪酶活力[12]。
取两个150 mL 的三角瓶,记为为空白组和样品组。分别向两组三角瓶中加入4.0 mL 乳化橄榄油底物溶液和5.0 mL 缓冲液,再于空白组中加入95%的酒精15.00 mL,于40 ℃下水浴中预热5 min,然后各自加入1.0 mL 酶液充分混匀,反应15 min 后立即向样品组中加入95%的酒精15.00 mL 使反应终止,取出[13]。
向两组三角瓶中分别滴入两滴酚酞指示剂,用0.05 mol/L 的NaOH 标准溶液进行滴定,至微红色并在30 s 后不褪色为滴定终点,记录NaOH 标准溶液消耗体积并计算。脂肪酶活力的计算公式如下:
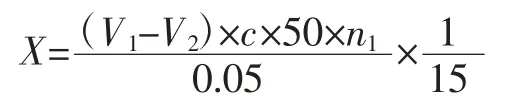
式中:X 为样品的酶活力,U/g;V1为滴定样品组时消耗NaOH 标准溶液的体积数,mL;V2为滴定空白组时消耗 NaOH 标准溶液的体积数,mL;c 为 NaOH 标准溶液浓度,mol/L;n1为样品的稀释倍数。
1.3.3 生长曲线的测定
分别将菌株以2%的接种量接种于PDB 培养基中,30 ℃下培养,每隔2 h 取菌液测定600 nm 下的OD值,取至36 h,绘制菌株的生长曲线图。
1.3.4 产H2S 及产生物胺测定试验
将FeCl2溶液注入到试管中,待琼脂冷却凝固后,用移液枪分别吸取4 种菌液各50 μL,插入到琼脂中进行接种,30 ℃下培育7 d,观察琼脂是否变成黑色,若变为黑色则说明该菌株产H2S 记为阳性,不变黑色记为阴性,每株菌做2 个平行试验[14]。
无菌条件下,称取1%的赖氨酸、酪氨酸和精氨酸混合氨基酸,添加到生物胺测定培养基中,混匀,对照组培养基中不添加氨基酸。分别将菌株接种到生物胺培养基中,30 ℃下培养3 d,观察颜色变化,若由黄色变为紫色则说明该菌株产氨基酸脱羧酶记为阳性,反之记为阴性[15]。
1.3.5 抑菌试验
以大肠杆菌和葡萄球菌作为指示菌。各挑取一环保藏在甘油中的大肠杆菌和葡萄球菌,在平板上划线活化2 代后,用无菌生理盐水制成浓度为107cfu/mL的菌悬液。用移液枪分别吸取200 μL 的指示菌菌悬液于PDA 培养基中,用涂布棒涂布均匀,静置5 min。随后用6 mm 的无菌打孔器在培养基上打孔。分别取4株菌株的菌液各 50 μL,4 ℃下 8 000 r/min 冷冻离心15 min,加入到培养基孔中,30 ℃下培养48 h。观察孔周围是否出现抑菌圈,并记录出现的抑菌圈直径,每株菌做2 个平行试验[14]。
1.3.6 耐盐性及耐亚硝酸盐性试验
将菌株分别接种于含8%NaCl 的耐盐测试培养基中,对照组不接种菌液,30 ℃下培养72 h,测定600 nm处的OD 值,每组样品测定3个平行,并计算“对照组OD 值/样品组 OD 值”的比值[16]。
将菌株分别接种于含0.015%NaNO2的耐亚硝酸盐培养基中,对照组不接种菌液,30 ℃下培养72 h,测定600 nm 处的OD 值,每组样品测定3 个平行,并计算“对照组 OD 值/样品组 OD 值”的比值。
1.3.7 菌株的拮抗试验与复配试验
通过上述试验筛选出2 株合适的菌株,将菌株在PDA 培养基上交叉划Z 线,30 ℃下培养72 h 后,观察是否均有菌落生长,划线的交叉处是否出现相互抑制生长的现象,若无该现象则说明这2 株菌不具有措抗作用[17]。
将 2 株菌的种子液按 1 ∶1、1 ∶2、2 ∶1 的体积比分别接种于新的PDB 培养基中,30 ℃下培养,在培养12、24、36、48、60、72 h 时取菌液测定 600 nm 处的 OD值,同时测定pH 值。
2 结果与分析
2.1 脂肪酶活力的测定试验
在相同条件下对菌株进行培养,脂肪酶活力测定结果如图1所示。
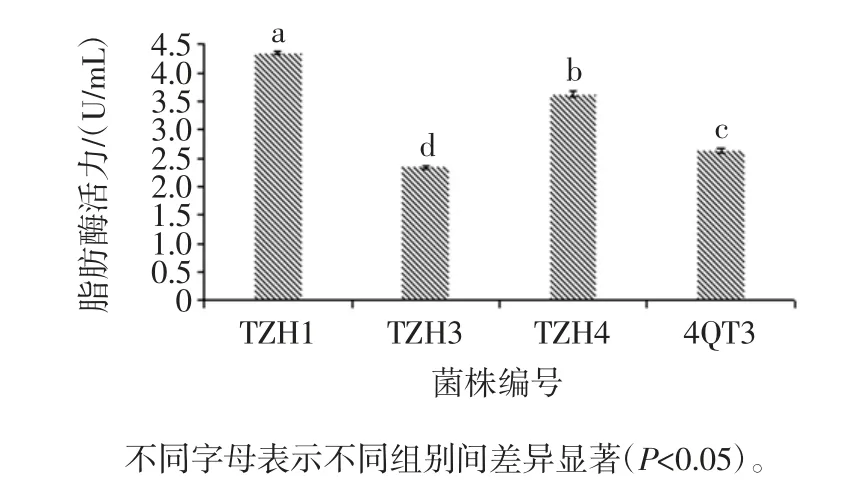
图1 菌株产脂肪酶活力Fig.1 Strains producing lipase activity
如图1所示,THZ1 的酶活力最高为(4.35±0.02)U/mL,其次 TZH4 的酶活力为(3.62±0.05)U/mL,4QT3 的酶活力为(2.63±0.04)U/mL,TZH3 的酶活力为(2.34±0.02)U/mL。菌株TZH1 的酶活力显著高于其他3 株菌(P<0.05)。
发酵肉制品在风味形成的过程中,脂类物质起着重要的作用,而脂肪酶能催化脂类物质的反应,有利于风味物质的形成。于华等[18]从四川腊肉中分离获得一株产脂肪酶能力较强的霉菌,在其最适产酶条件下脂肪酶活力可达384.05 U/100 mL。姚晓蕾[19]采用脂肪酶对猪肉进行酶解,发现其挥发性分为物质有明显的增加,包括硫化物、有机硫化物、芳香类化合物及含乙醇类物质等。因此菌株的脂肪酶活力越高,越能形成发酵肉制品中的优良风味。
2.2 菌株的生长曲线
4 株菌的生长活性曲线如图2所示。
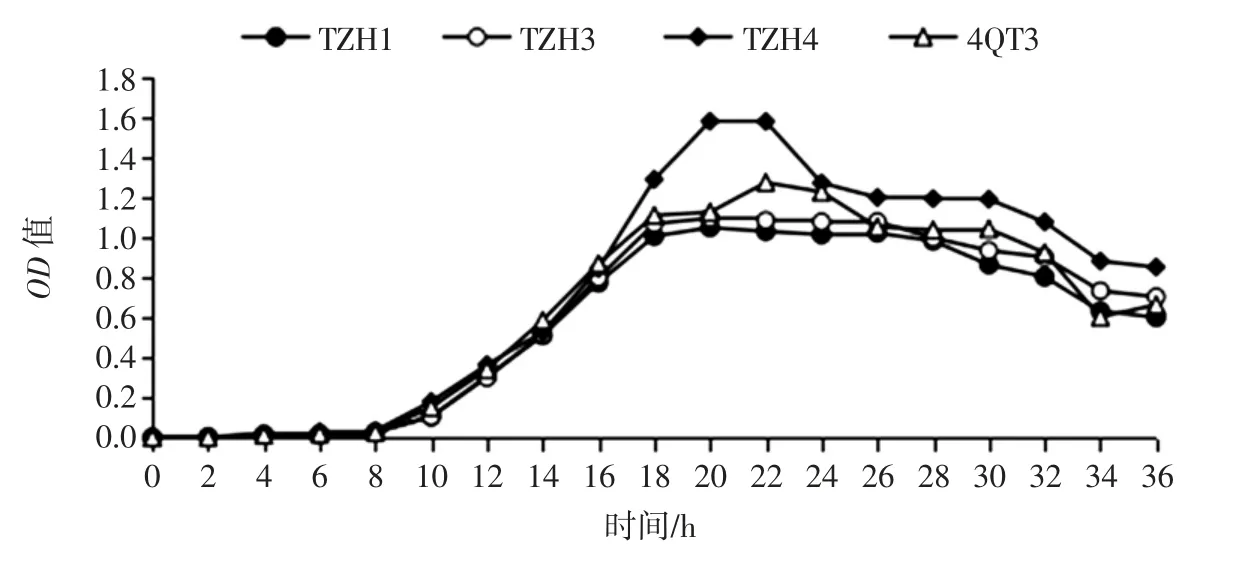
图2 株菌株的生长曲线Fig.2 Growth curves of 4 strains
4 株菌的生长趋势相似,其中0 h~8 h 为迟缓期,8 h~18 h 为对数期,18 h~26 h 为稳定期,26 h~36 h 为衰亡期。可以看出菌株TZH4 的生长活性较强,其余3株的生长活性相似。
2.3 产H2S和产生物胺测定试验
4 株菌株进行产H2S 和产生物胺测定试验结果如表1所示。
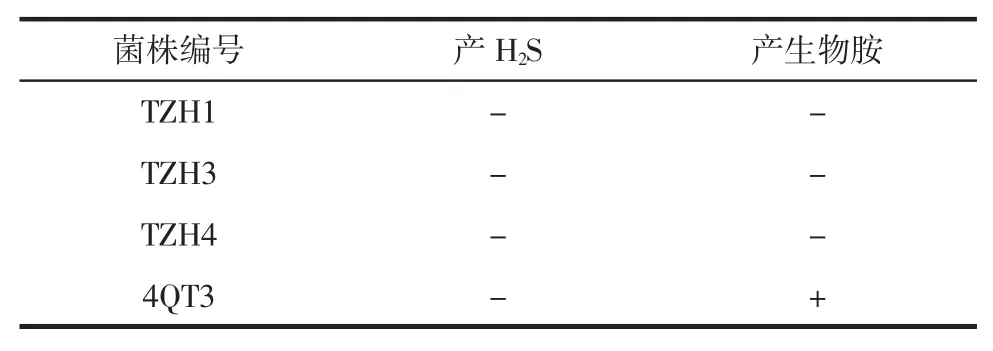
表1 菌株产H2S 产生物胺测定结果Table 1 Results of determination of amines produced by strains producing H2S
产 H2S 测定试验中,TZH1、TZH3、TZH4 和 4QT3的琼脂均无变黑现象,因此这4 株菌均不产生H2S。产H2S 测定试验中,4QT3 的培养基由黄色变为紫色,其余不变色,因此菌株4QT3 产生物胺,其余3 株菌不产生生物胺。
H2S 是一种有毒物质,不仅影响食品的口味,而且还对人体有害,它被称为是人体神经的毒剂,是窒息和刺激性较强的危害性气体[20]。H2S 能与肉品中的还原性血红蛋白作用生成紫红色硫化血红色蛋白,进一步氧化形成绿色[21]。生物胺普遍存在于各种发酵食品,在生物细胞中具有重要的生理功能,但当人体吸收过量的生物胺时,可能会引起头痛、心悸、血压变化等过敏性反应[22]。某些微生物则会在充足的生物胺前体物(氨基酸)、具有氨基酸脱羧酶活性以及适合的生长繁殖等条件下产生生物胺[23]。因此筛选用于发酵肉制品的菌株,不得产生H2S 和生物胺。
2.4 抑菌试验
4 株菌株进行抑菌试验的结果见表2所示。
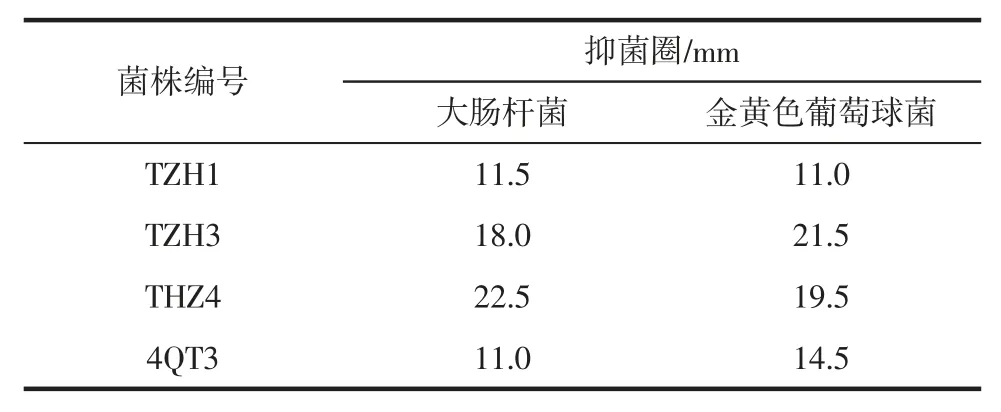
表2 菌株的抑菌能力Table 2 Antibacterial ability of the strain
如表2所示,TZH1、TZH3、TZH4 和 4QT3 对大肠杆菌的抑菌圈分别为 11.5、18.0、22.5、11.0 mm,TZH1、TZH3、TZH4 和4QT3 对金黄色葡萄球菌的抑菌圈分别为 11.0、21.5、19.5、14.5 mm。抑菌圈越大,说明抑菌能力越强。
由金黄色葡萄球菌和大肠杆菌O157:H7 等细菌性食物中毒引起的疾病在我国约占食品安全事件的30%~90%,也是世界范围内的主要公共卫生问题[24]。致病性大肠杆菌和金黄色葡萄球菌通常引起腹部痉挛、水性或血性腹泻、发烧、恶心和呕吐等中毒症状,常出现在畜禽肉、水产品、奶、蛋等食品中。可以看出,菌株TZH3 和TZH4 的抑菌能力较强,能更好地抑制有害微生物的生长。
2.5 耐盐性和耐亚硝酸盐性试验
4 株菌株进行耐盐性验和耐亚硝酸盐性试验的结果如图3所示。
如图3所示,耐盐性试验中,TZH1、TZH3、TZH4和 4QT3 的“对照组 OD 值/样品组 OD 值”比值分别为1.55、8.57、9.75、2.27。菌株 TZH3 的比值显著高于其他3 株菌(P<0.05),比值越大,说明耐盐性越强。耐亚硝酸盐性试验中,TZH1、TZH3、TZH4 和 4QT3 的“对照组OD 值/样品组 OD 值”比值分别为 1.26、2.61、3.58、1.17。菌株TZH3 的比值显著高于其他 3 株菌(P<0.05),比值越大,说明耐亚硝酸盐性越强。
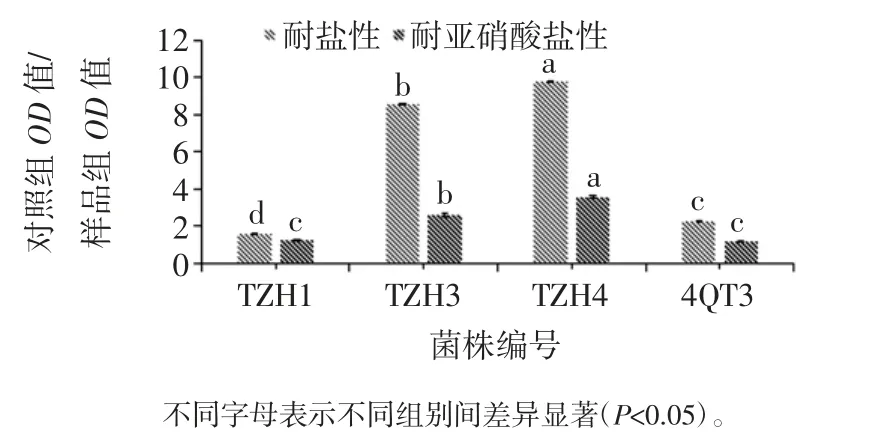
图3 菌株的耐盐性及耐亚硝酸盐性Fig.3 Salt tolerance and nitrite resistance of the strain
一般微生物细胞液的渗透压为0.85%NaCl 的等渗状态,微生物在等渗压的食盐溶液中代谢活动仍可正常进行,但当增加食盐时,食盐溶液的渗透压大于微生物细胞液的渗透压,当食盐的浓度达到13%以上时,可以完全抑制微生物的生长,包括乳酸菌以及大肠杆菌等[25]。当食盐及亚硝酸盐达到一定浓度时,会对微生物产生渗透胁迫及毒性作用,使微生物受到抑制甚至死亡[14]。而在发酵肉制品时,难免会用到NaCl 和NaNO2等腌制剂,因此所筛选出的菌株应当具有良好的耐盐性和耐亚硝酸盐性。可以看出,4 株菌中TZH3和TZH4 的耐盐性和耐亚硝酸盐性较好。
2.6 菌株的拮抗试验与复配试验
综合以上分析,最终选择TZH3 和TZH4 进行拮抗试验及复配试验。将菌株TZH3 和TZH4 在PDA 培养基上交叉划线培养后,发现均有菌落生长,并且在两株菌的交叉划线处均没有发现相互抑制的现象,说明菌株TZH3 和THZ4 不具有拮抗作用。
菌株THZ3 和 TZH4 复配试验的 OD 值和 pH 值如图4和图5所示。
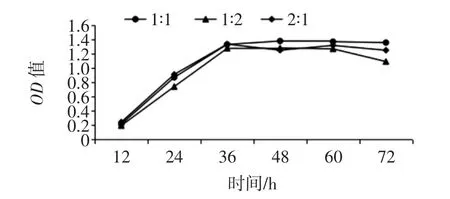
图4 复配生长情况比较Fig.4 Comparison of compound growth
由图4、图5可以看出当TZH3 和TZH4 的复配体积比为 1 ∶1 时,生长情况较优,且在 48 h 时 OD 值达到最大值。而pH 值变化不大,说明3 种复配比的产酸能力相似。因此可选择TZH3 和TZH4 的复配体积比为1 ∶1 来对羊肉制品进行发酵。
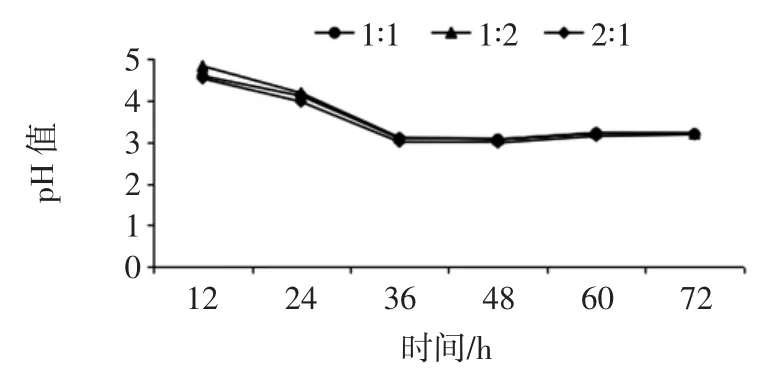
图5 复配pH 值比较Fig.5 Comparison of compound pH values
3 结论
本试验将4 株具有除膻效果的霉菌进行了功能性分析,包括微孢根霉(Rhizopus microsporus)TZH1、米根霉(Rhizopus oryzae)TZH3、米曲霉(Aspergillus oryzae)TZH4、多枝横梗霉4QT3。通过脂肪酶活力测定试验、生长曲线的测定、产H2S 和产生物胺测定试验、抑菌试验、耐盐性和耐亚硝酸盐性试验、拮抗试验与复配试验,验证菌株安全性。结果表明,菌株TZH3 和TZH4安全性较好,适用于羊肉制品发酵。
近年来,国内许多学者将细菌或霉菌制成混合发酵制剂,接种到羊肉制品中。在发酵过程中,微生物产生的脂肪酶与羊肉中的脂肪酸产生作用,蛋白酶与蛋白质产生作用,对羊肉的风味及质构起到改善作用,一定程度上降低了羊肉的膻味[3],为发酵制品提供特殊风味和色泽的同时又不会破坏羊肉的品质。现研究多采用直接购买的纯种菌株进行肉制品发酵,很少会筛选出具有特定功能性的菌株。菌株TZH3 和TZH4除了能够产生脂肪酶外,经试验验证还具有降解4-甲基辛酸和4-乙基辛酸的功能,可以制成发酵剂应用于养肉制品发酵,开发新型羊肉制品并改善羊肉风味,对扩大羊肉消费市场具有重要的实现意义。

