酒曲中酵母菌的分离鉴定及果酒发酵的初步研究
杜刚,陆小凯,詹梦涛,娄水珠,陈静,杨海英,
(1.云南民族大学民族药资源化学国家民族事务委员会-教育部重点实验室,云南 昆明 650500;2.云南民族大学化学与环境学院,云南 昆明 650500)
果酒是采用新鲜的果实或果汁作为原材料,通过捣碎、发酵、压榨以及浸泡等方式酿制而成的饮料酒[1]。因果酒中含有大量的糖、多酚、有机酸、酯类、多种维生素及人类所需的氨基酸等物质,营养丰富,适量饮用有益身心健康[2-3]。近年来酒类消费倡导以果酒取代粮食酒,各种果酒的研究引起了广泛关注[4-7]。果酒酿造中分离和筛选出适合果酒发酵的菌株是决定果酒质量及风味的关键因素,要保证高效生产并且提高生产效率,就要筛选出优良的生产菌种进行纯种发酵[8-11]。
酵母菌是果酒生产中的主要微生物,酿酒酵母普遍应用于酿制白酒、红酒、啤酒和果汁饮料的生产,其生物合成过程中会形成多种多样的代谢产物,从而对食品风味产生重要影响[12-14]。本试验从市售酒曲样品中分离出酵母菌,通过26S rDNA 序列分析进行了菌种鉴定,经过感官评价初筛获得性能较优的酵母,采用顶空固相微萃取-气质联用技术(solid phase microextraction -gas chromatography/mass spectrometry ,SPME-GC/MS)方法[15-17]对筛选出的酵母菌株在猕猴桃汁培养基中的产香进行研究,为筛选用于果酒生产的酵母菌株提供依据。
1 材料与方法
1.1 材料
1.1.1 样品采集
试验所用酒曲为市售酒曲,样品1:广西都安县传统白酒酒曲;样品2:广西河池壮家米香型酒曲;样品3:浙江金华酱香酒曲;样品4:福建古田红曲;样品5:贵州铜仁玉屏烧酒曲;样品6:湖北黄石清香型酒曲。
1.1.2 培养基配制方法
酵母浸出粉胨葡萄糖琼脂(yeast extract peptone dextrose,YPD)固体培养基(1L):葡萄糖 20 g,蛋白胨20 g,琼脂 20 g,酵母膏 10 g,蒸馏水 1 000 mL,pH 自然,121 ℃灭菌20 min,冷却备用。
YPD 液体培养基(1 L):葡萄糖 20 g,蛋白胨 20 g,酵母膏 10 g,蒸馏水 1 000 mL,pH 自然,121 ℃灭菌20 min,冷却备用。
马铃薯葡萄糖琼脂固体培养基(potato dextrose agar,PDA)(1 L):葡萄糖 20 g,马铃薯 200 g,琼脂 20 g,蒸馏水1 000 mL,分装锥形瓶,121 ℃灭菌20 min,冷却备用。
1.2 仪器与设备
SW-CJ-2PD 洁净操作台:苏净安泰空气技术有限公司;ZHWT-2012 恒温摇床:上海智城分析仪器制造有限公司;LRH-250-G 恒温干燥培养箱:广东省医疗器械厂;YXQ-LS-100SII 立式压力蒸汽灭菌器锅:上海博迅实业有限公司;THERMOFISHER(ISQ)气相色谱/质谱联用仪、TR-5MS(30m×0.25mm×0.25μm)毛细管色谱柱:美国赛默飞世尔科技(中国)有限公司;手动固相微萃取装置、100μm 聚二甲基硅氧烷(polydimethylsiloxcane,PDMS)固相微萃取头:安捷伦科技有限公司;恒温加热磁力搅拌器:德国IKA公司;Scout SE 电子天平:奥豪斯仪器(常州)有限公司。
1.3 方法
1.3.1 酵母菌的分离纯化
取1 g 酒曲样品,放入装有100 mL 无菌蒸馏水的锥形瓶中,恒温摇床振荡10 min 将样品充分打散、混匀,用双层的无菌纱布过滤,样品稀释至10-2~10-7。分别将上述6 个浓度的稀释液用移液枪移取0.2 mL 于不同的PDA 固体培养基上,每个梯度做3 个平行并分别做好标记。静置1 min 于28 ℃恒温培养箱倒置培养48 h 后观察并记录。挑取具有典型酵母菌形态特征的菌落,镜检为纯种后,进行划线分离,直至得到单菌落。挑取单菌落转接到YPD 斜面上,标明日期及编号放于28 ℃恒温培养箱培养,待其长出来后装入密封袋置于4 ℃冰箱保藏。
1.3.2 酵母菌的鉴定
1.3.2.1 菌种的形态特征观察
挑取少量菌种于PDA 平板上划线纯化,28 ℃培养2 d,选取单个菌落制成装片用光学显微镜高倍下观察其大小、干湿、隆起、颜色、边缘情况、表面光泽、菌落质地等细胞形态。
1.3.2.2 聚合酶链式反应(polymerase chain reaction,PCR)扩增和 DNA 测序
斜面菌种活化后,酵母菌接种于150 mL YPD 液体培养基,27 ℃培养 3 d~4 d,培养物 13 000 r/min 离心6 min,收集菌体,液氮冻融-十六烷基三甲基溴化铵(cetyl trimethyl ammonium bromide,CTAB)提取 DNA。26S rDNA D2 PCR扩增引物NL1:5′ -GCATATCAATAAGCG GAGGAAAAG -3′ 和 NL4:5′ -GGTC CGTGTTTCAAG-3′。PCR 反应体系为:Taq MIX 25 μL,Bestaq MasterMix/with dye(25 μL),引物各 2.5 μL,模板5 μL,加无酶水补足 50 μL。程序为:95 ℃预热 3 min,95 ℃变性 10 s,55 ℃退火 30 s,72 ℃延伸 30 s,72 ℃终延伸 5 min,30 个循环后 72 ℃末端延伸 10 min,4 ℃保存。PCR 产物以琼脂糖电泳检测,测序由昆明硕擎生物科技有限公司完成。
1.3.2.3 26S rDNA 基因序列测定及系统发育树分析
酵母菌分析所得DNA 序列用DNAMAN 生物软件进行拼接,用MEGA6.0 进行酵母序列的同源性比对(Alignment)和利用邻接(neighbour-joining,NJ)法系统发育树构建[18]。
1.3.3 酵母菌的筛选
将“1.3.1”分离得到的菌株分别接种到YPD 培养基中,28 ℃培养 3 d~5 d 以后,通过感官分析[19]筛选出具有果香和略带花香气味的菌株,将初筛获得的酵母菌接种到猕猴桃汁液体培养基中,28 ℃培养3 d~5 d,再通过感官分析筛选出具有比较浓郁的酒香味或独特果香味的菌株。
1.3.4 酵母菌的发酵产香研究
猕猴桃干果与水按1 ∶9 的质量比混合,浸泡30 min,搅拌机打碎得到猕猴桃汁培养基。将1.3.3 筛选得到的酵母菌接种到猕猴桃汁培养基中活化24 h后,以5.0%接种量接种于装有200 mL 猕猴桃汁的三角瓶中,发酵温度为28 ℃,发酵时间10 d。发酵液过滤后得到猕猴桃汁发酵样品。
1.3.5 挥发性成分分析
1.3.5.1 挥发性成分的提取
利用手动顶空固相微萃取(solid-phase microextraction,SPME)法对猕猴桃汁发酵样品中挥发性物质进行富集,取发酵样品5 mL 于样品瓶中,加入0.5 g NaCl,将老化好的萃取头插入到样品瓶顶空部分,在45 ℃的恒温磁力搅拌器上,转速为180 r/min 条件下萃取 30 min,GC 进样口(温度 240 ℃)解吸附 1 min,用于气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)分析。
1.3.5.2 气相色谱质谱工作条件
色谱条件为TR-5MS 毛细管柱(30 m×0.25 mm×0.25 μm);进样口温度 240 ℃;载气为氦气;柱流量为1 mL/min;进样模式:分流模式(分流比为 10 ∶1)。
程序升温:起始温度为 30 ℃,保持 2 min,以5 ℃/min 的速率升至 80 ℃保持 1 min,以 10 ℃/min 的速率升温至100 ℃保持1 min,以20 ℃/min 的速率升温至230 ℃保持1 min。
质谱条件:EI 离子源,电子能量为70 eV,倍增器电压1 600 V。质谱扫描范围为10 a.m.u ~500 a.m.u,扫描方式:全扫描,扫描速度:0.2 scan/s。离子源温度:255 ℃,传输线温度:265 ℃。
各组分通过Nist11 谱库检索进行定性分析,运用面积百分比法计算相对百分含量。
2 结果与分析
2.1 酵母菌的分离和初筛结果
从6 种酒曲中共分离出10 株酵母菌,其中从样品1 分离出2 株,编号CK01、CK02;从样品2 分离出2株,编号CK03、CK04;从样品3 分离出1 株,编号CK05;从样品 4 分离出 2 株,编号 CK06、CK07;从样品5 分离出 1 株,编号 CK08;从样品 6 分离出 2 株,编号CK09、CK10。
通过感官分析初步筛选出酒香型酵母菌2 株(CK03、CK10),浓香型酵母菌5株(CK01、CK02、CK04、CK05、CK07),清香型酵母菌 3 株(CK06、CK08、CK09)。
2.2 酵母菌株的形态鉴定结果
对分离得到的10 株菌株在显微镜下进行形态特征观察,观察结果见表1。
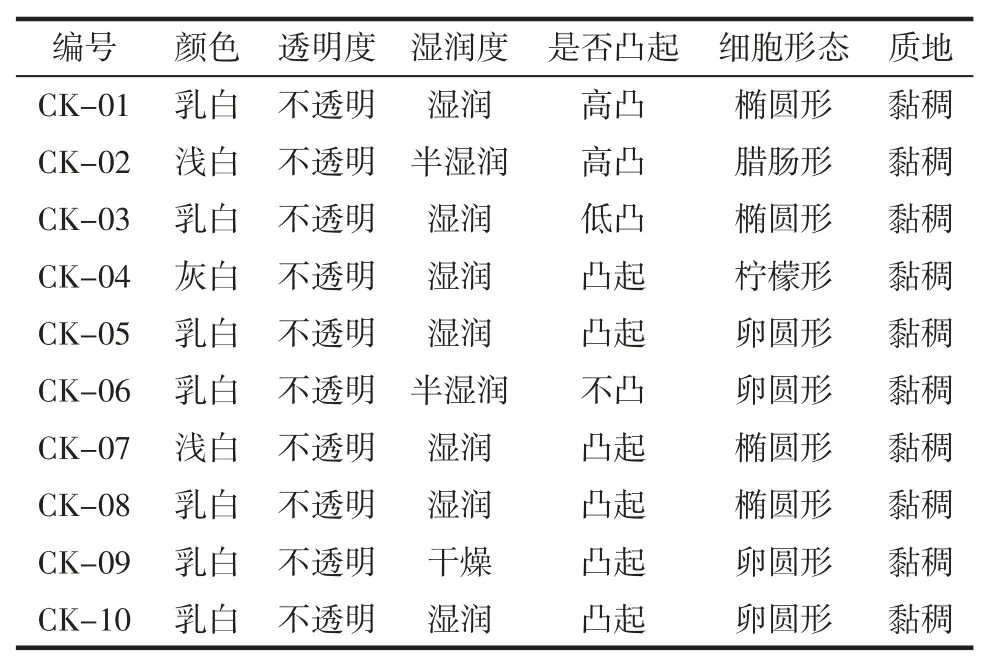
表1 酵母菌菌落形态观察结果Table 1 The table of yeasts colony morphology
2.3 菌株的分子鉴定
2.3.1 酵母菌株的PCR 结果
10 株酵母菌株PCR 扩增产物片段大小在500 bp~750 bp 之间,如图1所示。
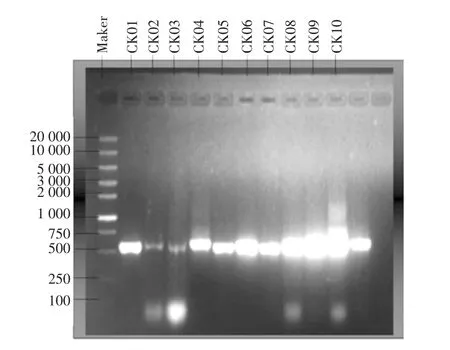
图1 10 株酵母菌株PCR 扩增的结果Fig.1 The PCR results of yeasts
2.3.2 酵母ITS 序列相似性Blast 查询结果
酵母ITS 序列相似性Blast 查询结果见表2。
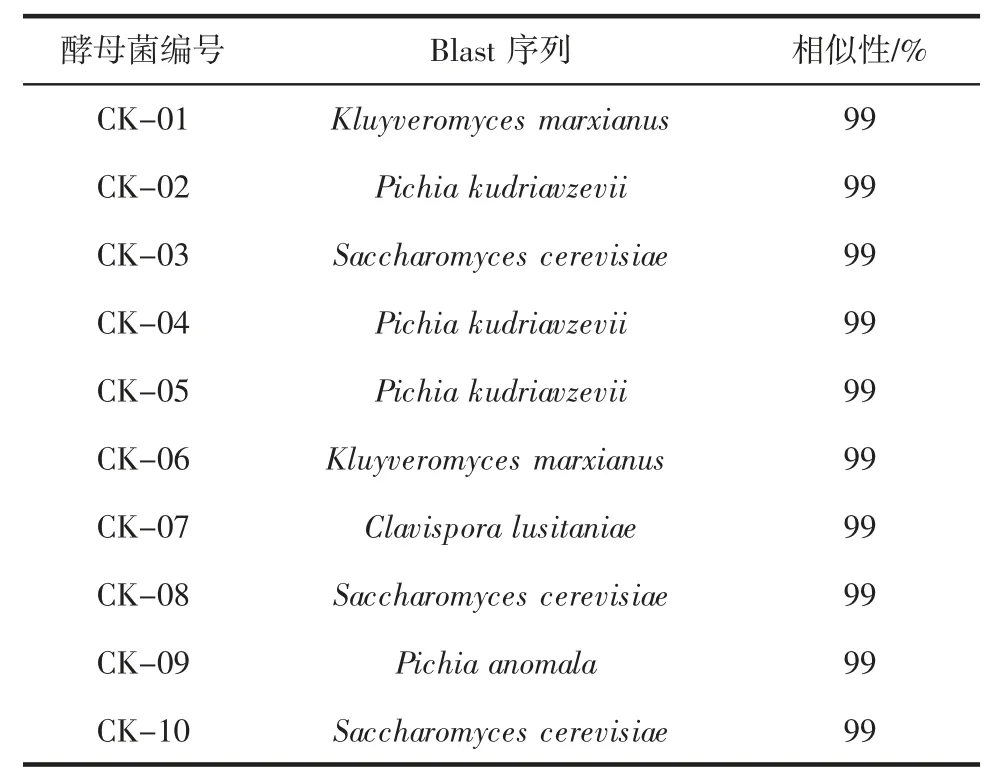
表2 酵母ITS 序列相似性Blast 查询结果Table 2 ITS sequence of yeasts similarity Blast query results
2.3.3 酵母菌菌株系统进化树
测序结果用Blast 在GenBank 中进行同源性比对,选取模式菌株以领域连接法构建系统发育树,见图2。
由图2可知,所测10 株酵母菌中有3 株酵母菌均同为 Pichia kudriavzevii,3 株酵母菌为 Saccharomyces cerevisiae,1 株酵母菌为 Pichia anomala,2 株酵母菌为Kluyveromyces marxianus,1株酵母菌为Clavispora lusitaniae。
2.4 猕猴桃汁发酵样品挥发性成分分析
通过“1.3.3”试验筛选出的酵母菌CK-03 用于发酵产香研究,对发酵样品采用GC-MS 分析,总离子流图见图3。
经过Nist11 谱库检索得到挥发性化合物的种类,计算相对含量结果见表3。
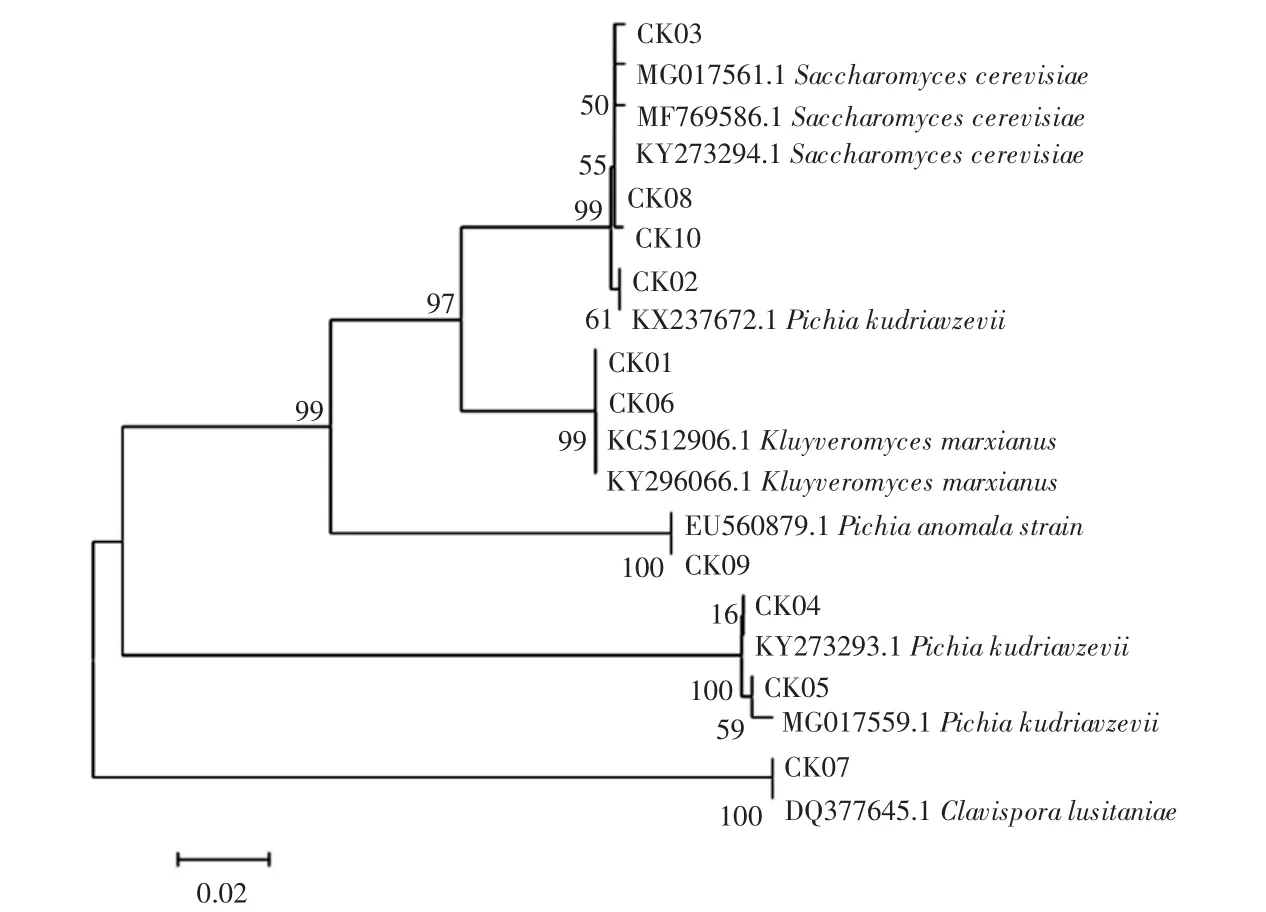
图2 酵母菌菌株基于26S rDNA 的系统进化树Fig.2 Phylogenetic tree of yeast strains based on 26S rDNA analyses
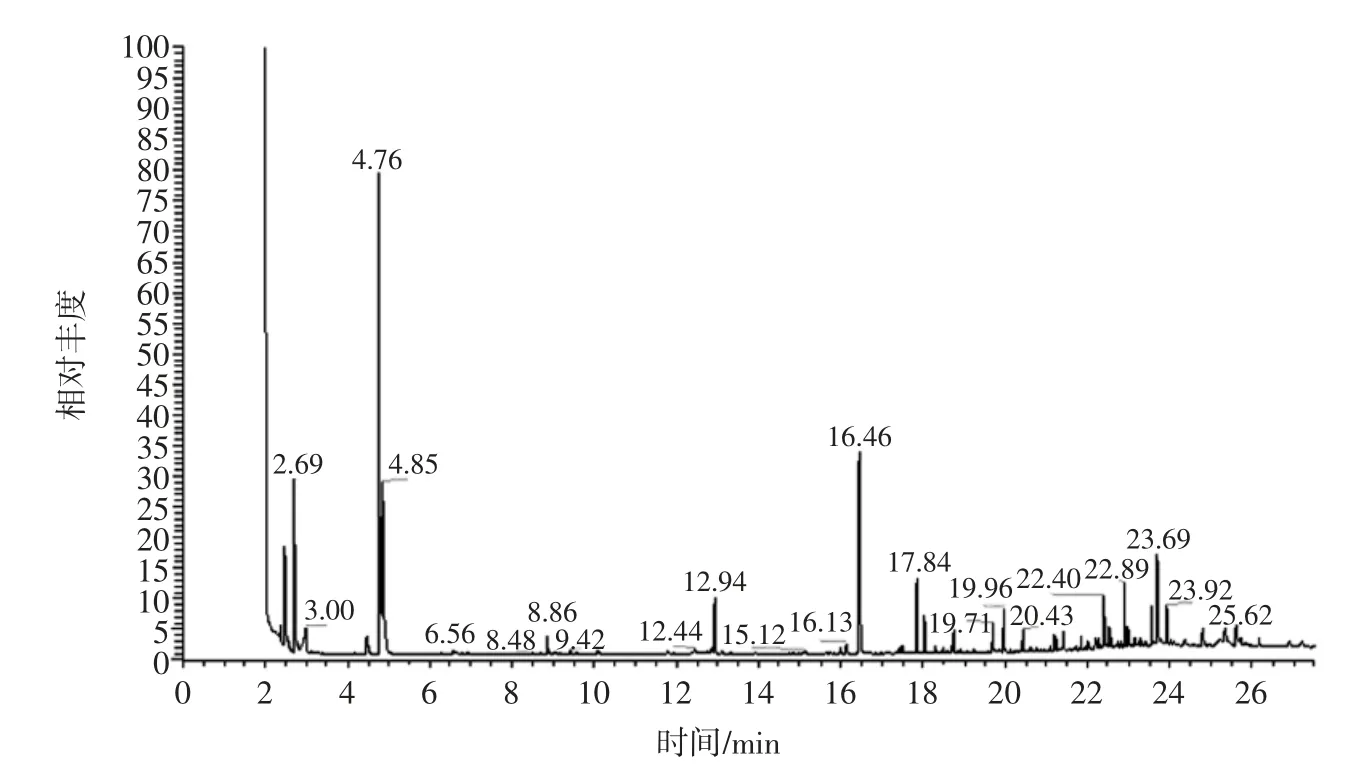
图3 酵母CK-03 发酵样品挥发性成分的GC-MS 总离子流图Fig.3 Total ion chromatograms of volatile components with yeast strains CK-03 fermentation
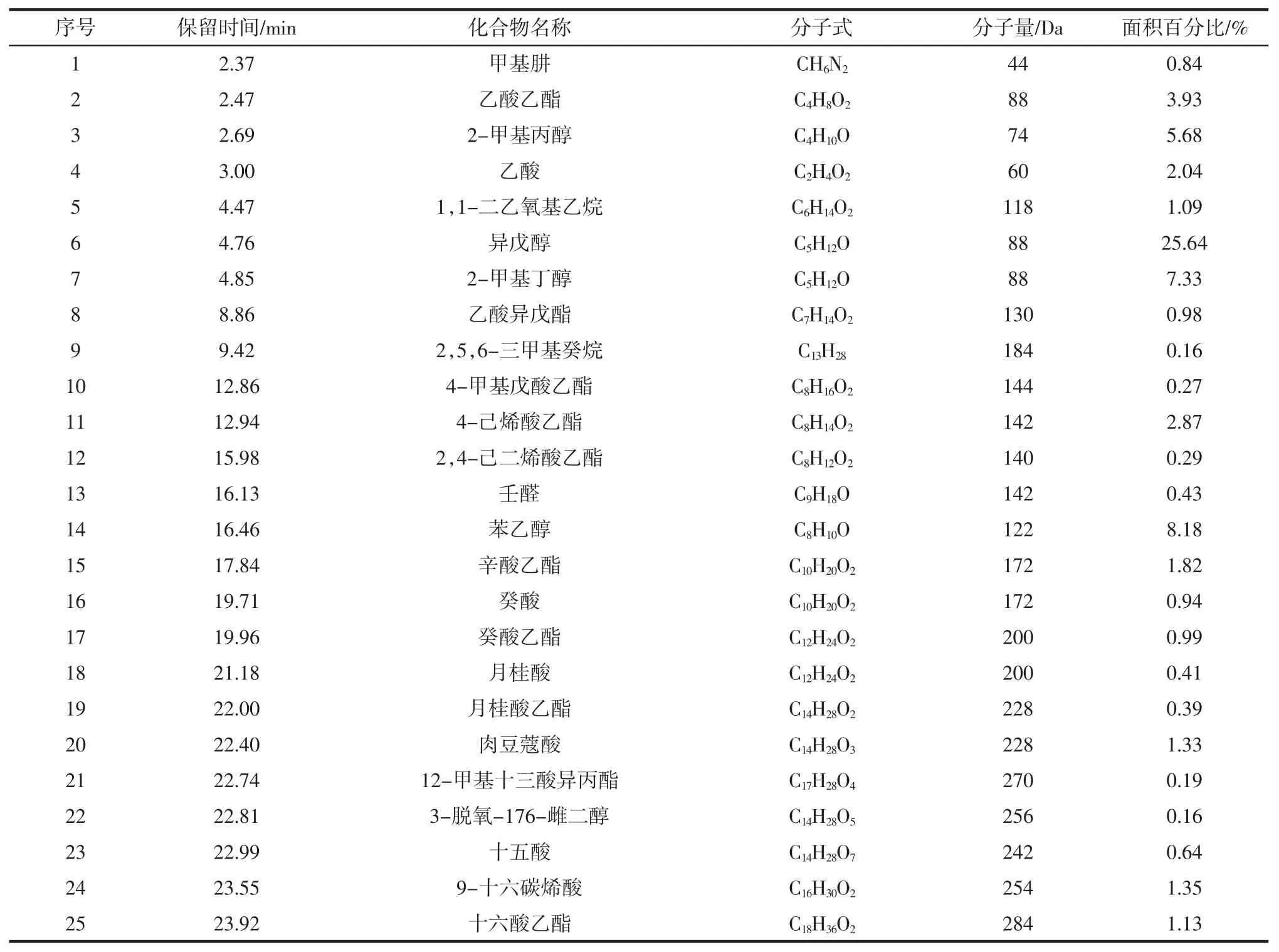
表3 酵母CK-03 发酵样品的主要挥发性成分Table 3 Volatile components with yeast strains CK-03 fermentation
样品共检出25 种挥发性成分,其中酯类10 种,醇类 4 种,酸类6 种、醛类 1 种、烷烃2 种。醇类物质和酯类物质是构成发酵样品香气的主要成分,醇类组分含量较高,其中异戊醇、苯乙醇、2-甲基丁醇的相对含量分别为25.64%、8.18%、7.33%。异戊醇具有酒香和果香的味道,苯乙醇具有呈香、呈味作用[20]。酯类物质种类最多,其中乙酸乙酯、4-己烯酸乙酯、辛酸乙酯含量较高,分别为3.93%、2.87%、1.82%,其他酯类还有乙酸异戊酯、癸酸乙酯、月桂酸乙酯等,辛酸乙酯具有白兰地酒香气,癸酸乙酯具有果香和花香的香气[21],这些酯类产生的香气相互综合,赋予发酵样品浓郁的酯香。此外,在发酵样品中还检测到6 种酸类、1 种醛类和2 种烷烃。这些物质含量底,可能对发酵样品香气的直接贡献不大,但对发酵样品复杂的香气做出了贡献。
3 结论
本试验从种市售酒曲样品中分离出10 株酵母菌,经过形态鉴定和系统发育树分析,确定酵母菌CK-02、CK-04、CK-05 为 Pichia kudriavzevii,酵母菌 CK-03、CK-08、CK-10 为 Saccharomyces cerevisiae,酵母菌CK-09 为 Pichia anomala,酵母菌 CK-01、CK-06 为Kluyveromyces marxianus,酵母菌CK-07 为Clavispora lusitaniae,表明不同酒曲的酵母菌株有较大差异。将粗筛后的酵母CK-03 发酵猕猴桃汁,经GC-MS 测定分析,发酵样品中含有多种挥发性成分,主要成分是醇类物质和酯类物质。CK-03 酵母菌的发酵工艺特性还有待进一步研究。

