动物胶原及其水解产物的研究进展与应用
梅娜娜,周广运,王东亮*
1. 国家胶类中药工程技术研究中心(东阿 252201);2. 东阿阿胶股份有限公司(东阿 252201)
胶原是在机体种类众多的蛋白质中一类重要的蛋白质,也是动物体内含量最多、分布最广的蛋白质。人体成分有16%左右为蛋白质,其中30%~40%属于胶原蛋白[1]。胶原通常以三螺旋的结构状态存在于机体组织(皮、骨骼、软骨和肌腱等)中。其氨基酸组成主要是甘氨酸、脯氨酸和羟脯氨酸。其中羟脯氨酸是胶原的特征氨基酸。胶原作为一类天然大分子,因加热或者酶解等外界条件会导致其不同程度的水解,产生不同类型的胶原水解产物,主要包括明胶及胶原蛋白。随着科学技术的发展,胶原及其水解产物在生物医学、食品工业及皮革等领域方面的应用也越来越广泛[2]。
1 胶原在各组织中的分布
胶原在不同的器官组织有不同的分布,并且长度也随着种类的不同而不同。如表1所示。在Ⅰ、Ⅱ和Ⅲ型胶原中,每一多肽链长300 nm,由1 000个氨基酸组成。在Ⅵ和Ⅹ型胶原蛋白中其三螺旋区域分别由200个和460个氨基酸组成。在皮肤胶原中,胶原分子通过细胞外赖氨酰氧化酶形成的溶血素残基之间的链间交联而并排堆叠在一起[3]。胶原蛋白赋予结缔组织的强度、刚性和柔韧性,并对于动物的成长与健康必不可少。
另外,胶原的品质与不同动物来源的原料也有密切的关系。不同动物主要包括陆源性畜禽(猪、牛、驴等)的皮骨、淡水鱼鱼皮鱼鳞及深海鱼皮骨。从不同动物来源的胶原所含有的特征性羟脯氨酸含量看,陆源性畜禽>淡水鱼皮鱼鳞>深海鱼皮。从市场角度看来自畜禽皮骨(一般是畜禽加工副产物)、淡水鱼鱼皮鱼鳞的胶原相关产品性价比明显高于深海鱼皮来源的产品[4]。

表1 胶原类型及其在动物组织中的分布[5-6]

接表1
2 动物胶原的结构
虽然不同种类动物的胶原的结构和组成不同,但经长期研究发现胶原结构有着共性规律。
2.1 一级结构——氨基酸组成
胶原占动物总蛋白的1/3,是一类含量丰富蛋白质[7]。其化学结构独特,三肽结构中重复性地含有丰富的甘氨酸、脯氨酸及羟脯氨酸(甘氨酸-脯氨酸-Y和甘氨酸-X-羟脯氨酸,其中X、Y可以是任何氨基酸)。1 mol胶原分子中包含了1/3甘氨酸,0.7/3脯氨酸和羟脯氨酸,和1.3/3其他氨基酸,见表2。甘氨酸、脯氨酸和羟脯氨酸占总组成胶原氨基酸的57%[6]。
不同氨基酸在胶原的结构中可起到不同的作用。不同氨基酸4-羟脯氨酸的含量影响分子内氢键的形成,对分子三螺旋结构型的稳定十分重要。另外,特殊的羟赖氨酸部分会继续进行糖基化修饰[5]。
2.2 二级结构
其中每个α链中氨基酸排列组成可能相同,也可能不同。每条α链可以命名为αn(N)p,n表示α链不同种类,N表示胶原类型,p表示多肽数量。如,α1(Ⅰ)2α2(Ⅰ)表示Ⅰ型胶原中含有两条α1链和一条α2链。C末端前肽参与启动三螺旋结构的形成,N末端前肽则与形成胶原纤维对的直径大小有关[6]。

表2 I~VII型胶原蛋白中氨基酸和糖的组成(残基/1 000个氨基酸残基)[6]
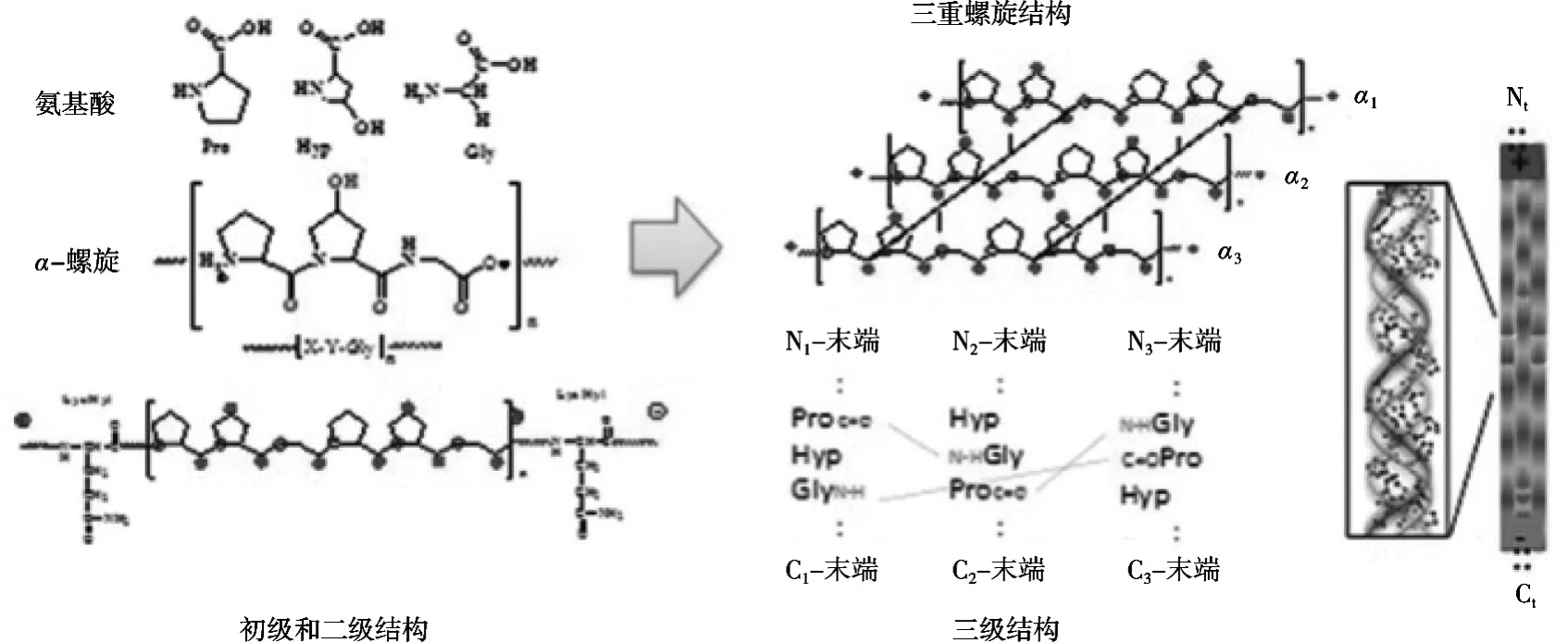
图1 胶原蛋白的初级、二级、三级结构及三重螺旋结构示意图[8]
2.3 三四级结构
胶原分子中三条α多肽链以右手螺旋的方式拧成三螺旋结构。具体来说,胶原由平行线型链组成,而每一线型是由三条左旋的α多肽链通过链与链间的相互作用紧密结合而形成的右旋的三重螺旋结构。在胶原分子中除了含有三螺旋结构域,还含有非螺旋结构域。蛋白质的三级结构主要是肽链之间的次级键的作用,即氨基酸残基侧链的极性基团产生的离子键、氢键和范德华力以及非极性基团产生的疏水键、范德华力等作用,除了蛋白质分子这些次级键外,胶原分子内和分子间还有3种交联:醇醛缩合交联、醛胺缩合交联、醛醇组氨酸交联。
胶原分子之间可自发通过共价键搭建交联,形成高度有序的分子更大高级结构(四级结构)的蛋白质,聚集成束成胶原纤维。胶原分子通过分子内或分子间的作用力形成不溶性纤维,故胶原是不溶性硬蛋白。
3 胶原水解产物-明胶和胶原蛋白
胶原是动物组织器官中存在的一类天然蛋白质,且有完整的三螺旋结构,保留有生物活性。主要分布在结缔组织、皮肤、肌肉、骨骼、牙齿、内脏、韧带、巩膜与眼睛等组织器官中。不溶于冷水和热水。
明胶是胶原在酸、碱、酶或者高温作用下的变性产物。分子量分布较宽,工业上生产的明胶分子量为15 000~25 000 Da。明胶不溶于冷水,在冷水中只会吸水并溶胀,加热至60 ℃以上,可溶于水。明胶的水溶液冷却后,成为凝胶,凝胶具有网状结构。
胶原蛋白中三螺旋结构彻底松开,且降解成多分散的肽段,还可能包括低聚肽,分子量从几千万到几万道尔顿,分子量分布很宽,能溶于冷水,且能被蛋白酶利用。并且根据食品安全国家标准GB 31645—2018规定富含胶原蛋白的新鲜动物组织在水解到一定程度后,分子量在10 000 Da以下时,被称为胶原蛋白肽。
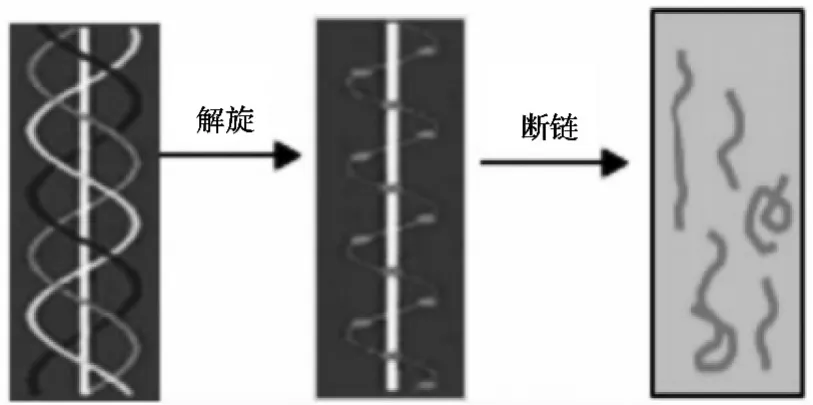
图2 胶原-胶原蛋白肽结构变化过程[4]
4 不同分子量胶原的功能及应用
4.1 三螺旋结构完成的胶原的功能与应用
胶原在动物细胞中扮演着黏结功能的角色,广泛存在与动物细胞外,是细胞外基质最重要的组成成分,也是动物结缔组织中最主要的一种结构性蛋白质。参与组织的形成、成熟、细胞间信息的传递,与细胞的增殖、分化、免疫,动物运动、关节润滑,肿瘤转移、伤口愈合、血液凝固等关系密切,也与结缔组织胶原疾病的发生发展有密切关系。胶原具有含量丰富、生物相容性强、高孔隙率、易加工、亲水性、低抗原性及体内吸收性等特性[9-11]。
医用。胶原在医学领域存在广泛应用,包括缝合线、止血剂、组织替代和再生(骨、软骨、皮肤、血管、气管、食道等)、整容手术(嘴唇、皮肤)、牙科复合材料、皮肤再生模板、膜氧合器、避孕药(屏障法)、可生物降解的基质、神经保护性包裹物、植入物、角膜绷带、隐形眼镜、给药等[12-13]。其是生物医学应用中使用最广泛的生物材料之一[14]。胶原可通过其官能团的反应改性,引入交联或生物分子,产生具有机械或生物特性的材料[11,15]。但使用胶原的主要缺点是制作成本费用高(时间高消耗和提取纯化步骤的复杂性)及为避免变性和体外溶胀需采用独特的加工条件[16-17]。胶原与人体衰老和疾病有密切的关系,这主要与胶原侧链胺基团(Lys,Arg)和还原糖糖化之间的非酶化学反应对基质结构产生变化有关[18]。法医利用骨骼中胶原蛋白含量与非胶原蛋白含量的比值降低的幅度来判断未知骨骼遗骸的死后间隔[19]。
选SPSS21.0软件对数据做出分析,(± s)表示神经功能缺损情况,实施t检验,(%)表示不良反应、疗效,实施χ2检验,当P<0.05表示差异具有统计学意义。
食用。因胶原中含有人体必需和非必需氨基酸共18种。同时甘氨酸、脯氨酸和羟脯氨酸的含量较高。故胶原蛋白是一种高营养价值的食品。胶原作为人体皮肤真皮的重要组成成分,可与弹性蛋白一同形成网状结构,从而使皮肤保持一定的硬度与弹性。胶原蛋白中所含有的大量的甘氨酸具有镇静的作用,可以用于神经衰弱和焦虑症的治疗。有文献表明胶原可以缓解胃溃疡患者的疼痛感。则胶原在保健食品行业有较好的应用。另胶原在食品添加剂、食品品质改良和食品包装材料等方面也有广泛的应用。张义[20]通过添加烟熏液、核黄素和单宁,发现三者均可较好地改善胶原蛋白膜的机械性能和阻隔性能,可用于不同目的下可食蛋白膜的强化,使胶原在包装、保鲜及功能性应用方面具有较广的应用价值。曾多[21]以湿度为熟化过程的控制条件,初步筛选出有效湿度范围,为60%≤RH<80%。并进一步对湿度、温度和时间的工艺参数进行优化,湿度优化分三个阶段,温度优化简化工艺流程,第一第二阶段合并,降低前两个阶段的熟化时间,为48 h。结果确定第一、第二、第三阶段的最佳湿度分别为60%,70%和75%。第一、第二和第三阶段的最佳熟化温度分别为65,65和75 ℃。最佳熟化时间:第一第二阶段合并的时间为48 h,第三阶段时间为2~6 h。最后采用DSC和ATR FTIR探索肠衣的保水机制,结果表明不同熟化条件下水分子与胶原的结合能力不同,加湿熟化可促进或改变水分子与胶原的结合,从而增强胶原的保水能力。
饲用。为将制革得到的残次皮料、皮边角料等副产物充分利用起来,有研究者采用物理、化学或者生物技术的方法处理得到饲料用的胶原蛋白粉。魏红芳等[22]按照《饲料分析及饲料质量检测技术》分别测定胶原蛋白粉和豆粕中水分、粗蛋白、粗灰分及粗脂肪含量,用H 835-50氨基酸分析仪测定两者17种氨基酸的含量。结果表明胶原蛋白粉中粗蛋白和钙的含量高于豆粕,粗脂肪和磷的含量低于豆粕。胶原蛋白粉总氨基酸含量为69.35%,高于豆粕中总氨基酸含量(41.91%)。谷氨酸、精氨酸等均高于豆粕,其中甘氨酸的含量为豆粕的11.27倍,脯氨酸是豆粕的4.54倍。说明胶原蛋白粉可以部分代替豆粕在畜禽饲料中的推广。
4.2 明胶的功能及应用
明胶是胶原经热变性或者物理、化学方法降解而得,部分保留了胶原的三螺旋结构,具有良好的成膜性、凝胶性、生物可降解性、生物相容性等优点。在食品、医药等行业应用广泛。
翁武银等[23]以罗非鱼皮为原料来提取明胶制备可食用膜,并考察脱水处理对其理化性质的影响。结果表明所制备的可食膜其拉伸强度(TS)达37.5 MPa。温度达到100或120 ℃后,明胶的TS逐渐降低,疏水作用和共价键作用在明胶膜中的贡献增强,从而膜的玻璃转化温度得到提高。可以证明脱水和热处理可改善鱼皮明胶膜的机械性能、耐水性能和稳定性能。蓝广芊[24]采用正交试验和单因素试验,确定添加氯化钙、甘油、单宁酸的添加量,制得壳聚糖/明胶复合止血材料。确定最佳制备条件为壳聚糖质量分数7%,明胶质量分数8.5%,氯化钙质量分数1.5%,甘油质量分数7%,单宁酸质量分数0.05%。止血效果是医用明胶海绵和纯壳聚糖海绵的3~4倍。另外,明胶可用作胶囊剂囊材,作为基质,可应用于凝胶剂;作为载体可应用于基因、疫苗等药物的递药系统等。在应用过程中又因明胶中有亚氨基、醛基等活性基团的存在,其在储存过程中易发生交联,故研究者通常将明胶进行改性,增强其凝胶强度、机械性能等特性。米田裕治等[25]以无水琥珀酸进行明胶改性,制备琥珀酰明胶,用此改性明胶代替明胶制备软胶囊,胶囊内容物为琥珀酰明胶不溶物和含有亲水基的化合物(如苯酚衍生物),制备了一种有易溶性,且不易造成崩解延迟的软胶囊剂。
4.3 小分子胶原蛋白的功能及应用
胶原蛋白多肽是经胶原或者明胶经水解处理后制得的一系列具有功能性且分子量在2 000~30 000 Da的小分子多肽。此类小分子胶原蛋白多肽比胶原和明胶具有不同的特性。如不具有明胶的凝胶性能,具有易吸收性,更强的抗氧化性、抑菌性、抗血压等特性。
易透皮性。陶宇[26]通过研究沙海蜇胶原蛋白肽体外透皮吸收研究发现,分子量越小的胶原蛋白多肽表现出越好的透皮吸收性能。且通过累计透皮吸收量和时间的曲线得到沙海蜇胶原蛋白肽体外透皮吸收的零级动力学方程,Mr<2 500,Q=209.29t-6.801;2 500<Mr<8 000,Q=84.381t+133.75;Mr>8 000,Q=52.597t+72.96。样品浓度越高并在pH 8左右时,胶原蛋白肽表现出较好的体外透皮吸收性能。
抗氧化性。胶原或明胶水解后所得的多肽结构抗氧化性增强,不同来源的胶原均可制备具有抗氧化性的胶原蛋白多肽。见表3。王静等[27]通过测定蛋白酶酶解液中不同分子量的海参多肽的抗氧化活性,发现四种不同分子量肽SPH I(>10 kDa)、S PH Ⅱ(5~10 kDa)、SPH Ⅲ(3~5 kDa)、SPH Ⅳ(<3 kDa)的活性氧的清除能力大小依次增强。证明多肽分子量越小抗氧化能力越强。王杉杉[28]通过超滤、凝胶过滤层析等方法分离出牦牛皮胶原蛋白抗氧化活性肽I-D7。并测定此肽的氨基酸序列为Phe-Leu-Pro-Gln-Pro-Pro-Gln-Glu,活性肽的分子量为954.5。
抗菌性。Gomez-guillen等[29]分别用鱿鱼胶原和金枪鱼皮胶原降解制备分子量小于1 kDa和1~10 kDa的多肽,通过琼脂扩散法研究多肽对常见细菌的抗菌能力,结果表明上述两种多肽对革兰氏阴性和阳性细菌及乳酸菌等都有明显的抗菌性能。
降高血压。高血压病在人体疾病中的发病概率逐年增加,主要是高血压会损伤血管,身体重要器官发生缺血和功能受损,其中血管紧张素转化酶(ACE)通过将无活性的血管紧张素Ⅰ转化成使血管收缩的血管紧张素Ⅱ,就此引发高血压疾病。有些研究者已经通过将动物胶原水解成功能性小分子多肽,利用小分子胶原蛋白多肽抑制ACE的活性,从而降低高血压的发病概率。Ichimura等[30]通过连续对自发性高血压大鼠口服喂养猪皮胶原水解产物多肽,发现ACE抑制肽Gly-Phe-Hyp-Gly-Pro的IC50为91 Μm,且Gly-Pro作为大量重复序列存在于胶原中。口服食用500 mg/kg的Gly-Pro显著降低大鼠的血压。
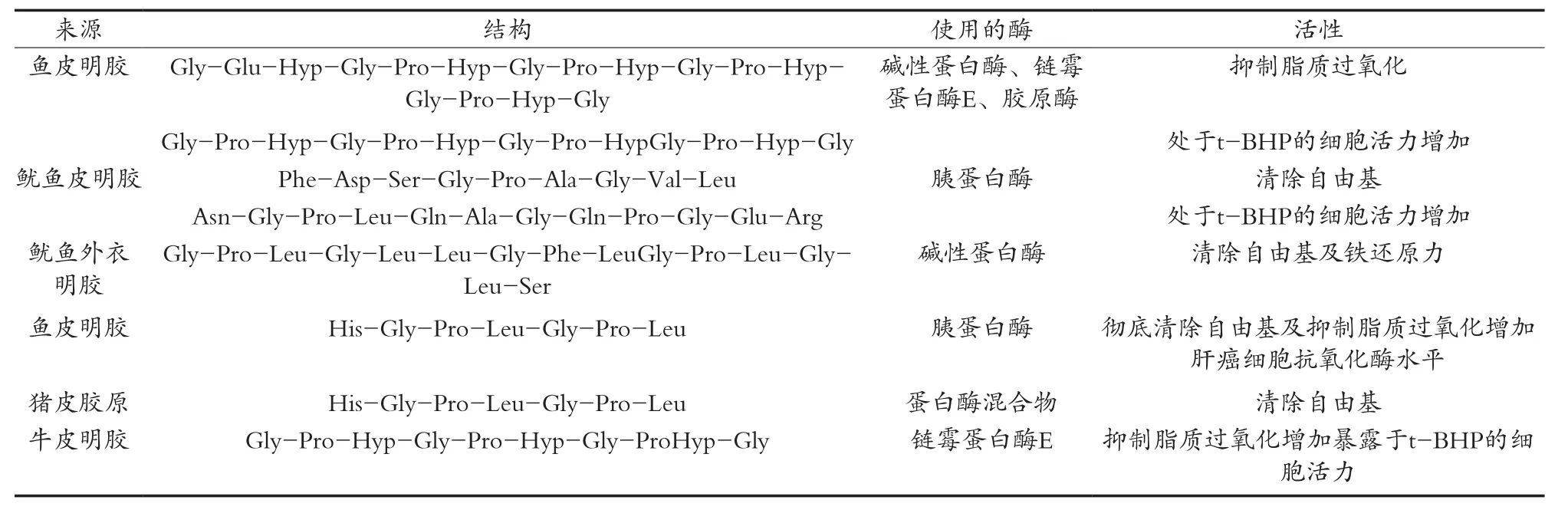
表3 由胶原及其水解产物明胶制备的具有抗氧化活性的多肽结构[31]
5 结语
随着人们生活水平的提高,生活需求不断提升。胶原及其水解产物以其独特优势在食品、化妆品、医疗等行业的利用将越来越广泛。但是目前市场产品鱼龙混杂,各种标志含有胶原蛋白或者胶原蛋白多肽保健产品的厂家对胶原及其水解产物的概念分不清楚,误导消费者。来自不同种类动物的胶原亦有不一样的功效,为避免市场对来自不同动物的胶原产品进行混淆视听,未来对不同物种胶原的鉴定研究应更加深入。

