利用超临界CO2流体萃取小球藻精油中活性成分的工艺
陈金明,张文焕,罗苏芹,戴宏杰,黄惠华*
1. 广州联丰香料科技有限公司(广州 510663);2. 吉百利糖果(广州)有限公司(广州 510730);3. 华南理工大学食品科学与学院(广州 510640)
小球藻(Chlorella)属绿藻门(Chlorophyta)、绿球藻目(Chlorococcales)、小球藻科(Chlorellaceae)中一个重要的属,是一种单细胞真核微藻[1]。小球藻在自然界分布较广,在海洋、湖泊、池塘、沟渠、潮湿的土壤、树皮等环境中均可生长繁殖,但以淡水环境为主[2]。小球藻的光合效率高、生长繁殖快、适应性强,具有超量吸收某些有机物和重金属的能力[3-4]。小球藻细胞中的色素主要为叶绿素和类胡萝卜素,以干物质计,其叶绿素含量通常为4%~6%,胡萝卜素含量为0.044 1%~0.044 8%,类叶黄素含量为0.267%~0.310%[3]。叶黄素的提取是叶黄素规模化生产中十分重要的下游环节,与叶黄素的最终产品品质和生产成本密切相关。目前提取叶黄素最常见的方法是通过有机溶剂提取,但存在萃取效率低、有机试剂残留等问题,其应用性受到很大的限制[5]。
超临界流体萃取技术是近20年来国际上迅速发展起来的最先进的物理萃取技术,已广泛应用于食品、香料、石油、化工、医药等行业,其中CO2是最常用的超临界流体[6]。在国外已有利用超临界CO2萃取小球藻活性成分的研究报道[7-10],但是在国内,这方面的研究相对较少[11-12]。试验以萃取温度、萃取压力、萃取时间和夹带剂用量为自变量,以精油得率和叶黄素浓度为因变量,通过响应面优化超临界CO2萃取小球藻精油工艺,以期为超临界CO2萃取小球藻精油及其活性成分提供基础数据。
1 试验材料与方法
1.1 材料与试剂
小球藻,购于CSIRO Marine Laboratory(Hobart,Australia);无水乙醇,分析纯,购于天津市百市化工有限公司;乙腈,色谱纯,购于天津四友精细化工有限公司;甲醇,色谱纯,购于天津四友精细化工有限公司;叶黄素,购于美国Sigma公司。
1.2 设备与仪器
DHG-9123 A超临界CO2萃取设备,广州轻工业研究所;高效液相色谱仪,美国戴安公司。
1.3 试验方法
1.3.1 小球藻精油提取技术路线
小球藻原料的预处理:购买原料→在低温(40~50 ℃)下烘干→称取藻粉100 g→加入一定体积的无水乙醇→密封、避光浸泡24 h。
超临界CO2萃取小球藻精油流程:
1) SC(L)FE-CO2流程:CO2钢瓶→冷冻系统→贮罐→高压泵→萃取釜→解析釜→冷冻系统(循环)。
2) 真空浓缩:萃取物→0.09 MPa,40 ℃下浓缩,去掉夹带剂无水乙醇→小球藻精油(深绿色油状物)。
1.3.2 单因素试验设计
影响超临界CO2萃取效果的主要因素有:萃取压力(MPa)、萃取温度(℃)、萃取时间(h)、夹带剂用量(mL)以及CO2流量(L/min)。考虑到萃取时的成本和萃取仪器的稳定性,单因素试验时未将CO2流量列入考察范围而将其固定在2.0 L/min。试验主要研究小球藻中的活性成分,所以确定以小球藻精油得率(g/100 g小球藻粉)以及油中的叶黄素浓度(mg/g小球藻精油)为考察指标,研究了萃取压力(7~30 MPa)、萃取温度(25~60 ℃)、萃取时间(1.0~6.0 h)、夹带剂无水乙醇用量(0~300 mL)对小球藻精油得率和叶黄素浓度的影响。
1.3.3 响应面试验设计
小球藻精油得率响应面优化:在单因素试验结果基础上进行响应面设计,选取显著性影响因素萃取压力、萃取温度和夹带剂无水乙醇用量三个因素为自变量,以小球藻精油得率为因变量进行三因素三水平的响应面设计试验(见表1)。采用Design-Expert 8.0.5软件对试验数据进行回归分析,并预测最佳萃取工艺。

表1 小球藻精油得率的响应面分析设计
小球藻精油叶黄素含量响应面优化:在单因素试验结果基础上进行响应面设计,选取显著性影响因素萃取压力、萃取温度、萃取时间和夹带剂无水乙醇用量四个因素为自变量,以小球藻精油叶黄素浓度为因变量进行四因素三水平的响应面设计试验(见表2)。采用Design-Expert 8.0.5软件对试验数据进行回归分析,并预测最佳萃取工艺。
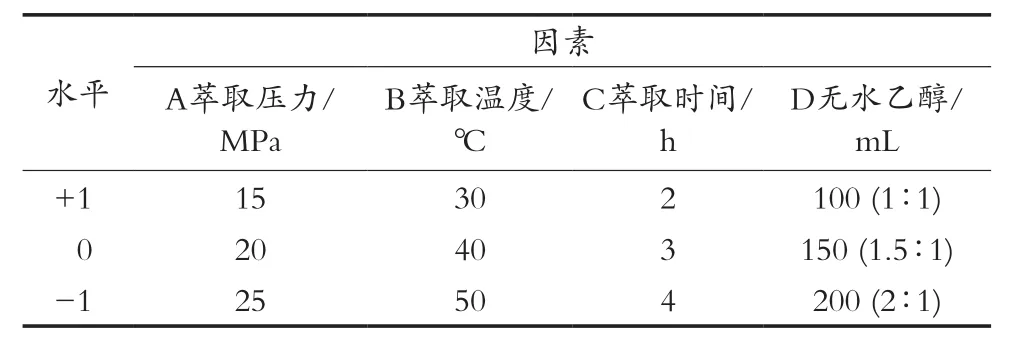
表2 叶黄素浓度的响应面分析设计
1.3.4 叶黄素含量分析
应用高效液相色谱进行叶黄素含量的分析[13]。采用Dionex HPLC系统测定,选用Symmetry C18色谱柱(5 μm;250 mm×4.6 mm),流动相为甲醇-乙腈(9:1,V/V),流动相流速1.0 mL/min,进样量10 μL,柱温25 ℃,PDA 996检测器在440 nm与470 nm处检测叶黄素,以Sigma公司的叶黄素作为标样进行叶黄素定量分析。得到回归方程Y=8.766 8X-40.546,其中Y为峰面积(R2=0.999 2)。
2 结果与讨论
2.1 单因素试验结果
2.1.1 萃取压力对小球藻精油得率与叶黄素浓度的影响
称取小球藻粉100 g,萃取温度为40 ℃,萃取时间为3 h,夹带剂无水乙醇为200 mL(液固比为2:1(mL·g)),萃取压力分别设定为7,10,15,20,25和30 MPa,进行萃取,每次萃取试验重复进行3次。小球藻精油得率分别为:3.89±0.13,4.85±0.12,5.11±0.07,5.80±0.09,5.48±0.07和5.13±0.06 g/100 g(见图1(a));小球藻精油中叶黄素浓度分别为:4.62±0.09,4.80±0.09,5.61±0.07,6.36±0.08,5.28±0.05和5.55±0.05 mg/g小球藻精油(见图1(b))。单因素方差分析结果表明萃取压力对小球藻精油得率和叶黄素浓度均有显著性的影响,从图1(a)中可知对精油得率影响最大的范围为15~25 MPa之间,从图1(b)中可知对叶黄素浓度影响最大的范围为10~25 MPa之间。
2.1.2 萃取温度对小球藻精油得率与叶黄素浓度的影响
称取小球藻粉100 g,萃取压力为20 MPa,萃取时间为3 h,夹带剂无水乙醇用量为200 mL(液固比为2:1(mL·g)),萃取温度分别设定为25,30,35,40,50和60 ℃,进行萃取,每次萃取试验重复进行3次。小球藻精油得率分别为:4.53±0.10,4.80±0.09,5.09±0.07,5.24±0.07,4.71±0.10和3.60±0.07 g/100 g(见图1(c));小球藻油中叶黄素浓度分别为:5.92±0.10,6.26±0.16,6.14±0.11,6.89±0.08,6.05±0.13和5.82±0.11 mg/g小球藻精油(见图1(d))。单因素方差分析结果表明萃取温度对小球藻精油得率和叶黄素浓度均有显著性的影响,从图1(c)和(d)中可知对精油得率和叶黄素浓度影响最大的范围均在30~50 ℃之间。
2.1.3 萃取时间对小球藻精油得率与叶黄素浓度的影响
称取小球藻粉100 g,萃取压力为20 MPa,萃取温度为40 ℃,夹带剂无水乙醇用量为200 mL(液固比为2:1(mL·g)),萃取时间分别设定为1.0,2.0,3.0,4.0,5.0和6.0 h进行萃取,每次萃取试验重复进行3次。小球藻精油得率分别为:5.43±0.06,5.55±0.05,5.67±0.06,5.71±0.07,5.70±0.07和5.60±0.06 g/100 g(见图1(e));小球藻精油中叶黄素浓度分别为:5.34±0.07,6.33±0.07,6.89±0.08,6.81±0.07,6.63±0.09和6.80±0.07 mg/g小球藻精油(见图1(f))。单因素方差分析结果表明萃取时间对小球藻精油的得率没有显著性的影响,后续试验将萃取时间固定在3.0 h。萃取时间对叶黄素浓度有显著性的影响,从图1(f)中可知对叶黄素浓度影响最大的范围为2.0~5.0 h之间。
2.1.4 夹带剂无水乙醇用量对小球藻精油得率与叶黄素浓度的影响
称取小球藻粉100 g,萃取压力为20 MPa,萃取温度为40 ℃,萃取时间为3 h,夹带剂无水乙醇分别设定为0,50,100,150,200和300 mL,即液固比分别为0,0.5:1,1:1,1.5:1,2:1和3:1(mL/g)进行萃取,每次萃取试验重复进行3次。小球藻精油得率分别为:0.48±0.09,2.81±0.08,5.00±0.12,5.84±0.08,5.67±0.07和5.56±0.06 g/100 g(见图1(g));小球藻精油中叶黄素浓度分别为:1.79±0.09,5.25±0.07,5.62±0.08,6.87±0.12,6.85±0.11和5.46±0.10 mg/g小球藻精油(见图1(h))。单因素方差分析结果表明夹带剂无水乙醇用量对小球藻精油得率和叶黄素浓度均有显著性的影响,从图1(g)和图1(h)中可知对精油得率和叶黄素浓度影响最大的范围均在100~300 mL之间。
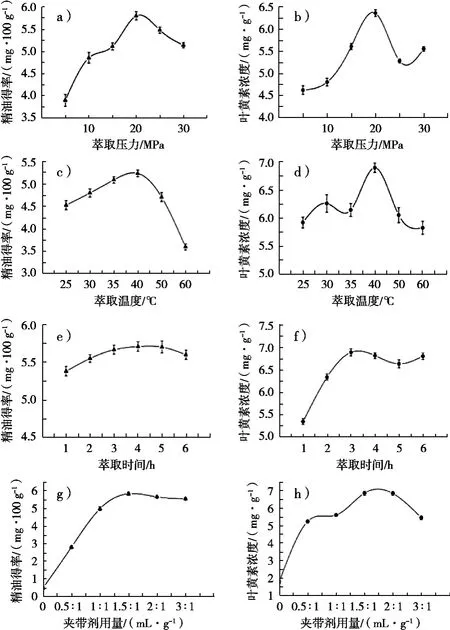
图1 萃取压力、萃取温度、萃取时间和夹带剂用量分别对小球藻精油得率和叶黄素浓度的影响
2.2 响应面分析优化试验
2.2.1 小球藻精油得率响应面设计试验与结果分析
运用Design-Expert 8.0.5软件进行响应面数据分析,小球藻精油得率响应面试验结果见表3。
各因素经过回归拟合后,建立的数学模型为:Y=5.26+0.64A-0.47B+0.55C-0.071AB-0.32AC+0.41BC-0.38A2-0.54B2-0.48C2。其中,Y为小球藻精油得率(g/100 g),A为萃取压力(MPa),B为萃取温度(℃),C为夹带剂无水乙醇用量(mL)。
由表4方差分析可知,整体模型的“Prob>F”值小于0.000 1,表明该二次方程模型高度显著。失拟项不显著,说明非试验因素对精油得率影响较小,该模型拟合良好。单因素A(萃取压力)、B(温度)以及C(夹带剂无水乙醇)均有高度显著的影响;AC、BC之间的交互作用影响均显著,而AB之间的交互作用影响不显著(见表3)。根据回归方程一次项系数绝对值的大小可得到三个因素对精油得率影响大小顺序为A>C>B,即萃取压力>夹带剂用量>萃取温度。
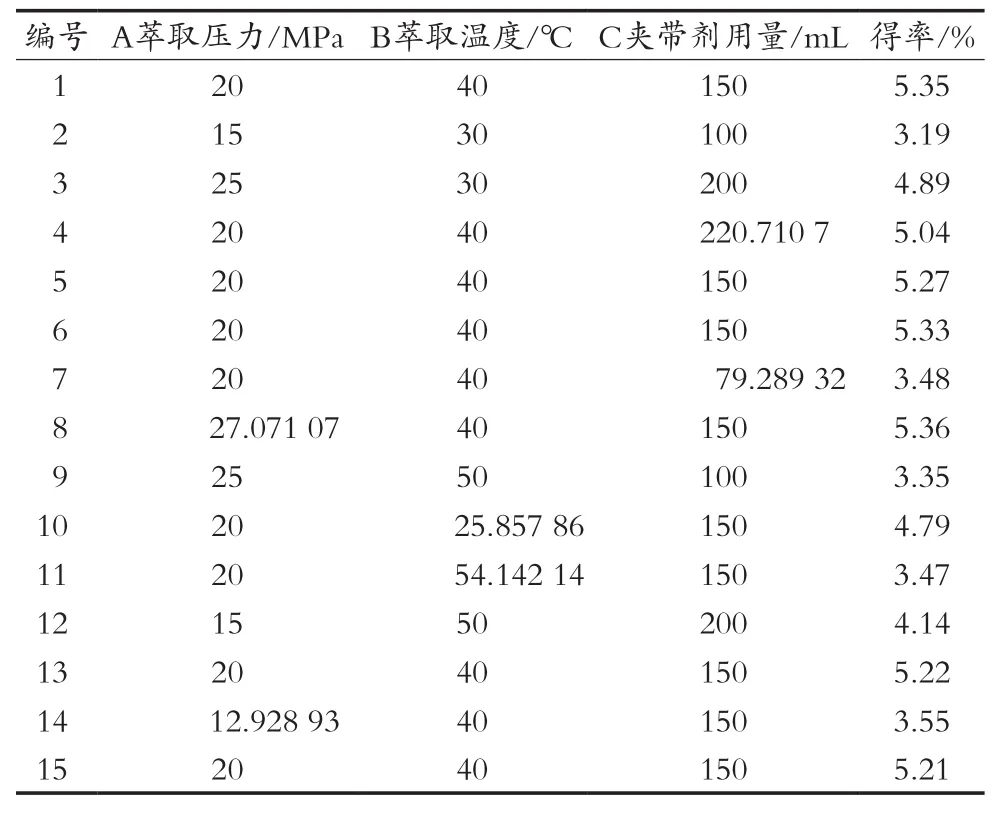
表3 小球藻精油得率的响应面分析试验结果
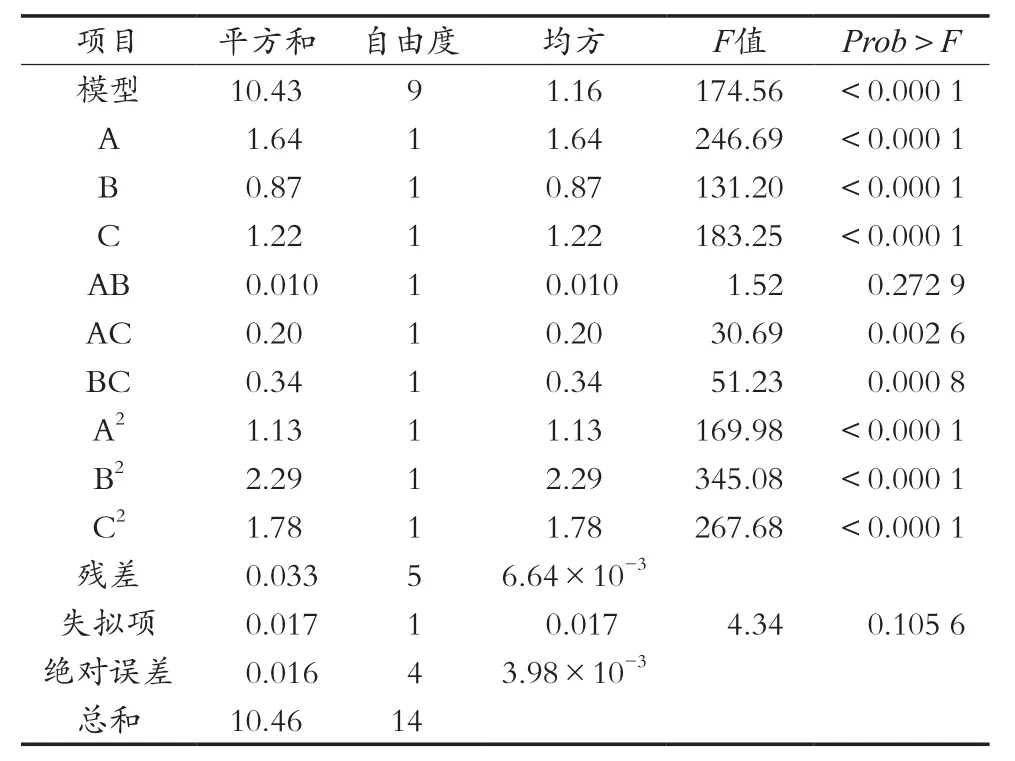
表4 小球藻精油得率的回归分析结果
图2(a)是在夹带剂无水乙醇用量为200 mL(液固比2:1(mL·g))时,萃取压力与温度对小球藻精油得率影响作用的响应面曲线。从图中可知,在较低的温度水平下,小球藻精油的得率随着温度的上升而增大,这是因为随着温度的上升,溶质的传质系数增大;而在较高的温度水平下,由于随着温度的升高,CO2的密度下降,导致了小球藻精油的得率随着温度的上升而下降的现象出现。同样,在较低的压力水平下,小球藻精油的得率随着压力的上升而增大并到达最高点,这是由于随着压力的增大,CO2流体的密度增大从而导致小球藻精油的溶解度增加[14];小球藻精油得率出现最高点后开始回落,这可能是由于在高压低温状态下,物料被压紧密度增大而且在低温下物料出现凝固现象,导致了传质速度的下降;或者在高压状态下,出现了溶质与溶剂间的互相排挤的现象,这些原因均会导致小球藻精油得率的下降[15]。图2(b)是在萃取温度为40 ℃,萃取压力与夹带剂无水乙醇对小球藻精油得率影响作用的响应面曲线。在高压力水平下,无水乙醇用量在较低水平下时,小球藻精油的得率随着无水乙醇用量的增加而提高,这是因为无水乙醇的增加使得越来越多的小球藻精油溶出,浓度增大,传质速度增加;而无水乙醇在较高的水平时,小球藻精油得率随着用量的增加而降低,这可能是由于过量的无水乙醇使得小球藻精油浓度下降,传质速度下降或者是在高压状态下产生了溶质与溶剂间的互相排挤的现象[15]。
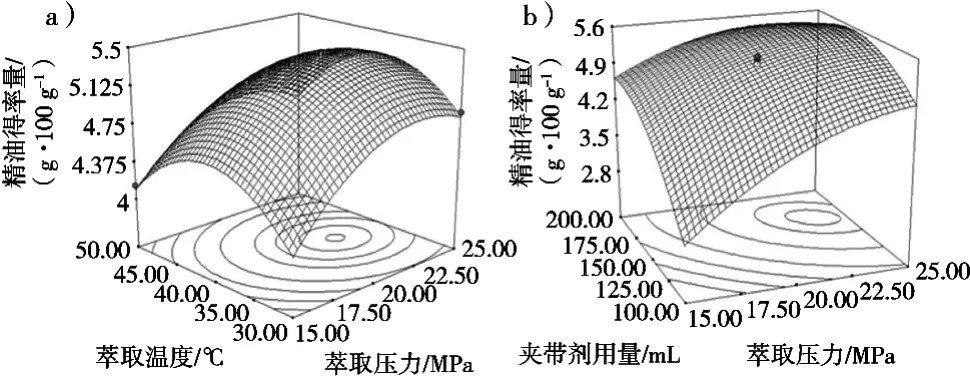
图2 萃取压力与温度和夹带剂用量和萃取压力对小球藻精油得率交互作用的响应面图
根据所建立的数学模型进行参数最佳化分析,得到小球藻精油得率最高所需的参数条件为:萃取压力24.16 MPa,萃取温度35.59 ℃,夹带剂无水乙醇用量155.42 mL(液固比约为1.55:1 mL/g)。此时小球藻精油得率为5.66 g/100 g藻粉。根据实际的应用情况,以萃取压力24 MPa,萃取温度36 ℃,夹带剂无水乙醇用量155 mL(液固比为1.55:1 mL/g)进行萃取,重复3次,得到小球藻精油得率为5.68±0.06 g/100 g藻粉,预测值与实际值无显著差异,表明预测结果实际可行。
2.2.2 小球藻叶黄素浓度响应面设计试验与结果分析
运用Design-Expert 8.0.5软件进行响应面数据分析,小球藻精油萃取工艺叶黄素浓度的响应面设计试验的结果见表5。
各因素经过回归拟合后,建立的数学模型为:Y=6.92-0.042A-0.18B-0.12C+0.13D+0.12AB-0.13AC-0.38AD-0.03BC+0.016BD+0.27CD-0.36A2-0.12B2-0.26C2-0.29D2。其中,Y为叶黄素浓度(mg/g小球藻精油),A为萃取压力(MPa),B为萃取温度(℃),C为萃取时间(h),D为夹带剂无水乙醇用量(mL)。
由表6方差分析可知,整体模型的“Prob>F”<0.000 1,表明该二次方程模型高度显著。失拟项不显著,说明该模型拟合良好。单因素A(萃取压力)、B(萃取温度)、C(萃取时间)和D(夹带剂无水乙醇用量)均有高度显著的影响;AB、AC、AD、BC和CD之间的交互作用影响均显著,而BD之间的交互作用影响不显著(见表6)。根据回归方程一次项系数绝对值的大小可得到四个因素对叶黄素浓度影响大小顺序为B>D>C>A,即萃取温度>夹带剂用量>萃取时间>萃取压力。
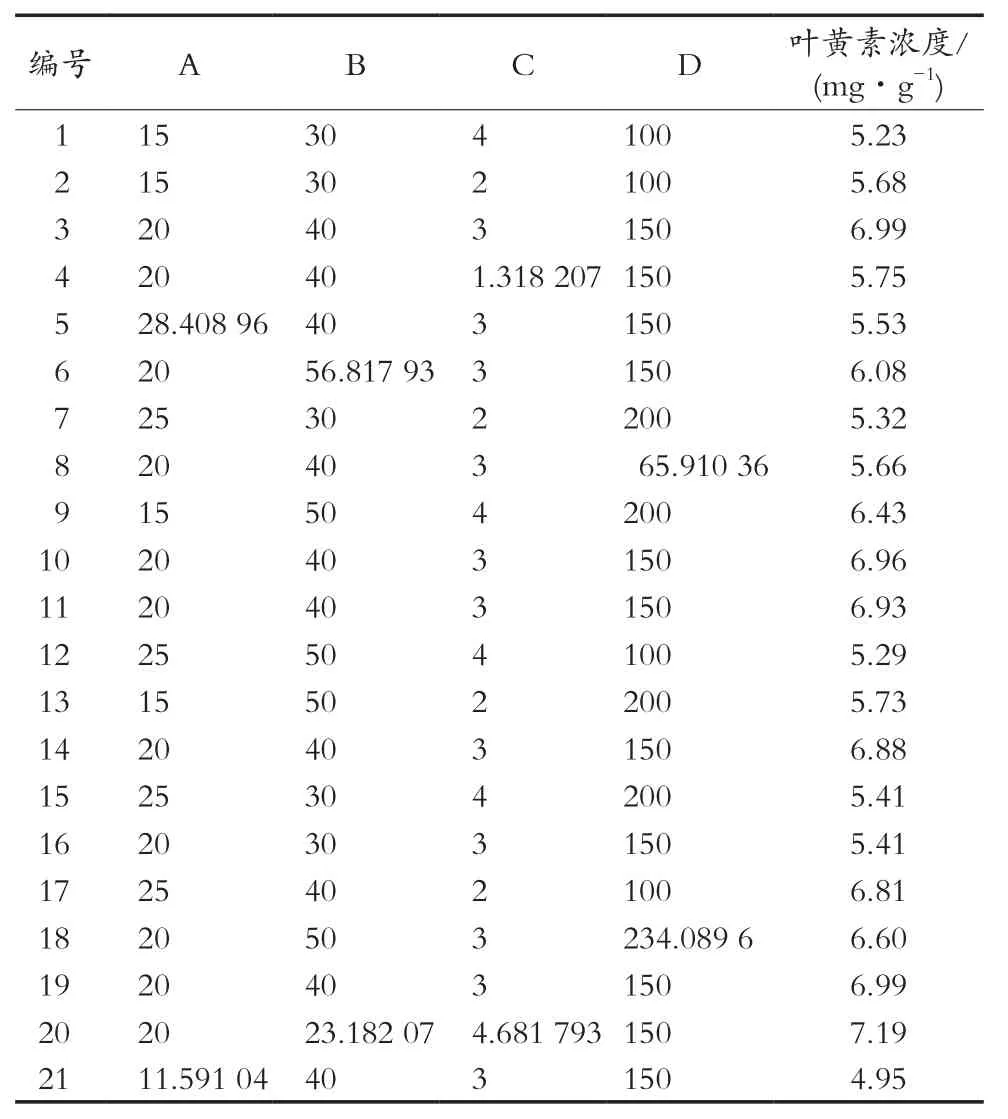
表5 叶黄素浓度的响应面分析试验结果
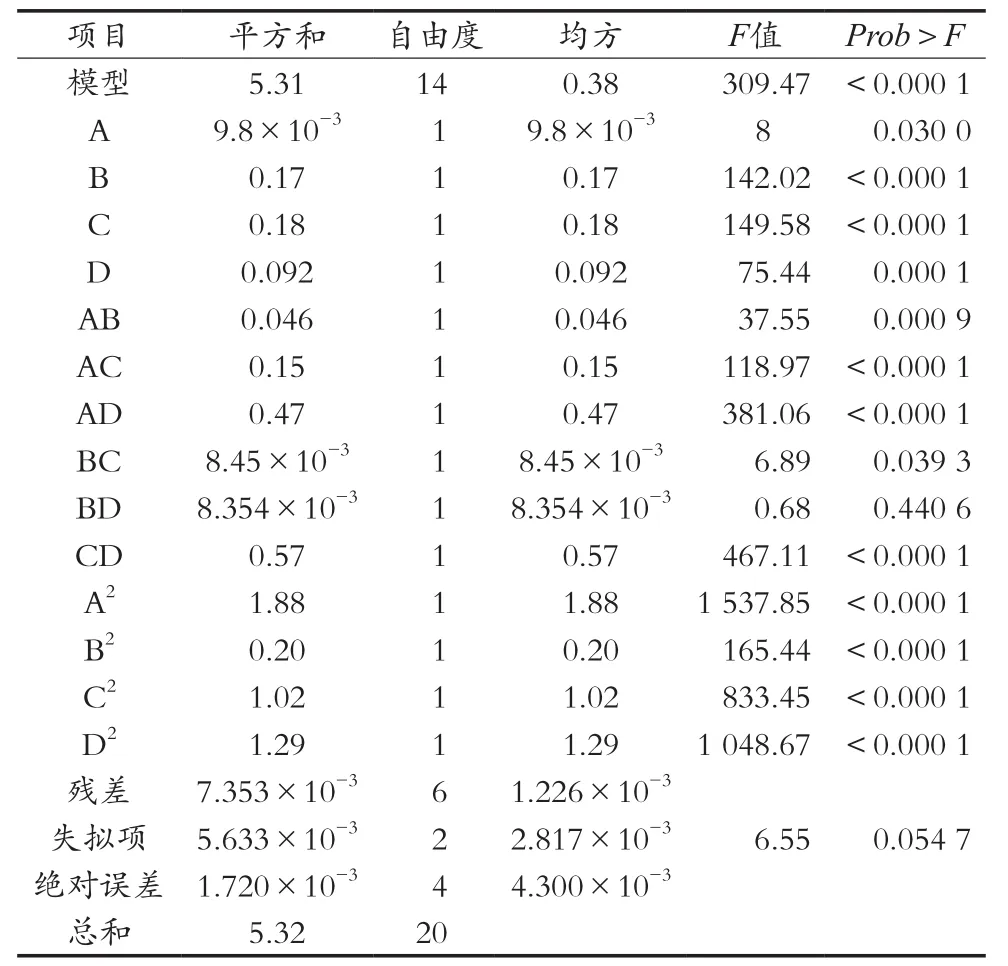
表6 叶黄素浓度的回归分析结果
图3(a)为在萃取2.5 h和夹带剂无水乙醇为150 mL(液固比1.5:1(mL·g))时,萃取压力与温度对小球藻精油中叶黄素浓度影响作用的响应面曲线。从图中可知,在较低的压力水平下,叶黄素浓度随着压力的上升而增大并到达最高点,这是由于随着压力的增大,CO2流体的密度增大从而导至大量的叶黄素随着小球藻油一起溶出,叶黄素浓度增加[16];在较高的压力水平下,叶黄素浓度随着压力的增加而降低,从前面的分析可知,在较高的压力水平下,小球藻油的得率也是随着压力的增加而降低,所以这也可能是由于在高压低温状态下,物料被压紧密度增大而且在低温下物料出现凝固现象,导致了传质速度的下降,而且叶黄素传质速度下降的速率更快;或者在高压状态下,出现了溶质与溶剂间的互相排挤的现象[15]。至于温度对叶黄素浓度的影响,在低温阶段,叶黄素浓度很快到达最高点,而低温度水平阶段小球藻油的得率会随着温度的提高而上升,说明了在低温的初始阶段叶黄素以比小球藻精油更快的速度传质,随后速率变慢;在高温水平下,叶黄素浓度随着温度的提升而下降,与小球藻精油的溶出趋势相近。
图3(b)为在40 ℃和无水乙醇用量为150 mL(液固比1.5:1)时,压力与萃取时间对小球藻精油中叶黄素浓度影响作用的响应面曲线。压力对叶黄素浓度的影响已在图3中说明,而在萃取时间上,叶黄素浓度随着时间的延长而增加,在萃取约3 h后,叶黄素浓度随着时间的延长而降低。这主要是因为长时间的萃取,会有大量其他组分溶出使得叶黄素浓度降低[16]。
图3(c)为在40 ℃和萃取2.5 h时,压力与无水乙醇用量对小球藻精油中叶黄素浓度影响作用的响应面曲线。压力对叶黄素浓度的影响已在图3中说明。在较低压力水平下,叶黄素浓度随着无水乙醇用量的增加而大幅提高,到达最高点后开始回落,在相同阶段,小球藻精油的得率也随着无水乙醇用量的增加而提高,但是增幅缓慢,所以在该阶段中与其它组分相比,叶黄素以较大的传质速度溶出,使得浓度大幅提高;而在较高的压力水平下,叶黄素浓度在较低的无水乙醇用量下变化不大,但是随着无水乙醇用量的进一步提高,叶黄素浓度急剧下降,这是因为在相同阶段下,小球藻精油的得率快速增大并达到最高点,即相对较多的其他组分溶出,最终使得叶黄素浓度下降[16]。
根据所建立的数学模型进行参数最佳化分析,得到小球藻油中叶黄素浓度最高所需的参数条件为:压力15.76 MPa,萃取温度30 ℃,萃取时间2.77 h,无水乙醇用量198.94 mL(液固比约1.99:1(mL·g))。此时叶黄素浓度为7.09(mg/g小球藻精油)。根据实际的应用情况,以压力16 MPa,萃取温度30 ℃,萃取时间2.8 h,夹带剂无水乙醇用量199 mL(液固比1.99:1(mL·g))进行萃取,重复3次,得到叶黄素浓度为7.13±0.10(mg/g小球藻精油),预测值与实际值无显著差异,表明预测结果实际可行。
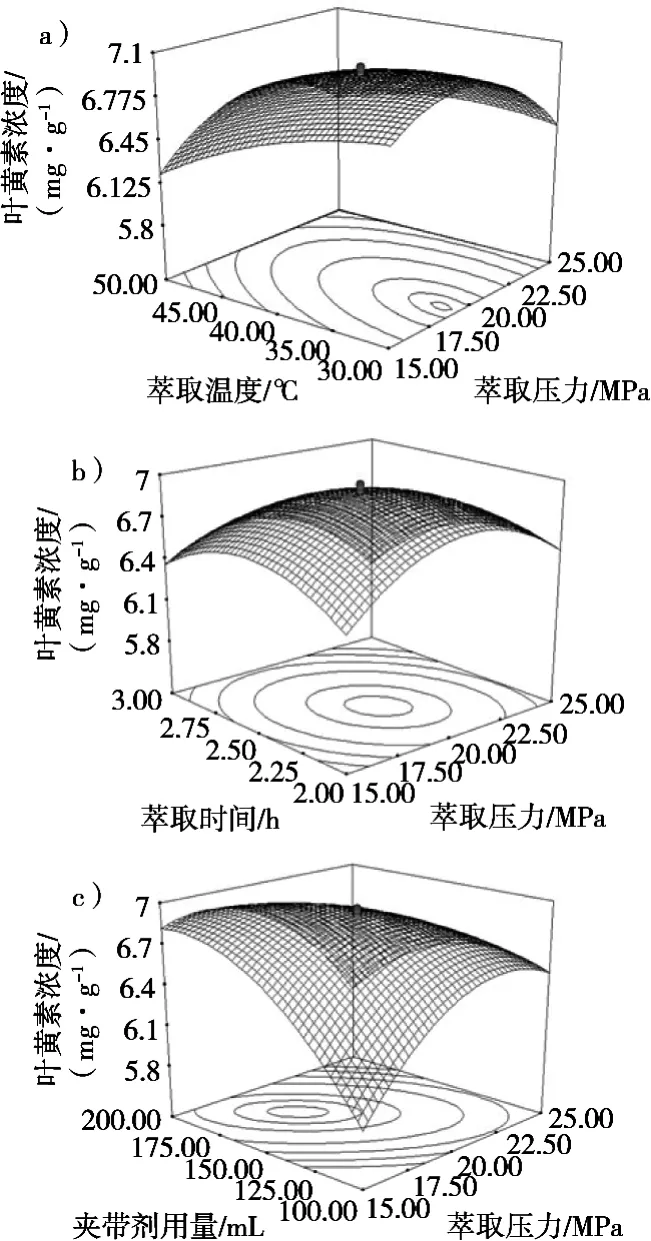
图3 萃取压力与萃取温度、萃取压力与萃取时间、萃取压力与夹带剂用量对叶黄素浓度的交互作用的响应面图
3 结论
1) 单因素试验分析结果:通过对单因素萃取压力、萃取温度、萃取时间以及无水乙醇用量的显著性检验,除萃取时间以外,其它三因素均对小球藻精油得率有显著性的影响;四个因素均对叶黄素浓度有显著性影响,根据各因素的最大影响范围确定了对响应面设计试验的水平范围,分别为压力15~25 MPa,温度30~40 ℃,时间2~4 h,无水乙醇用量100~200 mL。
2) 通过对小球藻精油得率的三因素三水平响应面设计试验分析,小球藻精油的最佳萃取工艺为:萃取压力24 MPa,萃取温度36 ℃,无水乙醇用量155 mL。此时得到小球藻精油得率为5.68±0.06(g/100 g藻粉)。
3) 通过对叶黄素浓度的四因素三水平响应面设计试验分析,叶黄素的最佳萃取工艺为:萃取压力16 MPa,萃取温度30 ℃,萃取时间2.8 h,无水乙醇用量199 mL进行萃取。此时,得到叶黄素浓度为7.13±0.10(mg/g小球藻精油)。

