超声波破碎法提取香草酸脱羧酶条件的优化
周金虎,毛志海,陈茂彬,方尚玲*
1. 发酵工程教育部重点实验室(湖北工业大学),工业发酵湖北省协同创新中心,工业微生物湖北省重点实验室(武汉 430068);2. 湖北华信制药有限公司(咸宁 437400)
白酒是中国的国酒,历经千百年传承仍被现代人所青睐,这不仅是中国白酒魅力所在,同时也是中国白酒健康价值的体现[1]。有文献报道,茅台酒有预防肺癌、浅表性胃炎等疾病的功效[2]。愈创木酚作为白酒中健康因子之一,越来越强引起科研工作者的关注。研究表明,愈创木酚类物质是良好的自由基清除剂,具有较好的活性氧消除功能,可抗氧和预防心血管等多种疾病的发生,具有预防疾病、抗衰老、促进人体健康的作用[3]。
香草酸脱羧酶是愈创木酚生成过程中起关键作用的酶,香草酸在香草酸脱羧酶的催化下非氧化脱羧生成愈创木酚[4]。通过对该酶性质的研究,可以更加深入地认识愈创木酚的产生,也为愈创木酚的代谢调控提供参考。截至目前,对香草酸脱羧酶相关的研究很少有文献报道。因此试验以筛选到的Delftia sp. X-a12为供试菌株,考察不同单因素对细胞超声破碎的影响,通过正交试验综合考虑各因素对细胞超声破碎的影响,以期为基于酶活代谢调控的控制提供方法和数据参考。
1 材料与方法
1.1 材料与试剂
供试菌株:从黄鹤楼浓香型酒厂筛选到的Delftia sp. X-a12。
香草酸(>98%,上海麦克林生化科技有限公司);愈创木酚(>98%,色谱纯,美国Aladdin工业公司);无水乙醇(≥99.8%,色谱纯,美国Aladdin工业公司);NaCl、NaH2PO4、Na2HPO4(均为分析纯,国药集团化学试剂有限公司)等。
发酵培养基[4]:牛肉膏0.3%、蛋白胨1.0%、氯化钠0.5%、(NH4)2SO40.04%、MgSO4·7H2O 0.1%、CaCl2·2H2O 0.05%、KH2PO40.12%、MnSO4·H2O 0.05%、0.5 mmol/L香草酸,在pH自然,121 ℃下灭菌30 min。
1.2 仪器和设备
SCIENTZ-IID超声波细胞破碎仪(宁波新芝生物科技股份有限公司);X1R高速冷冻离心机(美国赛默飞世尔科技公司);TB-214电子分析天平(d=0.1 mg,赛多利斯科学仪器(北京)有限公司);85-2 A数显恒温磁力搅拌(金坛市科析仪器有限公司);YM 30 Z立式压力蒸汽灭菌锅(上海三申医疗器械有限公司)等。
1.3 方法
1.3.1 种子液的制备
无菌条件下,用接种环挑取一环Delftia sp. X-a12菌泥于10 mL发酵培养基中,于37 ℃、160 r/min条件下培养24 h,作为种子液备用。
1.3.2 菌株生长曲线的绘制
将种子液按2%的接种量接种至100 mL发酵培养基中,于37 ℃、160 r/min条件下培养24 h,期间每隔2 h测定其在600 nm处的吸光度。以时间为横坐标,OD值为纵坐标,绘制菌体生长曲线,确定菌株的对数生长期。
1.3.3 超声波细胞破碎[4]
将培养至对数生长期的Delftia sp. X-a12菌悬液30 mL(离心管50 mL)在10 000 r/min、4 ℃条件下离心10 min,弃上清,用pH 6.5 20 mmol/L磷酸缓冲液洗涤菌体,离心弃上清,洗涤菌体离心弃上清,按菌体质量浓度0.10 g/mL悬浮于pH 6.5 20 mmol/L磷酸缓冲液中,在一定条件下进行超声波细胞破碎,在14 000 r/min、4 ℃条件下离心15 min,收集上清即为粗酶液。
1.3.4 香草酸脱羧酶酶活测定
检测香草酸脱羧酶脱羧活性反应体系为:0.5 mmol/L香草酸和粗酶液6 mL,在45 ℃、120 r/min条件下反应1 h后,用GC-MS检测愈创木酚的含量。以热灭活的对应酶(121 ℃、20 min)作为空白对照。
一个酶活单位(U)定义为1 min生成1 ng愈创木酚所需的酶量,酶比活力定义为以香草酸为底物,1 mL粗酶液每分钟转化生成1 ng愈创木酚所需的酶量为1个酶比活力单位,以U/mL来表示。
愈创木酚含量采用气质联用法(GC-MS)进行测定。采用外标法进行定量检测。
样品处理:取反应溶液1 mL,加入NaCl直至饱和,顶空固相微萃取20 min。气相色谱条件:DB-Wax色谱柱(30 m×0.25 mm×0.25 μm)气相色谱。进样口温度260 ℃,载气He,流速1.0 mL/min。不分流进样。升温程序为,50 ℃,保持0 min,再以20 ℃/min升温至150 ℃,保持0 min,再以10 ℃/min的速率升温至220 ℃,保持5 min。溶剂延迟5 min[5]。
质谱条件:电子电离(EI)源,采集类型SIM扫描。电子能量70 eV,离子源温度230 ℃,MS四级杆温度150 ℃,质量扫描范围50.00~600.00 m/z。
1.3.5 超声波破碎单因素试验[6]
将超声波破碎处理的各基础参数值设为:输出功率300 W,每次辐射时间3 s,间歇时间5 s(固定不变)、工作总时间10 min、菌体质量0.1 g/mL,并固定每次菌悬液的处理体积为30 mL,分别考察超声波输出功率(200,300,400,500和600 W)、工作总时间(2,5,10,15和20 min)和菌体质量浓度(0.020,0.025,0.030,0.050,0.10和0.20 g/mL)对香草酸脱羧酶提取效果的影响。
1.3.6 超声波破碎响应面优化试验[7]
在单因素试验基础上,以输出功率(A)、处理总时间(B)和菌体质量浓度(C)为考察因子,以香草酸脱羧酶酶活(Y)为响应值,利用Design-Expert 8.0.6中的Box-Behnken Design进行响应面试验设计,因素与水平编码值见表1。

表1 Box-Behnken试验因素与水平编码表
1.3.7 (NH4)2SO4分级沉淀和透析[8-10]
向8个分别装有25 mL粗酶液的小烧杯中缓慢加入干燥并研磨后的(NH4)2SO4(冰水浴条件下进行,边搅拌边加入),使其饱和度分别为20%,30%,40%,50%,60%,70%,80%和90%,于4 ℃下分别静置8 h,在14 000 r/min、4 ℃条件下分别离心30 min,弃上清,沉淀分别用预冷的缓冲液溶解后,置于透析袋中,并在缓冲液中分别透析过夜(4 ℃,磁力搅拌),分别测定其中香草酸脱羧酶酶比活。
2 结果与分析
2.1 菌株生长曲线绘制
细菌的生长一般分为4个阶段:延滞期、对数生长期、稳定期及衰亡期[11-12]。以时间为横坐标,OD值为纵坐标,Delftia sp. X-a12在发酵培养基中生长曲线见图1。
1620年,一艘载有100多人的船横渡大西洋来到新大陆定居。这个宗教团体在英国开始质疑教会的信仰,所以想与之分离。朝圣者在现在的马萨诸塞州定居。他们在新大陆的第一个冬天过得很艰难。他们来得太晚了,不能种更多的庄稼,没有新鲜食物,一半的人死于疾病。第二年春天,易洛魁族印第安人教他们如何种植玉米,这是殖民者的新食物,告诉他们如何在这陌生的大地种植其他作物,以及如何捕猎和捕鱼。
Delftia sp. X-a12的对数生长期为6~18 h,由文献得知香草酸脱羧酶是一种诱导酶,在对数生长期时代谢产香草酸脱羧酶量最多,所以选择培养18 h的菌悬液进行细胞破碎。
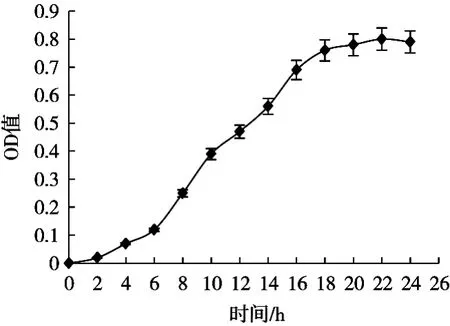
图1 Delftia sp. X-a12的生长曲线
2.2 超声波破碎单因素试验
2.2.1 输出功率对细胞破碎的影响
固定超声波辐射时间3 s、间歇时间5 s、工作总时间20 min、菌体质量浓度0.10 g/mL,考察超声波输出功率对香草酸脱羧酶活性的影响,结果见图2。
香草酸脱羧酶活性随输出功率的增大先升高后降低,500 W时达到最大,为5.50 U/mL。这是因为超声功率过小,不能有效破坏细菌细胞壁,释放胞内酶,增大输出功率,有利于空化泡的形成,从而增强破碎效果,但输出功率过大,则会引起细胞悬液局部温度和压力过高,导致胞内酶失活[6-7]。因此选定输出功率为500 W。
2.2.2 处理总时间对细胞破碎的影响
固定超声波辐射时间3 s、间歇时间5 s、菌体质量浓度0.10 g/mL、输出功率500 W,考察处理总时间对香草酸脱羧酶活性的影响,结果见图3。
随着处理总时间的延长,香草酸脱羧酶活性呈先升高后降低趋势,在15 min时达到最大,为55.41 U/mL。这是因为处理总时间过短,不能有效破坏细菌细胞壁,释放胞内酶,增加处理总时间,有利于空化泡的形成,从而增强破碎效果,但处理时间过长,则会引起细胞悬液局部温度和压力过高,使得菌液出现较多泡沫,导致酶失活和变性,同时由于时间过长细胞过于破碎,导致大量杂蛋白和其他杂质被提取出来,增加后续分离纯化目标蛋白的难度[13]。因此选定处理总时间为15 min。
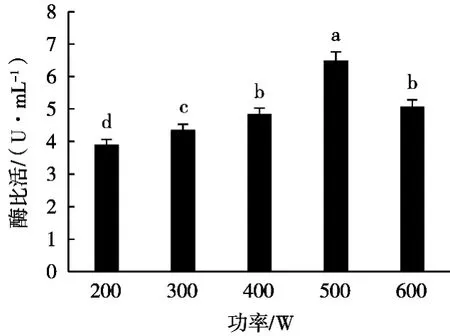
图2 超声波输出功率对香草酸脱羧酶活性的影响
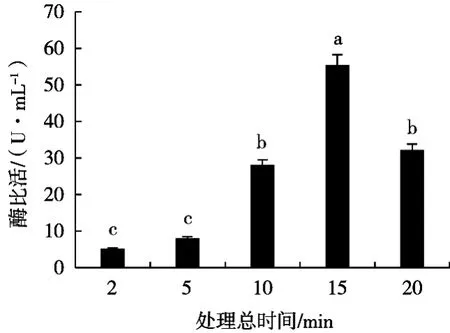
图3 处理总时间对香草酸脱羧酶活性的影响
2.2.3 菌体质量浓度对细胞破碎的影响
随着菌体质量浓度增加,香草酸脱羧酶活性呈先升高后降低趋势,0.10 g/mL时达到最大,为13.36 U/mL。这是因为细胞浓度低时,菌液的黏度下降,有利于细胞的破碎,但总体酶活较低,细胞浓度高时,菌液黏度增大,不利于空化泡的形成和爆炸,破碎效果反而下降,所以选择菌体质量浓度0.10 g/mL较为合适。
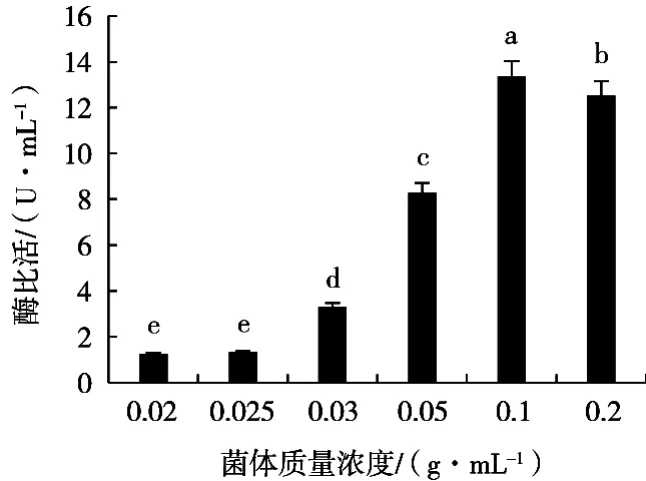
图4 菌体质量浓度对香草酸脱羧酶活性的影响
2.3 响应面试验
2.3.1 Box-Behnken试验设计与结果[14]
由单因素试验结果可知,不同试验因素对香草酸脱羧酶酶比活力的影响有所不同。为了优化超声波细胞破碎粗酶液中香草酸脱羧酶酶比活力的最佳条件,以中心组合试验设计原理为依据,根据单因素试验结果分析,进行三因素三水平响应面设计分析,共设计17次试验,12次为析因试验,5次中心试验,Box-behnken试验设计及结果见表2,回归模型方差分析结果见表3。
利用Design-Expert 8.0.6软件对表2的数据进行多元回归拟合分析,得出响应面回归方程为:Y=11.87-65.95A+53.33B+96.91C+144.89AB-85.07AC+93.43BC+156.83A2+128.54B2-4.12C2。
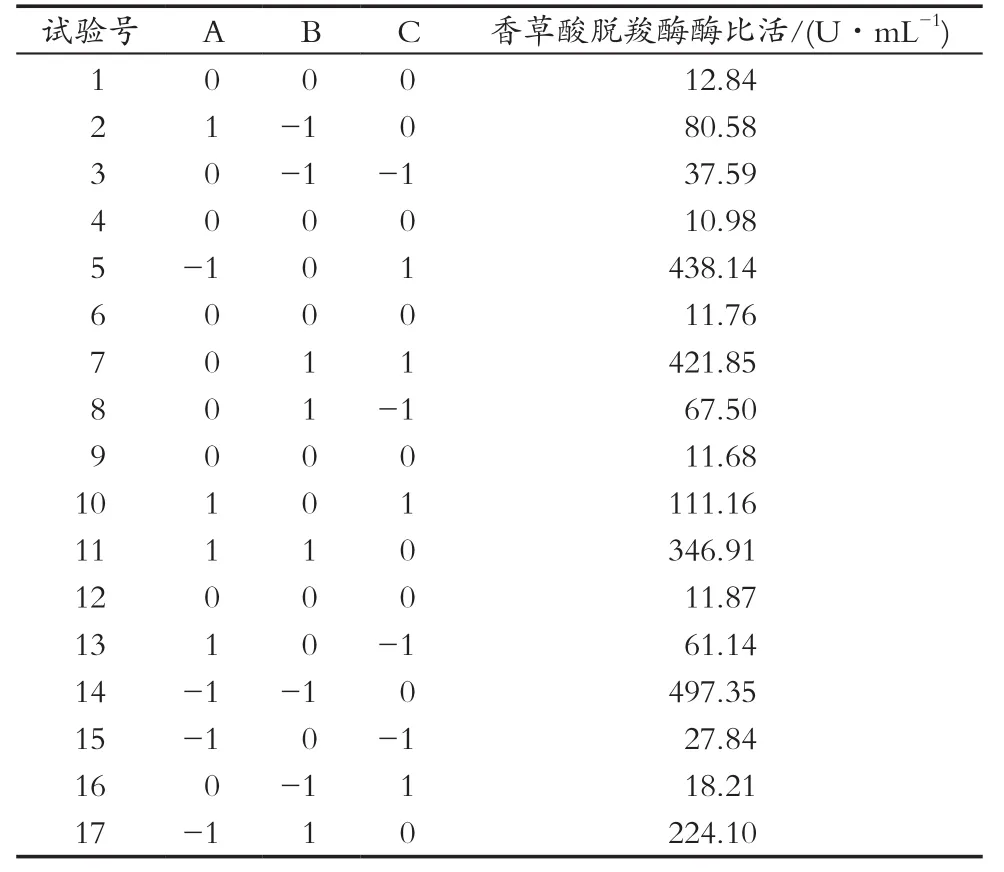
表2 Box-Behnken试验设计及结果

表3 回归模型方差分析
由表3可知,根据F值各个因素对试验结果影响次序为C>A>B,即菌体质量浓度>输出功率>处理总时间。建立的模型p=0.000 5<0.01,模型极显著。失拟项p=0.071 2>0.05,表示纯误差不显著。其中一次项C,交互项AB,二次项A2、B2均呈极显著,说明相关因素对超声波细胞破碎粗酶液中香草酸脱羧酶酶比活力影响较大。决定系数R2=0.957 5,表明超声波细胞破碎粗酶液中香草酸脱羧酶酶比活力实际值与预测值拟合度。校正决定相关系数R2adj=0.902 8,表明模型中各因素对香草酸脱羧酶酶比活力变化情况。因此,该模型有效,可用来预测分析各因素对香草酸脱羧酶酶比活力的影响。
2.3.2 响应面分析与优化
根据回归方程绘制响应面分析图,以确定输出功率、处理总时间、菌体质量浓度对超声波细胞破碎粗酶液中香草酸脱羧酶酶比活力的影响,响应面曲面和等高线见图5。
由图5可知,输出功率与处理总时间交互作用、输出功率与菌体质量浓度交互作用、处理总时间与菌体质量浓度交互作用的显著性情况与表3中交互项p值的分析结果一致。响应面的坡度较为陡峭,表明香草酸脱羧酶酶比活力对输出功率与处理总时间、输出功率与菌体质量浓度、处理总时间与菌体质量浓度的变化较为敏感。在输出功率不变的条件下,随着处理总时间延长,香草酸脱羧酶酶比活力呈先上升后下降的变化趋势,其他交互因素同上。
等高线呈圆形,表明两因素之间的交互作用强度较弱,影响不显著。等高线呈椭圆形,表明两因素之间的交互作用强度较强,影响显著[14]。
通过Design-Expert 8.0.6软件分析,提高超声波细胞破碎粗酶液中香草酸脱羧酶酶比活力的最佳条件为:超声波输出功率450 W、处理总时间18 min、菌体质量浓度0.12 g/mL,此条件下香草酸脱羧酶酶比活力的理论值为542.86 U/mL。
2.3.3 验证试验
在响应面优化得到的最佳条件下,即超声波输出功率450 W、处理总时间18 min、菌体质量浓度0.12 g/mL进行3次平行试验,实际测得的平均香草酸脱羧酶酶比活力为541.27 U/mL。试验值与理论值相近,证明应用响应面法优化超声波细胞破碎粗酶液中香草酸脱羧酶酶比活力是可行的[15]。
2.4 (NH4)2SO4分级沉淀分析
利用(NH4)2SO4分级沉淀的方法对超声波细胞破碎处理获得的粗酶液进行纯化,结果如图6所示。
香草酸脱羧酶主要集中在(NH4)2SO4饱和度50%~70%范围内,(NH4)2SO4饱和度达到60%时,酶比活达到最大,为633.34 U/mL,相当于粗酶液纯化倍数提高了1.17。而蔡瑞[4]使用80%饱和度的(NH4)2SO4沉淀A.acidoterrestris DSM 3923中的香草酸脱羧酶,这可能是由于该类酶的来源不同,所以性质也有所不同。
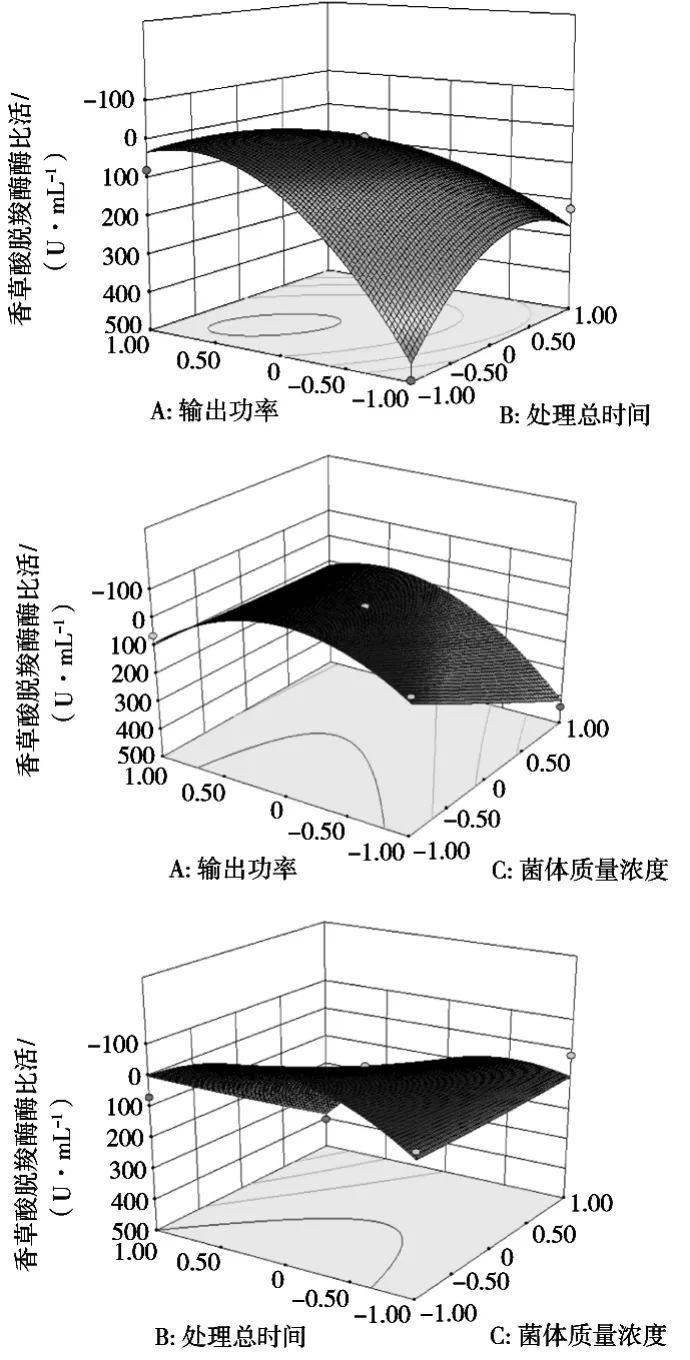
图5 输出功率、处理总时间与菌体质量浓度交互作用对香草酸脱羧酶酶比活力影响的响应面与等高线

图6 (NH4)2SO4分级沉淀对香草酸脱羧酶酶比活力的影响
3 结论
以前期从黄鹤楼浓香型酒厂窖泥中筛选到的Delftia sp. X-a12为基础,采用超声波破碎法对细胞进行破碎获得香草酸脱羧酶,通过单因素试验和响应面试验,获得香草酸脱羧酶酶活较高的提取条件:超声波输出功率450 W、处理总时间18 min、菌体质量浓度0.12 g/mL。此条件下香草酸脱羧酶酶比活力为541.27 U/mL。对粗酶液进行(NH4)2SO4分级沉淀,(NH4)2SO4饱和度达到60%时,酶比活达到最大,为633.34 U/mL,相当于粗酶液纯化倍数提高了1.17。通过对该酶性质的研究,可以更加深入的认识愈创木酚的产生,也为愈创木酚的代谢调控提供参考,以期为基于酶活代谢调控的控制提供方法和数据参考。

