杂交鲟维氏气单胞菌的分离鉴定及其耐药性分析
潘吉脉,张明洋,贺欣微,胡安东,杨 霞,张 飘,姜海波,文 明,2
(1.贵州大学动物科学学院,贵州 贵阳 550025;2.贵州省动物疫病与兽医公共卫生重点实验室,贵州 贵阳 550025)
我国是鲟鱼养殖规模化较大的国家,主要养殖品种为施氏鲟、西伯利亚鲟、匙吻鲟、杂交鲟等,其中杂交鲟是由不同品种的鲟鱼利用杂交技术孕育而来,具有生长快、性成熟早、遗传性状稳定、经济效益高等优势;因此,在鲟鱼养殖量中占比相当高的份额[1]。但在养殖杂交鲟的过程中,由于其易暴发疾病,尤以细菌性疾病较为严重,给鲟养殖业的发展造成严重阻碍。
维氏气单胞菌(Aeromonas veronii)隶属弧菌科、气单胞菌属,广泛存在于淡水环境:河流、湖泊、污水以及淤泥中,可引起多种水产动物发病。曾有鲫、鲤、鳗、虾、蟹等水生动物感染发病,主要临床症状为腹腔积水,表皮出血,肛肠润红等[2],其死亡率高达80%左右,给养殖行业带来重大经济损失。曾有报道从患病西伯利亚鲟中分离鉴定出维氏气单胞菌,但杂交鲟感染维氏气单胞菌报道较少。本试验从贵州某鱼场获得患病杂交鲟,主要症状为体表出血、肛门红肿外翻、鱼鳃暗红,剖检出现腹中严重积水、肝脏肿大等,初步疑似细菌性疾病,从患病杂交鲟中分离出一优势菌株,经染色镜检、生化鉴定、细菌16S rDNA基因分析,并进行系统进化树分析与序列比对,K-B法药敏试验及耐药基因与毒力基因检测,此试验对贵州地区鲟细菌性疾病的防治和合理用药指导提供理论参考,以及提高经济效益做出贡献。
1 材料与方法
1.1 主要试剂 脑心浸液琼脂培养基(BHI)与液体培养基均由贵州大学动物疫病研究所兽医实验室自制;革兰染色试剂盒,购自北京索莱宝科技有限公司;细菌生化鉴定管和细菌药敏纸片,均购自擎科生物试剂有限公司;细菌基因组DNA提取试剂盒,购自天根生化科技(北京)有限公司;健康状况良好的昆明种小鼠10只,购自重庆腾鑫生物科技有限公司。
1.2 细菌分离培养 患鱼由贵州省某水产动物养殖场运送至本实验室,用75%酒精擦拭患鱼全身,以作鱼体表面消毒处理,无菌操作条件下,取患鱼心、肝、肾、脾、腹水划线接菌于 BHI,置于30℃,24 h恒温箱中培养,细菌长出。取其优势菌落进一步纯化培养。同时也进行革兰染色,显微镜下观察菌体形态。
1.3 细菌生化鉴定 挑取单个菌落接种于BHI液体培养基中,纯化培养后,用接菌棒沾取菌液,插入细菌微量生化管中,后将微量生化管置于30℃恒温箱,培养24 h。生化的测定指标参照《常见细菌系统鉴定手则》,并用黎炯等[3],杨移斌等[4]人方法,对分离菌进行初步鉴定。
1.4 分离菌16S rDNA扩增测序及序列分析 以提取分离株DNA为模版,细菌16S rDNA通用引物由生工生物工程(上海)股份有限公司合成,上、下游引物分别是:27F:5′-AGAGTTTGATCATGGCTCAG-3′,1492R: 5′-TACGGTTACCTTGTTACGACTT-3′;预计扩增片段大小为1 500 bp。PCR反应体系为25 μL,2 ×TaqPCR Markter Mix:12.5 μL,上、下游引物各1 μL,模板2 μL,剩下用双蒸水补足。反应条件:94℃预变性5 min;94℃变性30 s,55℃退火温度45 s,72℃延伸90 s,共30个循环;72℃延伸10 min。取10 μL PCR产物进行1.5%琼脂糖凝胶电泳检测结果。
另送PCR产物于生工生物工程(上海)股份有限公司进行基因序列测序;测序结果与NCBI基因数据库中进行对比分析;利用Mega 7.0软件建立系统发育树。通过自荐分析进行置信度检测,自荐数集1 000次。
1.5 分离菌动物试验 将分离菌接种于HBI液体培养基中,30℃温箱培养10 h,将菌液离心,收集菌体,用灭菌PBS洗涤菌体两次,并把菌体配备成1×108CFU/mL浓度的菌悬液。实验动物为10只健康小鼠,随机分为试验组与对照组各5只;试验组小鼠腹腔注射100 μL浓度为1×108CFU/mL菌悬液,对照组注射无菌PBS;连续观察7 d,对小鼠出现临床症状进行记录,并对死亡小鼠进行剖检及病原菌分离,生化鉴定死亡小鼠分离出的病原菌。
1.6 分离菌药敏试验 药敏试验用全国临床实验室标准委推荐的K-B法,进行测定分离菌对药物的敏感程度,纯化培养后的菌液,吸取100 μL涂匀于HBI固体培养基上,后将药敏纸片规则的放在BHI培养基上,每个培养基上放5片药敏纸片,于30℃培养24 h后,用游标卡尺测定抑菌圈。结果判定依据美国临床实验室标准研究所出版《药敏试验指南》的标准,进行证实菌株对不同抗生素药物的敏感程度。
1.7 分离菌耐药性基因与毒力基因检测 以分离菌提取的DNA为模板,对耐磺胺基因(Sul1,Sul2)、Ⅰ类整合子(Intl1)、耐药氟苯尼考基因(FxeA)4种耐药基因进行PCR扩增,引物设计参考文献[5-7],引物由生工生物工程(上海)股份有限公司承接合成,耐药基于引物信息见表1;反应体系同1.4,反应条件:94℃预变性5 min;94℃变性30 s,退火(退火温度见表1)45 s,72℃延伸45 s,共35个循环;72℃延伸10 min;PCR产物经1.5%琼脂糖凝胶电泳进行检测。

表1 耐药基因检测引物信息
运用PCR法检测分离菌部分毒力基因,参照朱成科等[8]所示的毒力基因,它们分别为气溶素(Aer)、溶血素(Hly)、黏附素(Aha)、外膜蛋白(OmpA)4种毒力基因。以分离菌DNA为模板,设计引物送至生工生物工程(上海)股份有限公司合成,引物信息见表2;反应体系与条件同1.4;PCR产物用1.5%琼脂糖凝胶检测结果。

表2 毒力基因检测引物信息
2 结果
2.1 细菌分离培养结果 从外观为鱼鳃暗红、体表出血点、肛门红肿外翻和剖检出现肝脏肿大,腹中积水严重的杂交鲟中,分离细菌接种在BHI培养基,置于30℃培养24 h,分离得一优势菌株,观察出现边缘整齐、中间隆起、表面湿润、乳白色透明的菌落,用血平板培养基培养,该菌菌落出现β溶血圈(见中插彩版图1中A);经革兰染色,镜检观察所见:该菌为革兰阴性菌,菌体形态为两端钝圆的短杆菌(见中插彩版图1中B)。
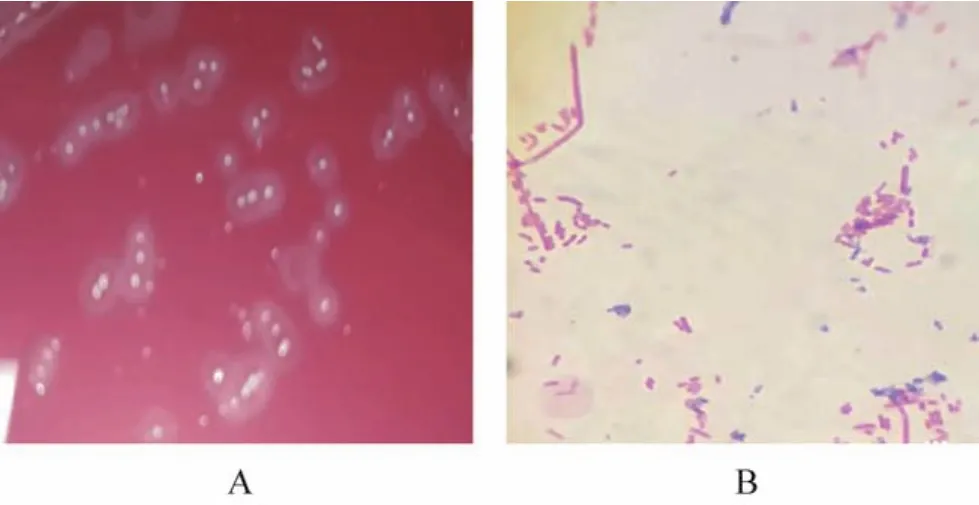
图1 细菌血平板培养和革兰染色图
2.2 分离菌生化鉴定 分离菌生化鉴定结果见表3,分离菌鉴定结果结合革兰染色和细菌形态特征,参照《常见细菌系统鉴定手册》初步将分离菌鉴定为维氏气单胞菌。
2.3 分离菌16S rDNA扩增测序以及系列分析结果以分离菌DNA为模板,用设计的16S rDNA通用引物,进行PCR扩增,PCR产物用1.5%琼脂糖凝胶电泳检测,得1 500 bp左右的基因条带,与预计扩增条带一致;用PCR产物16S rDNA进行测序,得序列长度为1 477 bp,提交该序列于GenBank,并对此序列进行BLAST比对分析;结果显示,分离菌的16S rDNA序列与GenBank中的A.Veronii序列相似度达99.00%(见图2);用Gema7.0软件建立系统发育树,发现分离菌与多株维氏气单胞菌聚在同一进化分支上;综合分离菌形态特征与生化结果,可确定该分离菌为维氏气单胞菌。

表3 分离菌生化鉴定
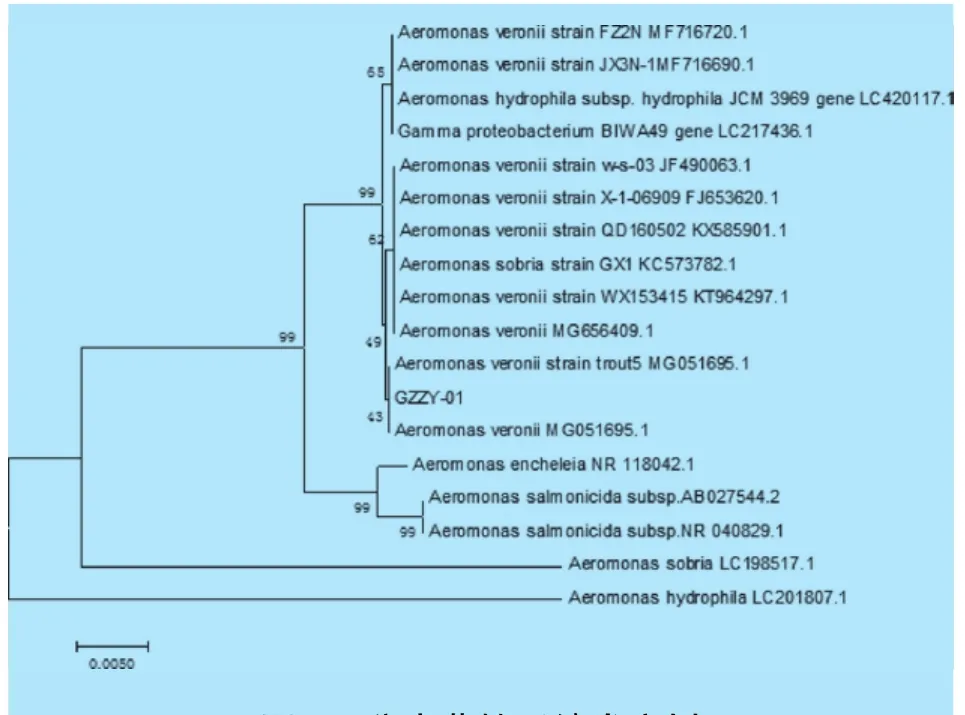
图2 分离菌株系统发育树
2.4 分离菌动物回归试验 注射菌悬液后的试验组小鼠,初见小鼠离群单呆;观察7 d,试验组在48 h后开始出现小鼠死亡,到第7天时试验组小鼠死亡4只,致死率达80%;对照组小鼠无明显变化。对死亡小鼠进行剖检,发现肝脏肿大,腹腔积液,这些现象是维氏气单胞菌引起的典型病变,后从死亡小鼠体内分离出菌株,经生化鉴定与分离菌生化指标变化相符,动物回归试验结果说明该菌株有较强致病性。
2.5 分离菌药敏试验结果 选用14种常用抗生素药物对分离菌进行药敏试验,试验结果如表4,分离菌对环丙沙星、对氟苯尼考、头孢哌酮、新霉素4种抗生素有较高的敏感;对多粘菌素B、哌拉西林、克林霉素、羧苄西林、红霉素有中度敏感程度;剩余抗生素药物表现出耐药。
2.6 分离菌耐药性基因与毒力基因检测结果PCR产物用琼脂糖凝胶电泳检测耐药基因,检测结果见图3,耐药基因阳性条带有耐磺胺基因两条(Sul1,Sul2),Ⅰ类整合子(Intl1)基因一条,未见扩增出氟苯尼考耐药基因(FxeA)条带,所出现阳性基因条带大小与预测出现基因条带大小相符,分离菌含有耐药基因Sul1(163 bp)、Sul2(191 bp)、Intl1(146 bp)3种耐药基因。
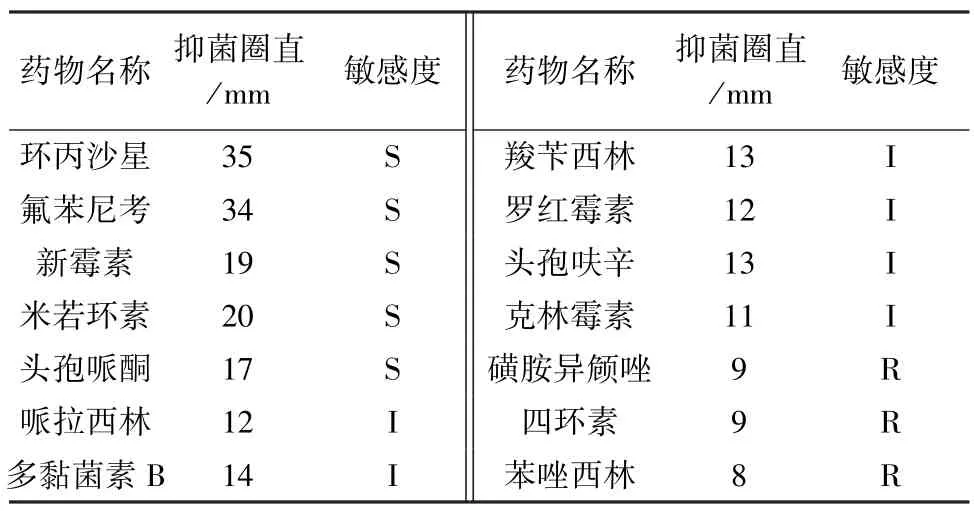
表4 药敏试验结果

图3 耐药性基因PCR扩增结果图
通过PCR检测致病性基因,结果显示,该株毒力基因阳性条带为气溶素(Aer)和粘附素(Aha)两种基因,出现基因条带大小结果与预测基因条带大小一致;未检出溶血素(HIy)与外膜蛋白(OmpA)毒力基因;结果见图4,得出分离菌含有Aer(417 bp)和Aha(998 bp)毒力基因。
3 讨论
1983 年维氏气单胞菌首次被法国微生物学家发现,它的发现是从溺水身亡者的呼吸道分泌物中分离得到[9],我国首次报道分离出维氏气单胞菌,由崔树玉等[10]在1989年从黑鱼中分离鉴定发现该菌,后续中,相续报道维氏气单胞菌引起中华绒螯蟹、斑点叉尾鮰、鳗鲡、西伯利亚鲟等水产动物发病[11-13],可见维氏气单胞菌能够引起多种水生动物发病。前人已有报道西伯利亚鲟感染维氏气单胞菌发病的病例,并有鱼鳃发白的症状,本试验从发病杂交鲟中分离出维氏气单胞菌病原,发病占未见鱼鳃发白显现;这一点能说明:维氏气单胞菌引起同种间不同品系的水产动物发病,但出现的症状不尽相同,这可能是品系、水生环境、菌株间差异的不同,而出现的结果。
图4 毒力基因PCR扩增结果图
关于耐药基因的检测:磺胺类药物在水产动物养殖中,是广谱抗生素,具有抑菌效果好的特点,所以在水产养殖业中得到广泛的推广使用,而滥用容易出现耐药现象。I类整合子可存在质粒、转座子等移动基因原件上,细菌之间移动基因之间的交接转换,是细菌获得多重耐药性的重要原因;耐磺胺类药物的抗性形成,跟Ⅰ类整合子有很密切的关系[14],药敏试验结果显示,分离菌出现耐磺胺类药物,可能是分离菌携带Sul1、Sul2、Intl1三种耐药基因,与本地养殖户应用磺胺类药物不当的原因。
维氏气单胞菌的致病性与其所携带的毒力基因存在很大的关系。气溶素(Aer)具有溶血性、细胞毒性、肠毒性等特点,是引起β溶血现象的毒力基因,它具有破坏细胞膜的通透性,引起多种内脏与体表广泛性出血的功能;又是维氏气单胞菌主要毒力因子之一[15]。血溶素(HIy)毒力因子具有能溶细胞活性,诱导细胞死亡的生物学功能[16]。膜蛋白(OmpA)毒力因子具有抗吞噬,抗补体的作用,这很有利于维氏气单胞菌逃避机体免疫清除[17]。粘附素(Aha)毒力因子在维氏气单胞菌感染中起到吸附定植于动物机体细胞上的作用,有观点称Aha毒力因子是引起体表溃烂的原因之一[18]。本试验检测Aer、HIy、OmpA和 Aha四种毒力基因,对分离菌进行毒力基因检测,结果显示,分离株携带Aer、Aha两种毒力基因。患病杂交鲟中出现体表出血、肛门红肿外翻的症状和培养于血平板上出现β溶血现象,可能是分离株携带Aer毒力基因引起的。分离菌携带Aha毒力基因,而通过观察未见患鲟体表溃烂的症状,出现这种结果,可能是基因的表达受多种因素制约。杂交鲟还出现严重腹水的症状,但未见资料表明由某个特定毒力基因诱发;这种现象,可能是分离菌致病性是多种毒力因子共同协调作用的结果。
关于药敏试验:在此试验前已有多人对维氏气单胞菌进行药敏试验,曹恒源[19]等对圆口铜鱼维氏气单胞菌进行药敏试验结果显示,圆口铜鱼维氏气单胞菌对四环素、氟苯尼考、诺佛沙星等药物敏感,胡天野[20]等框镜鲤维氏气单胞菌药敏研究结果显示,框镜鲤维氏气单胞菌对四环素,庆大霉素,青霉素有较高的抑菌效果;本试验药敏结果显示,分离菌对环丙沙星、氟苯尼考、头孢哌酮、新霉素4种抗生素敏感,对磺胺异恶唑、四环素、苯唑西林3种药物耐受;本试验药敏结果分离菌对四环素耐受,与曹恒源、胡天野药敏报道的结果不一致,这可能跟养殖品种、养殖环境、及养殖方式的不同而见的结果;故今后在此病的防治过程中,最好从患病水产动物体内分离菌株,并进行药敏试验,根据药敏试验结果,结合药物吸收特性,选择敏感高与吸收率强的药物进行安全给药。

