瞬时电位受体通道TRPA1/TRPV1在烟草致气道上皮细胞损伤中的作用
王沐昀,徐蒙蒙,李 锋,张 海,陈宇清,闫雪波,张妍蓓
氧化应激是慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)的重要发病机制之一[1]。活性氧(reactive oxygen species,ROS)可能来自香烟烟雾,是COPD最重要的危险因素[2]。瞬时电位受体离子通道(transient receptor potential, TRP)是一类离子通道蛋白,位于细胞膜。TRP通道是Ca2+渗透性阳离子通道,它通过直接允许Ca2+流入细胞以应对各种刺激,或使膜电位去极化来调节细胞功能[3]。其中,TRPA1和TRPV1在炎症形成和组织损伤中发挥主要作用[4-5]。线粒体是细胞内ROS的主要来源,参与COPD的发病机制[6]。线粒体的结构和功能受其分裂/融合过程的调控[7]。线粒体分裂由动力相关蛋白1(dynamin-related protein 1, DRP1)和线粒体裂变因子(mitochondrial fission factor,MFF)蛋白调控,而线粒体融合由线粒体融合蛋白1(mitofusions 1,MFN1)和线粒体融合蛋白2(mitofusions 2,MFN2)及视神经萎缩蛋白1(optic atrophy 1,OPA1)蛋白调控[8]。线粒体的功能除了产生ROS,还可以调节细胞氧化还原信号通路、细胞增殖和凋亡、先天和适应性免疫应答包括核苷结合寡聚结构域类似受体3[nucleotide-binding oligomerization domain(Nod)-like receptor 3,NLRP3]炎性小体[5]。NLRP3炎性小体含有NLRP3受体、适配器蛋白即凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing,ASC)和半胱氨酸蛋白酶-1(cysteinyl aspartate-specific proteinases,Caspase-1)。该研究拟通过建立香烟烟雾提取物(cigarette smoke extract,CSE)诱导的气道上皮损伤模型,探讨TRPA1/TRPV1在该模型中的作用及机制。
1 材料与方法
1.1 材料人支气管上皮细胞系Beas-2b细胞购自中国科学院上海生命科学研究院;1640培养基购自美国Hyclone公司;胎牛血清购自以色列BioInd公司;100 U/ml青霉素和链霉素100 μg /ml购自美国Thermo Fisher Scientific公司;万宝路香烟购自龙岩烟草工业有限公司;TRPA1抑制剂(A967079、AMG9810购自美国Abcam公司;细胞增殖/毒性检测试剂盒 Cell Counting Kit-8(CCK-8) 购自日本东仁公司;DCFH-DA (D6883)购自美国Sigma-Aldrich公司;MitoSOX Red 购自美国Invitrogen公司;蛋白浓度测定试剂盒、Fluo-4 AM (钙离子荧光探针,2 mg/ml)和蛋白裂解液RIPA购自南京碧云天公司;TRIzol试剂、Prime ScriptTM RT Master Mix Kit、Power Green qPCR Mix 购自大连TaKaRa公司;DRP1、 MFF、OPA1、 MFN2、NLRP3、Caspase-1和β-Tubulin抗体、HRP标记的山羊抗兔IgG二抗购自美国Cell signaling Technology公司。
1.2 方法
1.2.1细胞培养 Beas-2b细胞接种于无菌培养瓶中,将培养瓶置于37 ℃、5% CO2、95%相对湿度的培养箱中孵育,细胞单层贴壁生长。实验取生长状态良好的对数生长期细胞,以0.25%胰酶消化传代收集。
1.2.2CSE的制备 采用万宝路香烟,去除过滤嘴后点燃,用气体采样管 (大包氏管) 采集香烟主流烟雾,2个串联的大包氏管内各装有5 ml无血清的 DMEM 培养基作为吸收液,端连接香烟,另一端连接50 ml注射器,以50 ml/min的速度抽吸香烟2支、 每支烟抽吸10次,然后将该溶液调整pH值为7.40并用直径0.22 μm 滤膜过滤,去除细菌和颗粒,制备成100% CSE,30 min内用于实验。
1.2.3细胞分组 体外培养支气管上皮细胞Beas-2B细胞,分为空白组、CSE组、A967079(100 μmol/ml )+CSE组、AMG9810(100 μmol/ml +CSE组、A967079(100 μmol/ml)+AMG9810(100 μmol/ml)+CSE组。
1.2.4细胞增殖实验 取对数生长期的 Beas-2B细胞,调整细胞浓度至5×104个/ml,取100 μl种于96孔板,每组设6个复孔。待细胞贴壁后,分别在每孔加入CSE、CSE+抑制剂, 96 孔板四周孔用培养基填充,96 孔板置于5% CO2、37 ℃ 培养箱中培养 24 h 后,每孔加入10% CCK-8溶液,继续培养2 h后,用酶标仪测定96孔板在450 nm处的光密度(optical delnsity,OD)值即OD450 nm。
1.2.5Ca2+检测实验 细胞接种到96孔的黑色板中,密度为5×104/ml,每组6个复孔。抑制剂实验组是使用抑制剂预处理1 h后,所有实验组接受CSE处理2 min。PBS清洗后加入5 μm Fluo-4,避光孵育30 min。PBS清洗3次,使用Flexstation®2 fluorescence plate reader在OD488/516 nm检测OD值,并使用荧光显微镜拍照。
1.2.6氧化应激检测 使用DCFH-DA检测细胞内ROS的生成,细胞接种到96孔的黑色板中,密度为5×104/ml,每组6个复孔。分别在每孔加入CSE、CSE+抑制剂,24 h后,加入10 μm DCFH-DA 在37℃温箱中避光孵育15 min,无血清1640清洗3次,在488/525 nm测定OD。 使用Mito SOX RED检测线粒体氧化应激, 细胞接种到96孔的黑色板中,密度为5×104/ml,每组6个复孔。分别在每孔加入CSE、CSE+抑制剂,24 h后,加入5 mmol/L MitoSOX Red 探针,在37 ℃温箱中避光孵育10 min,PBS清洗3次,在OD510/580 nm处测定OD值和荧光显微镜拍照。
1.2.7qRT-PCR实验 检测抗氧化酶[血红素加氧酶1(heme oxygenase 1,HO-1);醌氧化还原酶1(NAD(P)H:quinoneoxidoreductaseNQO1:EC1.6.99.2,NQO1);锰超氧化物歧化酶(manganese superoxide dismutase,MnSOD);过氧化氢酶(catalase,CAT)]和炎症因子[白细胞介素-8(interleukin-8,IL-8)、IL-1β、IL-18、IL-33]的mRNA水平。将各组细胞1×107,取1 ml TRIzol抽提细胞总RNA。利用TAKARA Prime Scirpt逆转录试剂盒将RNA逆转录成cDNA。实时定量PCR按SYBRII Premix Ex TaqTM(TAKARA)试剂盒说明书操作。引物序列见表1。

表1 抗氧化酶和炎症因子的引物序列
1.2.8Western blot实验 将各组细胞1×107加入蛋白裂解液,BCA定量法计算蛋白的浓度。取30 μg总蛋白进行凝胶电泳(恒压 100 V),检测细胞中、线粒体分裂蛋白(DRP1 和 MFF)、线粒体融合蛋白(OPA1和MFN2)、NLRP3、Caspase-1 的蛋白表达情况, 以β-tubulin 作为内参,用 Image J 软件进行相关灰度值分析。
1.3 统计学处理采用 SPSS 22.0软件进行统计分析,多组间比较采用单因素方差分析。统计、制图使用GraphPad Prism 6.0软件。假设检验水准按α=0.05 判定,P<0.05为差异有统计学意义。
2 结果
2.1 抑制剂预处理可减轻CSE对细胞增殖和细胞内Ca2+水平的影响与空白对照、5% CSE、10% CSE相比,15% CSE刺激导致细胞增殖明显降低,因此选择10% CSE进行后续试验(98.31±36.44,F=32.48)。在10% CSE与细胞共培养的情况下,A967079、AMG9810、A967079+AMG9810对细胞增殖无明显的影响,各指标每组间差异无统计学意义(F=2.034,P>0.05)。10% CSE刺激对细胞内Ca2+内流的影响具有时间依赖性,并且在2 min达到峰值。表明CSE刺激可以激活细胞内钙通道,显著增强细胞内Ca2+内流,A967079(98.45±8.17)、AMG9810(96.72±8.17)、A967079+AMG9810(92.77±9.95)显著降低细胞内Ca2+水平(F=14.99,P<0.001,P<0.001,P<0.001),各指标每组间差异有统计学意义。见图1。
2.2 抑制剂预处理可减轻CSE对细胞内ROS和线粒体ROS的影响10% CSE刺激导致细胞内ROS水平升高(164.64±4.89,P<0.001)。A967079(113.37±5.89)、AMG9810(118.02±4.99)、A967079+AMG9810(103.69±7.53)抑制细胞内ROS水平(P<0.001,P<0.001,P<0.001),各指标每组间差异有统计学意义(F=78.77)。10% CSE刺激增加线粒体ROS水平(137.88±8.64,P<0.001)。A967079(122.79±3.17)、AMG9810(121.79±4.61)、A967079+AMG9810(118.44±4.99)均可抑制细胞内线粒体ROS水平(P<0.01,P<0.01,P<0.001),各指标每组间差异有统计学意义(F=25.84)。见图2。
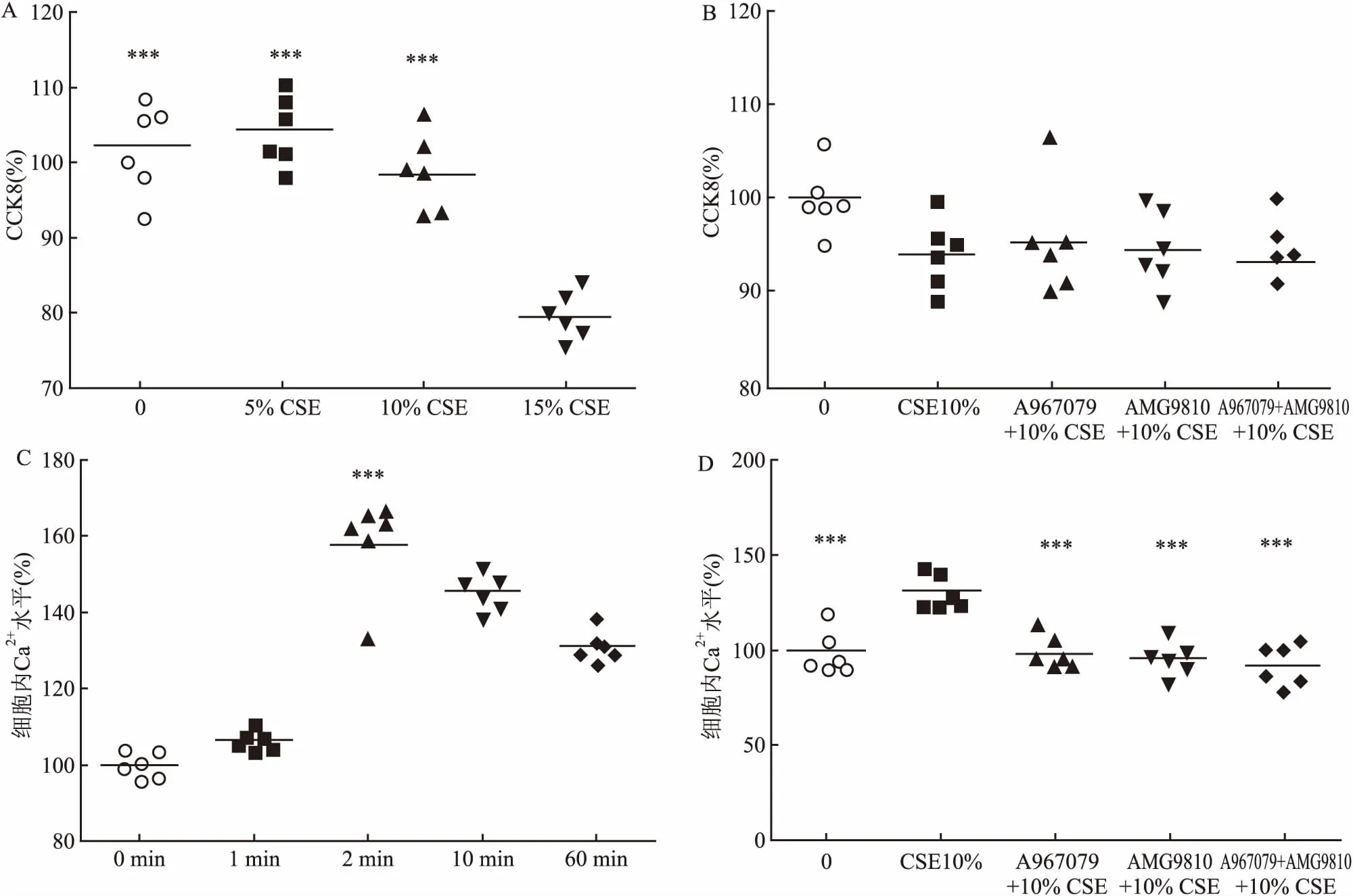
图1 抑制剂预处理可减轻CSE对细胞增殖和细胞内Ca2+水平的影响
A: 不同浓度CSE刺激对细胞增殖的影响;与15% CSE组比较:***P<0.001;B:10% CSE、抑制剂对细胞增殖的影响;C:10% CSE引起不同时间点Beas-2b细胞内Ca2+浓度变化;与0 min组比较:***P<0.001;D:抑制剂对10% CSE诱导的2 min时细胞内Ca2+水平的影响;与10% CSE组比较:***P<0.001
2.3 抑制剂预处理可减轻CSE对抗氧化酶mRNA表达的影响10% CSE刺激降低细胞的HO-1、NQO1和CAT 的mRNA表达(P<0.05,P<0.05,P<0.01)。A967079增加NQO1和CAT mRNA表达(P<0.001,P<0.001)。AMG9810增加CAT mRNA(P<0.001)。A967079+AMG9810增加HO-1、NQO1、MnSOD mRNA表达(P<0.001,P<0.001,P<0.001),各指标每组间差异有统计学意义(FHO-1=28.72,FNQO1=57.41,FMnSOD=35.4,FCAT=31)。见图3。
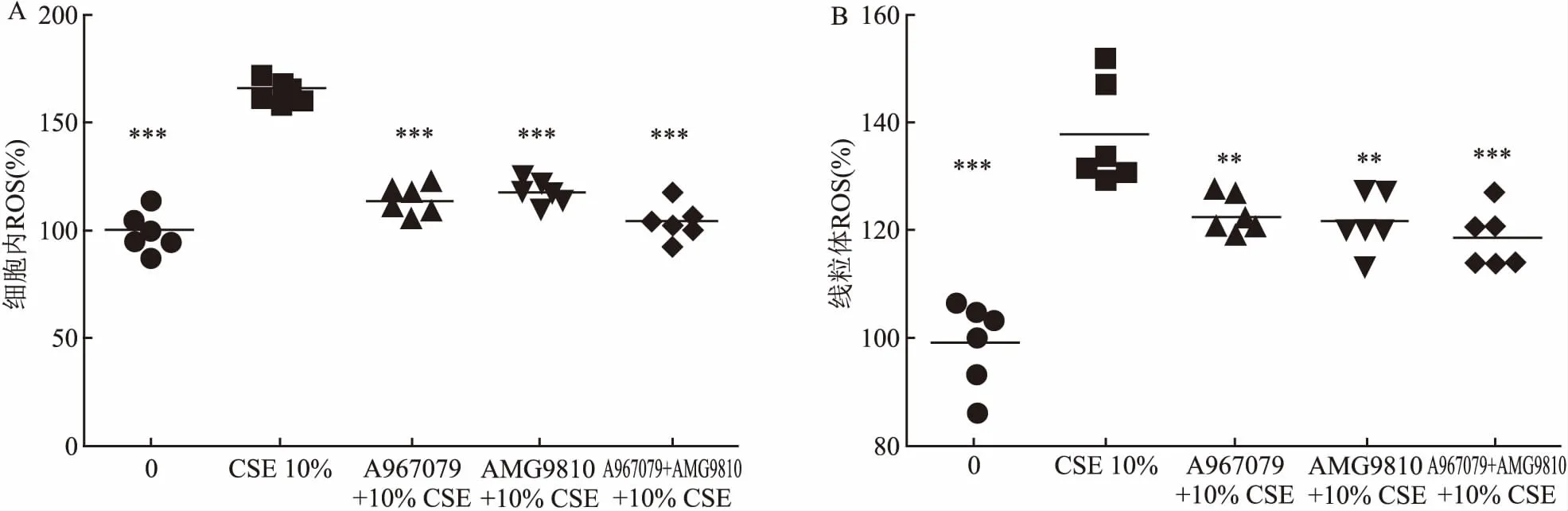
图2 抑制剂预处理可减轻CSE对细胞内ROS和线粒体ROS的影响
A:10% CSE对细胞内ROS水平的影响及抑制剂的干预效应;B:10% CSE对线粒体ROS水平的影响及抑制剂的干预效应;与10% CSE组比较:**P<0.01,***P<0.001
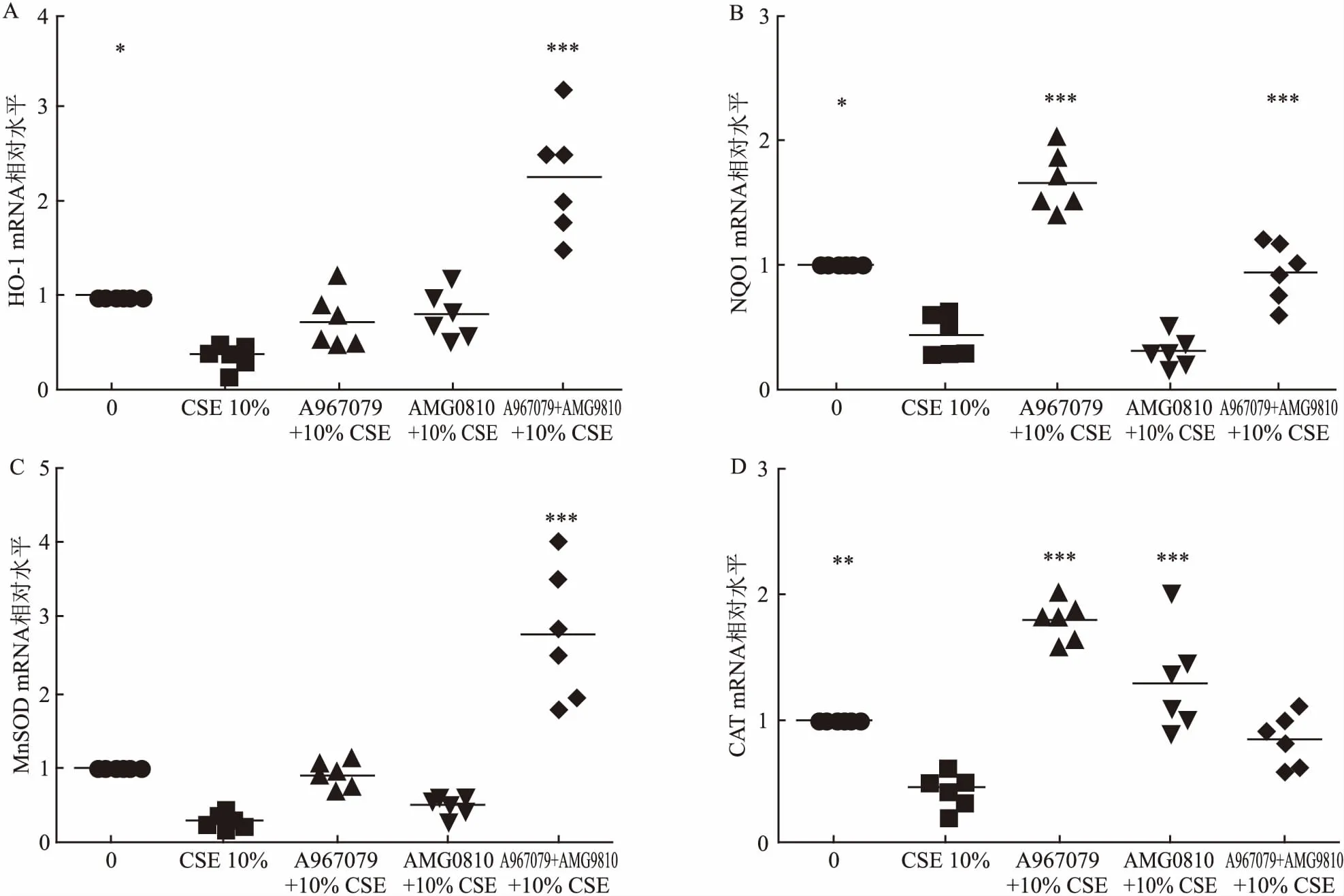
图3 抑制剂预处理可减轻CSE对抗氧化酶mRNA表达的影响
A:10% CSE对细胞HO-1的mRNA表达的影响及抑制剂的干预效应;B:10% CSE对细胞NQO1的mRNA表达的影响及抑制剂的干预效应;C:10% CSE对细胞MnSOD的mRNA表达的影响及抑制剂的干预效应;D:10% CSE对细胞CAT 的mRNA表达的影响及抑制剂的干预效应;与10% CSE组比较:*P<0.05,**P<0.01,***P<0.001
2.4 抑制剂预处理可减轻CSE对炎症因子mRNA表达的影响10% CSE刺激增加细胞的IL-8、IL-1β、IL-18、IL-33 mRNA表达(P<0.001,P<0.01,P<0.001,P<0.001)。A967079降低细胞的IL-1β、IL-18、IL-33 的mRNA表达(P<0.001,P<0.05,P<0.05),AMG9810降低细胞的IL-8、IL-18、IL-33 的mRNA水平(P<0.001,P<0.001,P<0.001)。A967079+AMG9810降低细胞的IL-1β、IL-18、IL-33的mRNA表达(P<0.001,P<0.001,P<0.001),各指标每组间差异有统计学意义(FIL-8=28.72,FIL-1β=57.41,FIL-18=35.4,FIL-33=31),见图4。
2.5 抑制剂预处理可减轻CSE对线粒体分裂/融合蛋白表达的影响线粒体分裂/融合蛋白的代表性图见图5。10% CSE刺激增加DRP1、MFF的蛋白表达,减少OPA1蛋白表达(1.38±0.20,1.67±0.33,0.80±0.07,P<0.05,P<0.001,P<0.01)。A967079减少DRP1、MFF蛋白(0.81±0.07,0.74±0.19,P<0.01,P<0.001),增加MFN2蛋白(1.45±0.41,P<0.05),AMG9810减少MFF蛋白(0.75±0.23,P<0.001),增加MFN2蛋白(1.38±0.30,P<0.05),A967079+AMG9810减少DRP1、MFF蛋白(0.86±0.12,0.68±0.13,P<0.05,P<0.001),增加OPA1、MFN2蛋白(1.46±0.38,1.43±0.29,P<0.05,P<0.05),各指标每组间差异有统计学意义,见图5。
2.6 抑制剂预处理可减轻CSE对NLRP3炎症小体的影响10% CSE刺激增加NLRP3、Caspase-1蛋白表达(P<0.001,P<0.05)。A967079降低NLRP3蛋白(0.89±0.06,P<0.05),AMG9810降低Caspase-1蛋白(1.08±0.16,P<0.05)。A967079+AMG9810降低NLRP3、Caspase-1蛋白(P<0.001,P<0.01)。各指标每组间差异有统计学意义(0.81±0.07,0.99±0.19,FNLRP3=11.08,FCaspase-1=5.629),见图6。
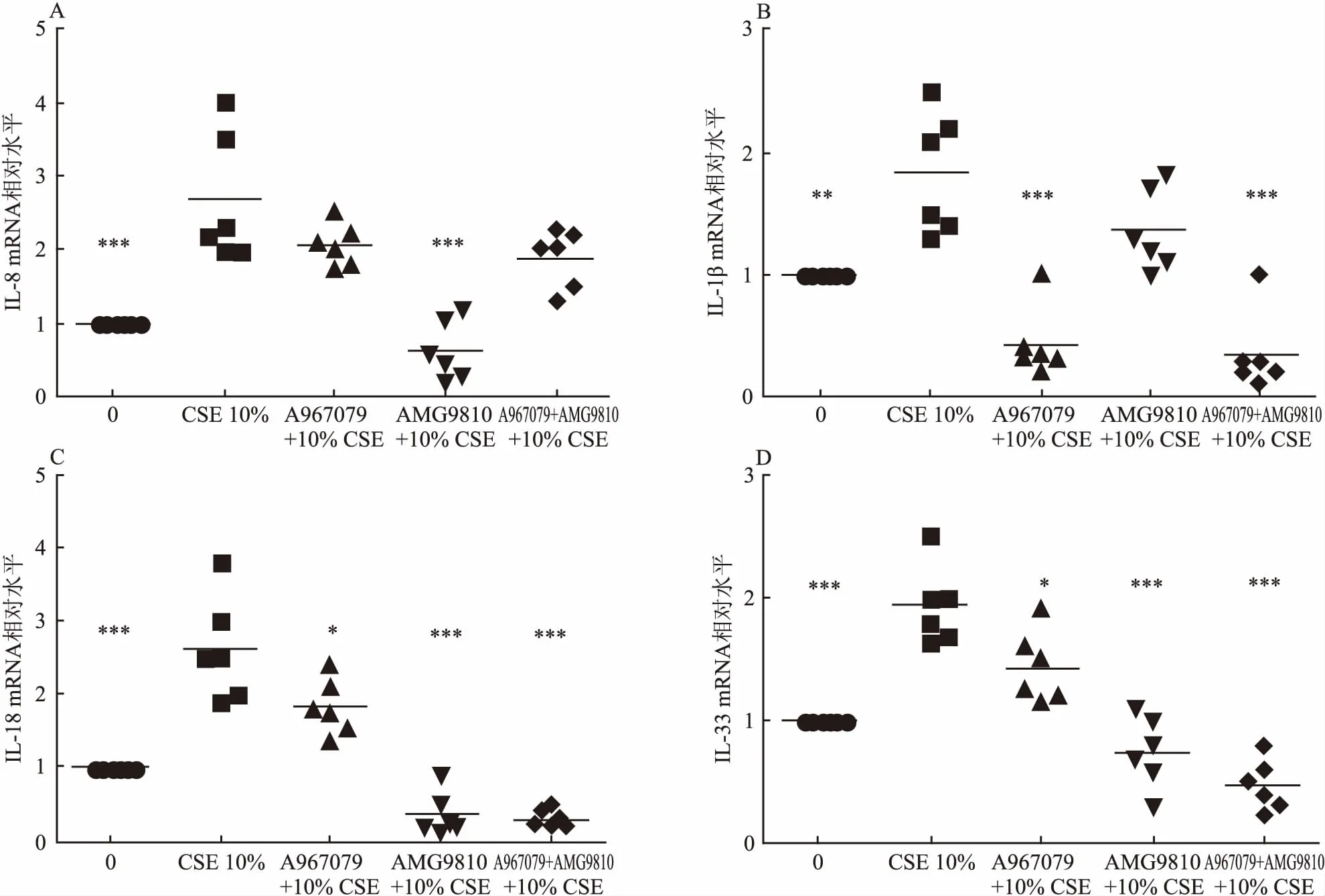
图4 抑制剂预处理可减轻CSE对炎症因子mRNA表达的影响
A:10% CSE对细胞IL-8的mRNA表达的影响及抑制剂的干预效应;B:10% CSE对细胞IL-1β的mRNA表达的影响及抑制剂的干预效应;C:10% CSE对细胞IL-18的mRNA表达的影响及抑制剂的干预效应;D:10% CSE对细胞IL-33的mRNA表达的影响及抑制剂的干预效应;与10% CSE组比较:*P<0.05,**P<0.01,***P<0.001
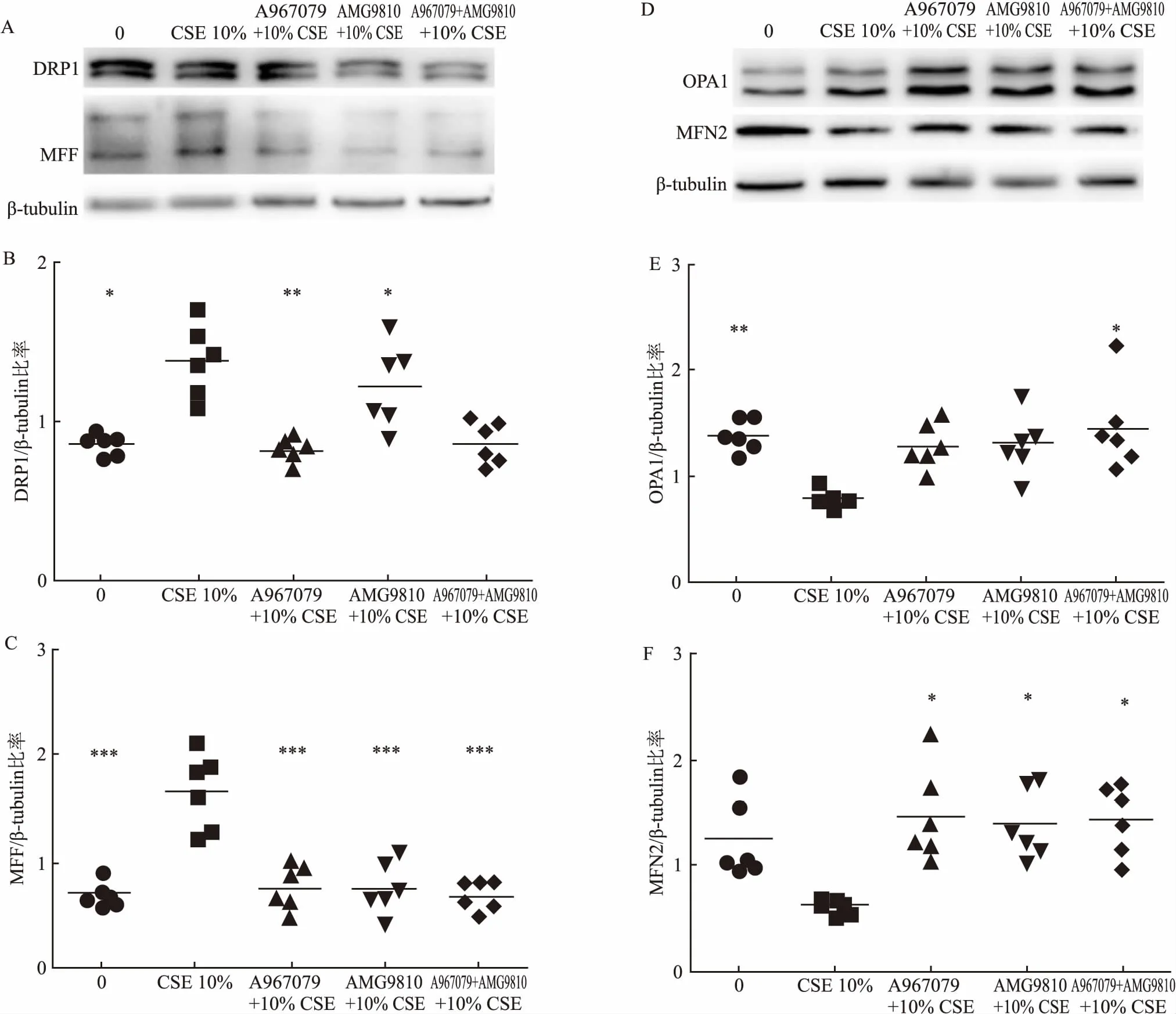
图5 10% CSE对细胞DRP1、MFF、OPA1、MFN2的蛋白表达的影响及抑制剂的干预效应
A:10% CSE对细胞DRP1、MFF 蛋白表达的影响及抑制剂的干预效应蛋白应激图;B: 10% CSE对细胞DRP1蛋白表达的影响及抑制剂的干预效应;C: 10% CSE对细胞MFF蛋白表达的影响及抑制剂的干预效应;D: 10% CSE对细胞OPA1,MFN2 蛋白表达的影响及抑制剂的干预效应蛋白应激图;E: 10% CSE对细胞OPA1蛋白表达的影响及抑制剂的干预效应;F:10% CSE对细胞MFN2蛋白表达的影响及抑制剂的干预效应;与10% CSE组比较:*P<0.05,**P<0.01,***P<0.001
3 讨论
本研究证实烟雾暴露引起气道上皮细胞的损伤,表现为细胞内氧化应激、线粒体损伤和炎症反应。在Beas-2b细胞中,CSE培养诱导Ca2+内流,增加细胞内和线粒体ROS,降低抗氧化酶mRNA表达,增加炎症因子mRNA表达,介导线粒体分裂/融合蛋白的失平衡,即线粒体分裂蛋白增加,线粒体融合蛋白减少。同时CSE增加NLRP3和Caspase-1的表达水平。单独应用或联合TRPA1、TRPV1抑制剂可以减少细胞内氧化应激、线粒体损伤以及下游炎症反应,预防线粒体分裂/融合蛋白的失平衡,下调NLRP3炎症小体,其中联合使用效应好于单独使用。以上结果表明TRPA1和TRPV1通路在烟雾诱导气道上皮细胞损伤模型中发挥重要的作用。
氧化应激反应是烟雾暴露诱导上皮细胞损伤的主要机制之一。它是细胞中氧化还原平衡相对于抗氧化状态转移到促氧化状态的一种情况,可能是与氧化剂种类的增加或自由基清除剂以及抗氧化酶水平的降低有关[9]。在Beas-2b细胞中,CSE共培养诱发线粒体ROS和细胞内ROS产生过量,这一现象与CSE共培养降低Beas-2b细胞中抗氧化酶mRNA水平有关。A967079、AMG9810、A967079+AMG9810均可降低CSE引起的细胞内和线粒体ROS升高。同时, A967079、AMG9810、A967079+AMG9810可以增加细胞内抗氧化酶表达mRNA水平。本研究表明TRPA1和TRPV1通道在烟雾暴露诱导肺部细胞的氧化应激反应过程中发挥重要的作用。这一过程可能与CSE诱导的细胞内Ca2+内流增加有关,抑制TRPA1/TRPV1通道可抑制细胞内的Ca2+内流。
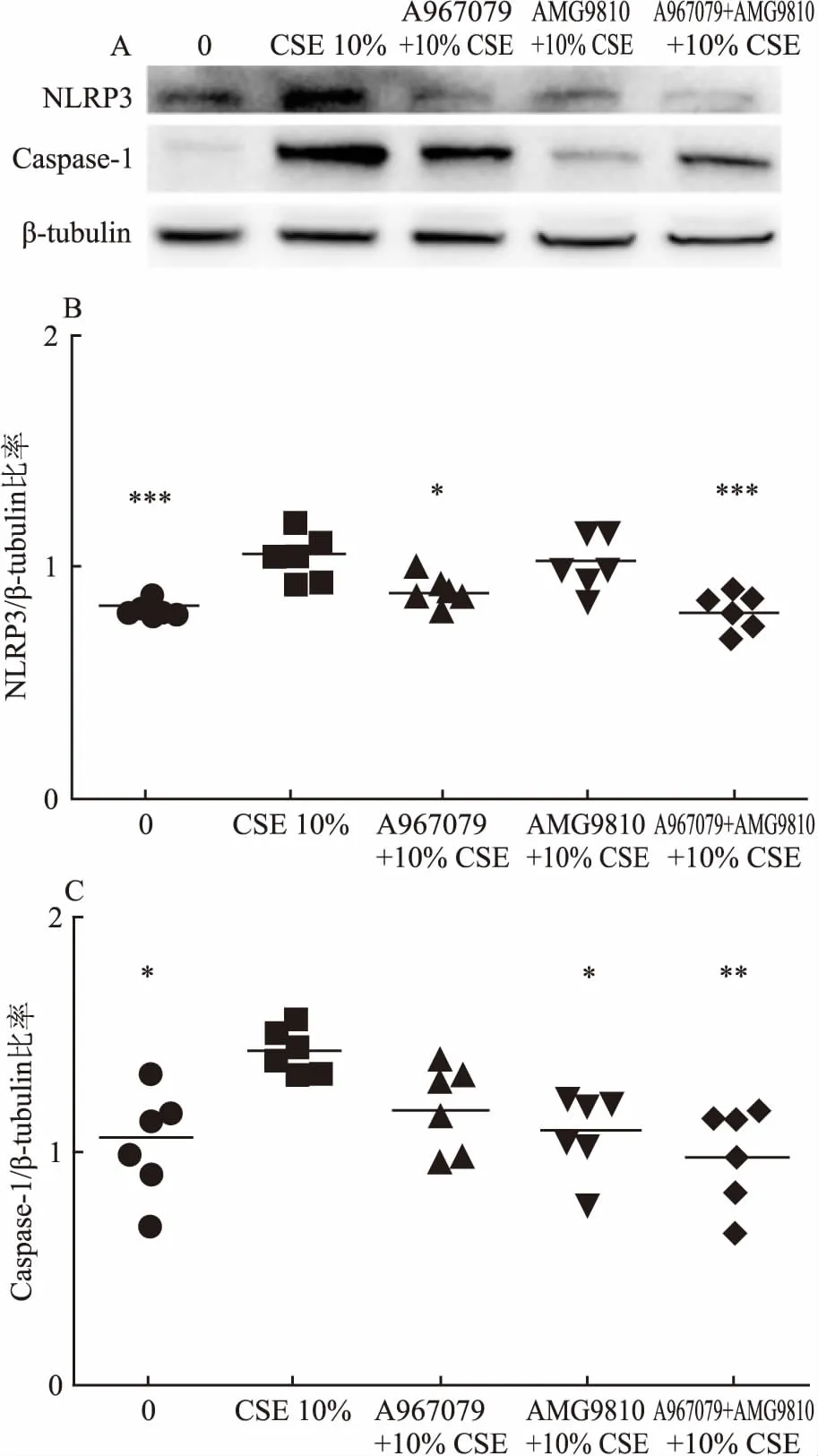
图6 10% CSE对细胞NLRP3、caspase-1的蛋白表达的影响及抑制剂的干预效应
A:10% CSE对细胞NLRP3、Caspase-1 蛋白表达的影响及抑制剂的干预效应蛋白应激图;B: 10% CSE对细胞NLRP3蛋白表达的影响及抑制剂的干预效应;C: 10% CSE对细胞Caspase-1蛋白表达的影响及抑制剂的干预效应;与10% CSE组比较:P<0.05,**P<0.01,***P<0.001
COPD[10]和哮喘[11]患者均存在气道上皮细胞线粒体功能异常,进而导致线粒体外膜渗透,凋亡蛋白释放,最终导致细胞死亡。在本研究中,CSE使Beas-2b细胞内的线粒体分裂/融合蛋白失衡,这种获得性线粒体功能障碍可能在COPD的发展中发挥重要作用,而A967079、AMG9810、A967079+AMG9810可以部分或完全地预防CSE诱导的线粒体分裂/融合蛋白失平衡。表明烟草暴露会通过TRPA1/TRPV1通路影响线粒体结构,进而损害气道上皮细胞的线粒体功能。本研究表明,CSE介导细胞内和线粒体氧化应激、诱发线粒体结构和功能障碍,这两者之间可能互为因果,相互影响。
体外研究[12]显示,在肺泡上皮细胞(A549细胞)和支气管上皮细胞中,ROS导致炎症介质基因表达增加。ROS作用于TRPA1和TRPV1通道激活NLRP3,刺激Caspase-1激活,从而导致IL-1β和IL-18分泌[13]。另外,NLRP3炎症小体在COPD的发病机制过程中发挥关键作用[14]。本研究中,CSE暴露增加Beas-2b细胞的炎症因子mRNA水平,增加NLRP3和Caspase-1蛋白的表达,A967079、AMG9810、A967079+AMG9810均可以部分或完全地抑制炎症因子水平,部分或完全地抑制NLRP3炎症小体通路。这表明CSE通过TRPA1/TRPV1-NLRP3炎症小体通路诱导细胞内炎症反应。抑制TRPA1/TRPV1可以抑制NLRP3炎症小体,抑制细胞内炎症反应。
本研究表明,TRPA1和TRPV1通过调控氧化应激、炎症反应和线粒体损伤而参与CSE诱导的气道上皮细胞损伤。靶向抑制TRPA1、TRPV1具有预防CSE诱导的气道上皮细胞损伤的作用。与单独抑制TRPA1或TRPV1相比,同时抑制TRPA1和TRPV1能更好地抑制CSE诱导的气道上皮损伤。

