微高压氧对脑缺血再灌注大鼠神经功能恢复及生长相关蛋白表达的影响
曹珺菲,陈 莎,徐金勇,刘方宇,李光武
近几年缺血性中风越来越频繁的出现在人们视线中[1]。有研究[2]将缺血再灌注后6 h内定为高压氧的黄金治疗时间。然而临床上错失黄金时间窗的情况屡有发生,因此探索合理延长治疗窗具有重要意义。氧增压治疗已被证实对脑缺血再灌注治疗有着潜在帮助[3]。微高压氧(micro-hperbaric oxygen, Micro-HBO)[4]是利用高压氧原理在低于临床高压氧,即1.2绝对大气压(atmosphere absolute,ATA)的高压环境下给予个体富氧环境的技术。该研究建立大鼠短暂性大脑中动脉阻塞(transient middle cerebral artery occlusion, tMCAO)模型并设置1 d和7 d的Micro-HBO干预时间,以探索最佳干预方式,并通过评定神经功能水平,观察梗死面积变化,Western blot检测生长相关蛋白43蛋白(growth associated protein-43, GAP43)含量表达,讨论Micro-HBO干预对tMCAO大鼠脑组织保护作用及与GAP43表达的关系。
1 材料与方法
1.1 实验相关试剂与设备主要实验试剂包括:2,3,5-三苯基氯化四氮唑(triphenyltetrazolium chloride, TTC)(17779-10X10ML-F)购自美国Sigma公司;RIPA裂解液;BCA蛋白定量试剂盒((P0013B, P0012S)购自上海碧云天公司;GAP43抗体(ab16053) 购自美国abcam公司;beta actin(66009-1-Ig)购自美国Proteintech,公司。设备主要有:微高压氧舱购自氧上海知元医疗科技有限公司;超高速离心机购自美国Thermo公司;全自动化学发光成像系统5200购自上海Tanon公司。
1.2 实验动物来源及分组健康SPF级雄性SD大鼠共57只饲养于(25±2)℃、湿度40%~60%环境中,由安徽医科大学实验动物中心提供。随机分为脑缺血再灌注组和假手术组(10只)。其中缺血再灌注组待清醒后根据Zea-Longa评分标准剔除0分及4分个体,并在补足分组数量后随机分为模型1 d组(10只)、模型7 d组(10只)、Micro-HBO干预1 d组(10只)、Micro-HBO干预7 d组(10只)。
1.3 tMCAO模型制作本实验参照Longa et al[5]的方式采用线栓法制作tMCAO模型。大鼠于术前12 h禁食,仅提供饮水。0.235 mm尼龙线前部涂硅胶制成线栓备用。大鼠麻醉后取仰卧位并固定,颈正中切口,钝性分离出一侧颈总动脉(common cerebral artery, CCA)、颈外动脉(external carotid artery, ECA)及颈内动脉(internal carotid artery, ICA)并挂线。结扎ECA和CCA,栓线由CCA进入大脑中动脉。自ICA和ECA分叉开始计算1.8~2 cm为最佳进线深度,稍感阻塞后停止进栓,并结扎ICA。大鼠于饲养箱中俯卧位直至苏醒。缺血2 h将线头拔至CCA处后并剪去多余线头完成再灌注。术后大鼠单笼饲养,给予充足的水和食物。假手术组大鼠仅接受CCA、ECA结扎。
1.4 Micro-HBO干预Micro-HBO组大鼠在tMCAO模型完成后于设定时间内进入微高压氧舱接受干预。其中Micro-HBO 1 d组于再灌注24 h后进入微高压氧舱接受1 h干预,Micro-HBO 7 d组自再灌注24 h后每天接受1 h微高压氧舱干预,连续7 d。微高压氧舱设定压力为1.2 ATA,氧浓度为(93±3)%。各组大鼠均在最后一次干预后24 h过量麻醉处死并取材,同一时期模型组的取材时间同干预组。
1.5 行为学评定
1.5.1Longa评定 术后1 d及7 d参照Longa 4分评定标准评估术后大鼠行为学表现。评分内容具体如下:0分:无神经功能损伤症状;1分:受损对侧前爪内收或不能完全伸展;2分:对侧追尾转圈;3分:对侧倾倒;4分:行走困难、无意识。术后仅选取1~3分个体并随机划分为不同实验组。各实验组于干预后再行评定。采用盲法评定,重复3次取均值。
1.5.2平衡木实验 将大鼠放置于长1 m,宽2 cm,距地面高度为1 m的木杆上,记录行走状态。受试个体于术前1 d学习平衡木实验,并于术后1 d及7 d正式实验。具体评分如下:0分:正常行走;1分:跌倒概率小于50%;2分:跌倒概率大于50%;3分:可维持平衡;4分:不能移动;5分:从平衡木坠落。采用盲法评定,重复3次取均值。
1.6 TTC染色及梗死灶体积百分比再灌注后1、7 d分别取每组大鼠5只,过量麻醉处死,并以生理盐水灌注后取脑,冰冻20 min至硬后弃去嗅球、小脑及脑干进行2 mm厚度冠状切片,放入2% TTC溶液中37 ℃染色30 min,红染后拍照存入计算机。使用ImageJ软件测量、计算并统计梗死灶总面积。考虑梗死侧大脑受损后可能出现水肿,因而采用对侧未受损的半脑作为对照。具体计算如下:(A-B)/A×100%,其中A为未梗死侧半脑面积,B为梗死侧红染脑区面积,全脑梗死灶总面积为各面梗死脑区面积比之和。
1.7 脑组织蛋白提取大鼠过量麻醉后断头取脑,于冰上矢状位将脑组织分为两半,取梗死侧灰色海马组织。将海马组织剪碎加入RIPA裂解液后放于玻璃研磨器中均匀研磨,并裂解30 min,12 000 r/min离心15 min后取上清液。以BAC蛋白质定量试剂盒测定浓度后调平并加入上样缓冲液。放置于-20 ℃保存。
1.8 蛋白免疫印迹检测配制SDS-PAGE凝胶,其中浓缩胶浓度为5%,分离胶浓度为10%,加入电泳液后进行上样,每孔上样量为10 μg/10 μl。80 V电泳至分离胶处后转为120 V,直到溴酚蓝至底。将凝胶上的蛋白转移至NC膜后,放入10%脱脂奶粉封闭1 h,一抗4 ℃孵育过夜,次日取出条带室温孵育二抗1 h,最后显影拍照。图片结果采用ImageJ进行灰度值计算并录入统计。
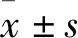
2 结果
2.1 行为学评定
2.1.1Longa评分 Longa评分主要用于评价个体神经功能水平。单因素方差分析显示,Micro-HBO 1 d组(1.60±0.44)较模型1 d天组(2.10±0.42)评分较优(F(3,36)=7.005,P<0.05)。Micro-HBO 7 d组(1.23±0.32)评分低于模型7 d组(1.77±0.52)差异有统计学意义(P<0.05)。7 d组与1 d组比较,差异无统计学意义。见图1A。
2.1.2平衡木评分结果 平衡木实验多用于检测术后感觉运动功能的恢复情况。模型1 d组(3.20±0.89)评分低于Micro-HBO 1 d组(4.03±0.62),差异有统计学意义(F(3,36)=13.079,P<0.05)。Micro-HBO 7 d组评分(4.0±0.83)较模型7 d组(5.20±0.45)评分更高(P<0.05)。7 d组在平衡木中的得分均较1 d组的分数更高(P<0.05;P<0.05)。见图1B。
2.2 TTC染色判断梗死体积百分比TTC染色结果见图2,除假手术组无梗死灶(全部红染)外,其他各组均可见不同程度的苍白色梗死灶。模型1 d组梗死灶累及海马区且梗死面积较Micro-HBO 1 d组大。模型7 d组较Micro-HBO 7 d组梗死跨度更大。对梗死面积百分比统计可见,7 d组均较1 d组个体梗死面积比更小(F(3,16)=10.57,P<0.05)。Micro-HBO干预组的梗死面积比低于模型组梗死面积比(P<0.05)。见表1。
2.3 Western blot检测Western blot检测大鼠海马内的GAP43含量见表2,假手术组的GAP43显著低于各模型组和Micro-HBO组(F(4,20)=46.959,P<0.05)。灰度值分析可以看出,1 d内的Micro-HBO组GAP43表达较模型组显著提高(P<0.05),7 d组中微高压氧组的GAP43含量也较模型组有所提升(P<0.05)。对不同时间点的大鼠海马内GAP43蛋白量分析发现,7 d组均表现出较1 d组更高的GAP43蛋白表达(P<0.05)。见图3、表2。
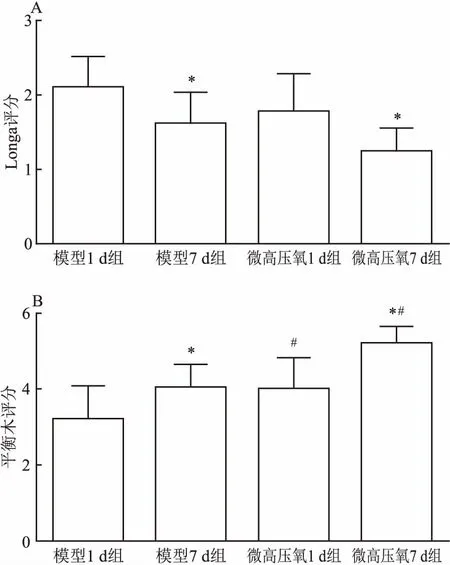
图1 各组大鼠行为学评分
A:各组大鼠longa检测后的评分;B:各组大鼠平衡木检测后评分;同一时间下模型组和Micro-HBO比较:*P<0.05 ;同一干预方式下不同时间组比较:#P<0.05

图2 各组TTC染色脑片
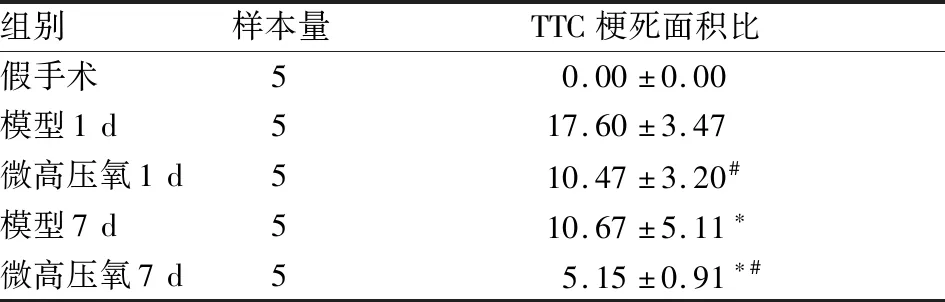
组别样本量TTC梗死面积比假手术50.00±0.00模型1d517.60±3.47微高压氧1d510.47±3.20#模型7d510.67±5.11∗微高压氧7d55.15±0.91∗#
与同一干预方式下1 d组比较:*P<0.05;同一时间下模型组和微高压氧组比较:#P<0.05
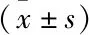
表2 各实验组大鼠海马区内GAP43蛋白表达
与假手术组比较:*P<0.05;与同一干预方式下1 d组比较:#P<0.05;同一时间下模型组和微高压氧组比较:△P<0.05

图3 不同组大鼠海马GAP43的表达
1:假手术组;2:模型1 d组;3:Micro-HBO 1 d组;4:模型7 d组;5:Micro-HBO 7 d组
3 讨论
1963年Jacobson et al[6]以狗为实验对象建立脑梗死模型并在2 ATA下应用纯氧进行干预,以氧-压结合的方式为脑缺血的治疗开启思路。高压氧对脑缺血再灌注后可能产生的脑水肿、缺血组织处自由基损伤、氨基酸代谢变化等状况有着保护和治疗作用[7]。但高压氧治疗也存在诸多问题。Rusyniak et al[8]研究表明,若梗死时长大于6 h,高压氧干预会加重症状,这可能与高压引起的血脑屏障损伤或氧化应激有关。Sánchez[7]在对多个案例回顾研究后发现,高压氧治疗中若将压力降低,则治疗时间窗可延长。因而Micro-HBO干预可能是干预tMCAO模型较为有效的方式。Dotsenko et al[9]在尝试使用1.2 ATA Micro-HBO的干预后发现,这一方式可以明显降低氧化应激反应,并在心肌缺血模型中有较好的表现。多次氧-压延迟干预也有助于缓解由于脑缺血造成的损伤,且随着干预次数增加,梗死面积减少、神经功能改善[10]。因而在1.2 ATA下Micro-HBO环境可能有助于tMCAO模型的神经功能恢复并且避免高压引起的血脑屏障损伤和氧化应激。
成年个体中的GAP43多分布于海马齿状回区9或嗅球等神经发育活跃区域并在神经的发育和损伤时特异性表达,也作为鉴别突触重塑和神经功能恢复的指标之一[11]。不同于其他用于修饰髓鞘、神经纤维等结构的蛋白,GAP43作用于突触后膜上,能特异性的参与轴突发育和修复[12],常被用作观察轴突发育和恢复的重要指标[13]。 GAP43含量在梗死后随时间增加而上升,并在梗死后7~14 d处于峰值。提升GAP43可以帮助挽救tMCAO大鼠的半暗带并改善神经功能表现,但在难以恢复的永久梗死灶中较难检测。这表明GAP43对有逆转可能的部位(如半暗带)表达明显,而对于较为严重的梗死灶表达较差。
本研究初步探索了Micro-HBO对MCAO大鼠的神经功能和GAP43表达情况。研究结果显示1 d和7 d的Micro-HBO组均较模型组有更好的神经功能表现。Micro-HBO组在感觉运动功能的恢复上较模型组更为明显,差异有统计学意义(P<0.05)。同时,模型组在1 d和7 d的平衡木评分存在差异并有统计学意义(P<0.05),可能提示大鼠的感觉运动功能有自发修复的能力。TTC染色结果显示Micro-HBO组的梗死面积百分比更低、累及脑区更少,表明Micro-HBO干预可能减小梗死脑区面积,同时这一结果也与行为学表现相互印证。Western blot检测可见模型组和手术组的GAP43含量均高于假手术组(P<0.05),证实再灌注损伤后GAP43被激活,而且在Micro-HBO干预下GAP43蛋白含量较模型组更高。表明较自然恢复的模型组,Micro-HBO干预更有助于GAP43大量激活并参与到轴突的修复和保护中。

